
- •1. История развития представлений о структуре атома. Теории Ломоносова и Дальтона. Модели атомов Томсона, Резерфорда, Бора.
- •4. Связь электронного строения атома и его валентными возможностей с положением элемента в псхэ
- •5. Определение и характеристики химической связи. Теории Бутлерова, Косселя, Льюиса. Основные виды х.С.
- •Типы связи
- •Теория химического строения Бутлерова
- •6. Ковалентная связь. Обменный донорно-акцнпторный м-зм
- •7. Ионная связь
- •9.Комплексные соединения. Д-а взаимодействием молекул. Комплексообразование. Лиганды.
- •10. Природа хим связи в комплексах. Структура и свойства комплексных соединений. Изомерия комплексов. Химическая связь в комплексных соединениях и их строение
- •17.5. Химические свойства комплексных соединений
- •17.6. Изомерия комплексных соединений
- •11. Биологические важные комплексные соединения(гемоглобин, хлорофилл, витамин в12 и т.Д.)
- •12. Использование комплексных соединений в медицине, фармецевтике, промышленности.
- •13. Микроэлементы
- •14.Микроэлементы
- •15.Макроэлементы.
- •16.Микроэлементозы.А.П. Авцин
Коллоквиум. Атом. Химическая связь. Комплексные соединения.
1. История развития представлений о структуре атома. Теории Ломоносова и Дальтона. Модели атомов Томсона, Резерфорда, Бора.
Об атомах задумывались еще древние греки. В 18 веке Ломоносов сформулировал КОРПУСКУЛЯРНУЮ ТЕОРИЮ ст-ния в-ва. Открытие фун-х законов позволило вывест важнейшиии хим понятия, которые легли в основу анато-но мол-ного учения окогчательно признанного 1860 году.
Основ положения ат-ного учения:
1)Существуют вещества с мол-ным и немол-м ст-нием
2)Между мол-ми имеются промежутки ,размеы которых зависят от тем и агр сост.
3)мол
….ТЕТРАДЬ
2.
Постулат Луи де Броля: он связал импульс движения материального объекта с длиной волны этого объекта через следующую величину.
L = h/p = h/mv, p = mv.
Функция
 не является квантовым числом, а содержит
эти квантовые числа.
не является квантовым числом, а содержит
эти квантовые числа.
Принцип неопределённости де Броля: если частица имеет макроскопические размеры, то длина волны для этой частицы сравнительно мала.
m
= 1г, v = 4 м/c,
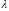 =10-21cм.
=10-21cм.
В качестве валентных выступают S и р подуровни.
3.
Правило Клечковского В.М.
Электрон заполн. Подуровень должен иметь минимально избыточной энергией по отношению к подуровню энергии.
Li 1822S1
Al18 1S22S22P63S23P63d0
K19 1S22S22P63S23P64S1
Правило Клечковского.
Заполнение идет от n+1 меньших к n+l больших
4S 3d
4+0 < 3+2 (сначала 4S, потом 3d)
2. Правило
Если суммы n+l равны друг другу, тозаполнение уровней и подуровней происходит в напр главного квантового числа k
4p
3
4+1 3+2 => сначала , потом 4p
Правило Клечковского.
Если сумма n+l равных
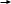 3d 4p 5S
3d 4p 5S
3+2 = 4+1 = 5+0

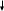 4S
4S
Явление правила проскока электронов.
Cr24 1S2 2S2 2P6 3S2 3P6 4S2 3d4
В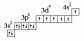 алентность
как правило определяется S и P электронами
(…..)
алентность
как правило определяется S и P электронами
(…..)
Схема заполнения уровней и подуровней по Клечковскому.
1 S2 2S2 2P6 3S2 3P6 4S2 3d10 4p6 – 5S2 – 4d10 - 5p6 –6S2 – 5d1 – 4f4 - 5d2-10 – 6p6 – 7s2 - 6d1 –5f14 - 6d2-10 – 7p6
Правило Гунда: Суммарный спин электронов на подуровне должен быть максимален, т.е. электроны на подуровне стремятся занять максимальное число свободных квантовых состояний.
Число неспор. электронов или свободных квантовых состояний определяется валентностью атома. В пределах электронного уровня электроны могут исходить с подуровня на подуровень.
s2р2=s1р3.
Валентность2 – валентность 4.
Принцип Паули.(на однлй молекулярной орбитале не может быть больше двух электр с антипаоралельными спинами).
Движение электр в молекуле рассматривается как взаимодействие.
Электронная энергия молекал есть сумма энергий орбиталей за вычетом суммы энергий межэлектронного отталкивания + сумма энергий отталкивания между ядрами.
 ф
ф
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто. Квантово-механические расчеты показывают, что в многоэлектронных энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни). Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей. Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули (принцип Паули): В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином). Используя понятия квантовые числа можно сказать, что: Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел - главного n, орбитальногоl, магнитного ml, и спинового ms. Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу: В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии). Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s - 2s -2р - 3s – 3р - 4s –3d - 4р - 5s -…. Такой порядок увеличения энергии подуровней определяет расположение эле Ментов в Периодической системе. Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г) (правило Хунда): При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов. Порядок возрастания энергии атомной орбитали в сложных атомах описывается правилом Клечковского: энергия атомной орбитали возрастает в соответствии с увеличениемn +l главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у атомной орбитали с меньшим значением главного квантового числа. Распределение электронов по различным атомным орбиталям называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям. Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронно-графических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например. Для основного состоянии атома водорода электронная формула: 1s1. Более полно строение электронных подуровней можно описать с помощью электронографических диаграмм, где распределение электронов по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны обозначают стрелками или ¯ в зависимости от знака спинового квантового числа. С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s –элементы, р-элементы, d-элементы, f-элементы.
