
- •Предисловие
- •I. Таблицы термодинамических свойств газов
- •Описание таблиц
- •Область применимости таблиц
- •Примеры пользования таблицами
- •II. Тепловая диаграмма для воздуха и продуктов сгорания данного топлива методика построения диаграммы
- •Пример построения диаграммы
- •Примеры пользования диаграммой
- •Список литературы
II. Тепловая диаграмма для воздуха и продуктов сгорания данного топлива методика построения диаграммы
При практических расчетах часто удобнее пользоваться не только таблицами, но и диаграммами. Такие диаграммы могут быть построены, если использовать соотношения, положенные в основу составления таблиц.
Для построения диаграммы для воздуха (рис. 3) по горизонтальной оси отложим температуру (например, в градусах Цельсия), а по вертикальной—энтальпию H и логарифм относительного давления lg π0, затем нанесем кривые зависимости H, lg π0 и µRT от температуры для

моля воздуха. По такой диаграмме можно производить те же расчеты, что и по Н, S-диаграмме для воздуха, причем она положительно отличается от последней своей простотой: вместо большого количества кривых, нанесенных на Н, S-диаграмму, здесь имеются две основные кривые и одна вспомогательная прямая.
Для определения адиабатных перепадов теплоты требуется лишь вспомогательная шкала, по которой можно отсчитать логарифмы степени изменения давления в адиабатном процессе lg φ. Следует заметить, что кривая логарифма относительных давлений lg π0 может быть использована для определения изменения энтропии в реальном процессе. В самом деле, для изоэнтропного процесса справедливо уравнение (5):
![]()
где e — основание натуральных логарифмов; lg e = 0,43429; µR — мольная газовая постоянная, равная 8,31441 кДж/(кмоль∙К).
Следовательно,
![]() (21)
(21)
Для изоэнтропного процесса имеем
![]() (22)
(22)
где S2s0 — значение S0 при температуре газа, соответствующей концу изоэнтропного процесса; S10 — значение S0 при температуре газа, соответствующей началу изоэнтропного процесса.
Для реального адиабатного процесса, протекающего при тех же давлениях p1 и р2 и той же начальной температуры.
![]() (23)
(23)
где S20 — значение S0 при температуре газа, соответствующей концу реального процесса.
Вычитая из уравнения (23) уравнение (22), получаем
S2 – S1 = S20 – S2s0 , (24)
т. е. изменение энтропии в реальном процессе равно разности значений S0, соответствующих температурам газа в конце реального и изоэнтропного процессов (при одинаковом отношении давлений).
Последнее равенство после подстановки значений S0 из уравнения (21) примет вид
S2-S1=19,144(lgπ 02-lgh 02s), (25)
т. е. изменение энтропии определяется через значения логарифма относительного давления.
С целью составления подобной диаграммы для продуктов сгорания данного топлива необходимо по составу этого топлива рассчитать объемный состав продуктов его сгорания при коэффициенте избытка воздуха α=1. Затем, пользуясь значениями энтальпии и логарифма относительного давления для компонентов N2, CO2, Н2O и O2, приведенными в табл. II.1—II.6, по правилу смешения следует определить H = µh и lgπ0 для продуктов рассчитанного состава при различных температурах с интервалом 50—100°С.
Имея значения энтальпии и логарифм относительного давления и для воздуха (табл. II.1) и для продукта сгорания топлива без избытка воздуха (табл. II.7), можно построить на одной диаграмме кривые H = µh и lg π0 в функции температуры для этих двух газовых смесей (воздуха и продукта сгорания) 1.
Будем теперь рассматривать газообразный продукт сгорания данного топлива с любым избытком воздуха как смесь газообразного продукта сгорания топлива при α=1 и влажного воздуха. При этом, задаваясь значениями α (например, 2, 3, 4, 5), можно определить объемную долю этого продукта сгорания при α=1 и воздуха в данной смеси. Такой расчет очень прост.
Определив теоретическое количество воздуха, необходимого для сгорания топлива L0, объем водяных паров в этом количестве воздуха и общий объем продуктов сгорания V0 при α=1 легко найти состав газов при любом значении α:
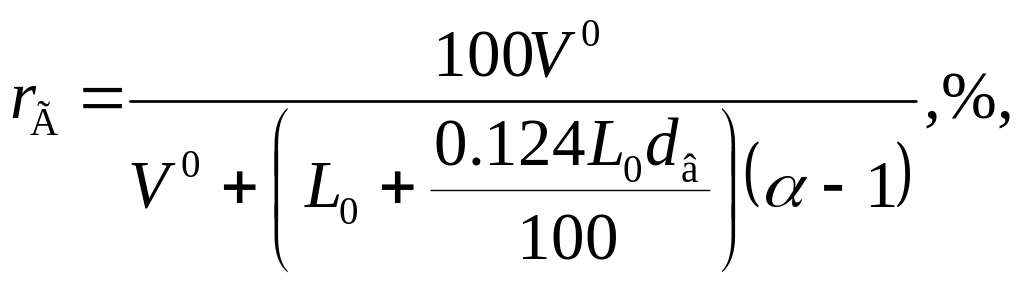
![]()
где rг— объемная доля продуктов сгорания при α = 1; rв — объемная доля воздуха; dB — количество водяных паров в граммах на нормальный кубический метр воздуха (согласно нормам расчета котлоагрегатов принято dB = 8 г/м3).
Если объемную долю воздуха в продукте сгорания топлива принять в качестве параметра, то значения энтальпии и логарифма относительного давления данной смеси определятся линейной интерполяцией между значениями этих величин для влажного воздуха и для продуктов сгорания топлива при α=1, т. е.
Н1смеси =Нв + (Hα=1 —Нв)(1— rв).
Иными словами, если интервалы между кривыми энтальпии и кривыми lg π6 для продуктов сгорания при α=1 и влажного воздуха разделить на п равных частей и соответствующие точки соединить плавными кривыми, то полученные кривые будут соответствовать продукту сгорания, содержащему 1/n, 2/п, 3/п ... объемных долей воздуха.
Практически достаточно разделить интервалы на 10 частей, чтобы интерполяция была вполне надежной. Для выбора кривой Н и кривой lgπ0, соответствующих продукту сгорания с данным избытком воздуха, достаточно нанести на диаграмму кривую зависимости rв от α, рассчитанную описанным выше способом.
Для определения молекулярной массы ц и плотности р газообразного продукта сгорания при нормальных условиях и любом значении а на диаграмму, наносят две прямые: µиρ.
В качестве примера в табл. II.7 приведены рассчитанные по правилу смешения значения энтальпии и логарифма относительного давления для продуктов сгорания ряда топлив при α=1.
Диаграмма, подобная описанной, может быть построена для продуктов сгорания любого топлива (твердого, жидкого и газообразного), в любом удобном и обеспечивающем высокую точность расчета масштабе. Использование такой диаграммы оправдывается исключительной простотой ее построения, высокой точностью и удобством пользования при практических расчетах. Диаграмма может быть рекомендована в тех случаях, когда производятся многочисленные расчеты процессов с продуктами сгорания данного топлива.




