
- •Қысқартылған сөздер тізімі
- •Химиялық лабораторияларда жұмыс істеу ережелері
- •Реактивтерді пайдалану ережелері
- •Лабораторияда жұмыс істегенде қолданылатын сақтық шаралары
- •1.1 Термодинамиканың жанды жүйелердегі негізгі заңдылықтары
- •Термодинамикалық заңдылықтарды жанды ағзаларда қолдану
- •Термодинамиканың негізгі бастамалары және заңдары
- •1.1.2 Термодинамиканың бірінші заңы
- •1.1.3 Термодинамиканың екінші заңы
- •1.1.4 Гиббс энергиясы. Гельмгольц энергиясы
- •1.1.5 Термодинамиканың үшінші заңы
- •1.2 Химиялық кинетика
- •1.2.1 Химиялық реакция жылдамдығына әрекеттесуін заттардың табиғатының әсер етуі
- •Реакция жылдамдығына катализатордың (өршіткінің) әсері
- •1.2.2 Химиялық реакциялардың кинетикалық жіктелуі
- •1.2.3 Ферменттер және олардың құрылысы туралы жалпы түсінік
- •1.3 Ерітінділер туралы ілім
- •1.4 Буферлік жүйелер мен ерітінділер туралы түсініктер, олардың құрамы және жіктелуі
- •1.4.1 Буферлiк жүйелердiң рН–ына әсер ететiн факторлар
- •1.4.2 Организмнің буферлiк жүйелерi. Бикарбонаттық және фосфаттық буферлiк ерiтiндiлердiң әсер ету механизмi
- •1.4.3 Буферлiк сиымдылық – буферлiк әсердiң өлшемi
- •1.5 Комплексті қосылыстар
- •Кейбір кең қолданылатын лигандтар
- •1.6 Тотығу-тотықсыздану реакциялары
- •1.6.1 Тотығу-тотықсыздану реакцияларын құрастыру және
- •1.7 Жоғарғы молекулалық қосылыстар
- •1.7.1 Жмқ туралы жалпы түсініктер, олардың жіктелуі және жалпы қасиеттері
- •1.7.2 Белоктардың ерітінділері - полиэлектролиттер және полиамфолиттер
- •1.7.5 Тұтқырлықтың биологиялық маңызы
- •(Онкотикалық) қысымы
- •1.7.7 Жмқ ерітінділерінің тұрақтылығының жойылуы. Тұздану механизмі
- •2.1 Cпирттер
- •2.1.1 Қаныққан бip атомды спирттер
- •2.1.2 Қанықпаған бір атомды спирттер
- •2.1.3 Екі атомды спирттер (гликольдер)
- •Үш атомды спирттер. Глицерин
- •2.2 Фенолдар және ароматты спирттер
- •2.2.1 Екі атомды фенолдар
- •2.2.2 Үш атомды фенолдар
- •2.2.3 Ароматты спирттер
- •2.3 Оксоқосылыстар
- •2.3.1 Оксотоптың құрылысы
- •Оксоқосылыстардың нуклеофильдік қосып алу реакциялары
- •Ацетальдегид ацетальдегидтің гидраты
- •2.4 Гетерофункционалдық қосылыстар
- •Аминді спирттер
- •Серин Коламин Холин
- •Гидроксиқышқылдар
- •Оксоқышқылдар
- •2.5 Аминқышқылдар. Ақуыздар
- •2.5.1 Ақуыздардың химиялық құрылысы
- •2.5.2 Ақуыздардың кеңістіктегі орналасуы
- •Ақуыздардың амфотерлігі
- •2.6 Көмірсулар
- •2.6.1 Олигосахаридтер (дисахаридтер)
- •2.6.2 Полисахаридтер
- •2.6.3 Көмірсулардың биологиялық ролі
- •2.7 Бір және екі гетероатомды бес мүшелі гетероциклдар
- •Дипиррилметан
- •Витамин в12 (цианкоболамин)
- •Фурацилин
- •Фуразолидон
- •2.7.1 Екі гетероатомды бес мүшелі гетероциклдар
- •Пиразолон – 5
- •2.7.2 Бір және екі гетероатомды алты мүшелі гетероциклдар
- •Урацил (2,4 – дигидроксипиримидин) тимин (2,4–дигидрокси–5–метилпиримидин)
- •Цитозин (4–амин–2–гидроксипиримидин)
- •Птеридин
- •2.8 Нуклеин қышқылдары
- •2.8.1 Рибонуклеозидтер
- •2.8.2 Дезоксирибонуклеозидтер
- •1, 2 Немесе 3 фосфор
- •Аденозин-3′–фосфат (3′-амф) немесе 3′–аденил қышқылы
- •(Уридинмонофосфат, уридин – 5′ – фосфат,
- •2.8.5 Полинуклеотидтер және полирибонуклеотидтер
- •2.9 Липидтер
- •2.9.1 Майлардың қорытылуы және сіңірілуі
- •2.9.2 Липидтер. Фосфоацилглицериндер
- •2.9.3 Қаныққан (шектелген) майлы қышқылдар сабындар
- •2.9.4 Қанықпаған (шектелмеген) майлы қышқылдар
- •2.9.5 Глицеролипидтер. Ацилглицериндер (жай және аралас)
- •2.9.6 Фосфоглицеролипидтер (фосфатид қышқылы, фосфатидилсерин, фосфатилэтаноламин, фосфатидилхолин)
- •2.9.8 Изопреноидтардың жалпы сипаттамасы (сабындалмайтын липидтер)
- •2.9.9 Холестерин (құрылысы)
- •Холестерин
- •2.9.10 Гликокортикоидтар және минералдық ортикоидтар
- •Эстрадиол
- •Тестостерон Тесттер
- •Жауаптары
- •Қолданылған әдебиеттер
2.5.2 Ақуыздардың кеңістіктегі орналасуы
Белоктардың І-ші реттік құрылысы (түзу сызықтық). Белоктардың І-ші реттік құрылысы деп амин қышқылдарының өзара пептидтік байланыс арқылы тізбек құруын айтады.
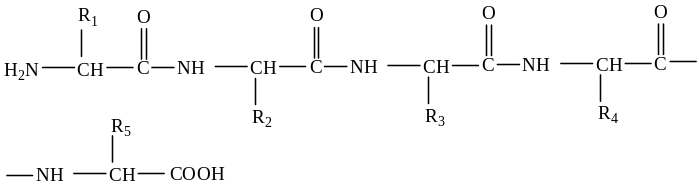
Әртүрлі белок құрамындағы амин қышқылдарының түрі де, саны да түрліше болып келуі мүмкін.
Мыс: гемоглобин – 574 ақ, оның 3-цис, 22-лиз
РНК – аза фермент-124 оның 8-цис, 9-лиз
Инсулин (гормон) – 51ақ, оның 6-цис, 1-лиз.
Ал кейбір белоктар құрамындағы амин қышқылдарының саны мен түрі бірдей болуы мүмкін. Бірақ белоктың қасиетін, қызметін, оның ерекшелігін анықтайтын - амин қышқылдарының полипептидтік тізбектегі алатын орны болып есептелінеді, міне белоктардың осы құрылысы, олардың І-ші реттік құрылымы деп аталынады.
Бірдей әріптерден, мазмұны әртүрлі сөздерді құрауға болатыны сияқты, 20-ға жуық амин қышқылдарынан әртүрлі белоктар түзіледі. Белоктардың бірінші реттік құрылымы берік коваленттік байланыс - пептидтік байланыс құрайды.
Белоктардың бірінші реттік құрылысының өзгеруі (амин қышқылдардың орнын өзгертуі) олардың қасиетінің күрт өзгеруіне әкеп соқтырады.
Ақуыздардың амфотерлігі
Белоктардың қышқылдық-негіздік қасиет көрсетуі олардың құрамындағы амин қышқылдары қалдықтарының құрамындағы ион түзуші радикалдарының санына тәуелді, шеткейлік NH2− тобымен, −COOH топтарының белок амфотерлік қасиетіне қосатын үлесі аз.
Белоктардың ионизациялануына қатысатын негізгі топтар:
Қышқылдық қасиет беретін топтар (сілтілік ортада теріс заряд береді)
−COOH (шеткейлік топ, аспарагин және глутамин қышқылдарының радикалдары)
Негіздік қасиет беретін топтар (қышқылдық ортада оң заряд береді)

радикалдары)
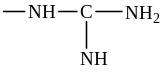
– аргинин
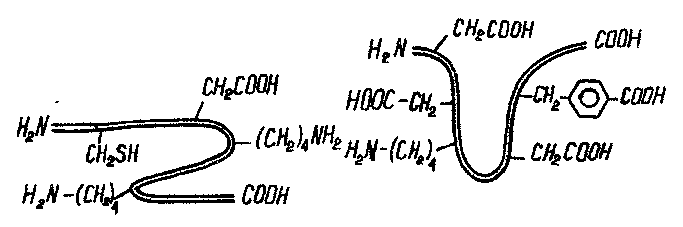
Берілген полипептидтік тізбектегі негіздік және қышқылдық қасиет көрсететін радикалдардың саны әр түрлі. Енді осы 2 полипептидке қышқылдық орта туғызсақ, онда бір полипептидте оң зарядтардың саны көбейеді. Ал сілтілік ортада, керісінше 2-ші пептидте теріс зарядтың жалпы саны көп болады, себебі сілтілік ортада диссоциацияланған СООН тобының саны көп.
Көрсетілген полипептидтердің әрқайсысының теріс зарядталған топтарының санының оң зарядталған топтардың санына тең болатын рН- ы болады. Белоктың мұндай күйін изоэлектрлік күй деп атайды. Ал осы күйді туғызатын рН-тың мәні изоэлекрлік нүкте деп аталынады. Белоктардың изоэлектрлік күй кезінде оң және теріс зарядтардың саны бірдей болатындықтан, белок молекуласы тұрақсыз және оңай тұнбаға түседі. Белоктардың изоэлектрлік нүктесі, олардың құрамындағы амин қышқылдар құрамына және олардың сандық қатынасына тәуелді.
Мысалы:
Пепсин -1.0 ИЭН (зарядтардың жалпы саны 0-ге тең)
Қанның альбумині-4.9
Қан гемоглабині-6.8
Бұлшықеттердің миоглобині-7.0
Лизоцим-11.0
рН-тың мәні изоэлектрлік нүктеден төмен ортада белоктардың оң зарядтарының жалпы саны теріс зарядтарына қарағанда басым болады, ал жоғарғы ортада теріс зарядтардың саны басым келеді.
Қанның сары суындағы белоктардың көбісінің ИЭН рН-тың 7-ден төмен мәнінде болғандықтан, олардың электрофорез әдісі арқылы бөлініп алынуы рН 9 мәнінде жүргізіледі. Дегенмен әртүрлі белоктың теріс зарядының мәні әртүрлі болғандықтан олардың электр тогы бар кеңістікте қозғалу жылдамдығы түрліше, сондықтан оларды бір-бірінен ажыратуға болады.
