
- •Комп’ютерний практикум 2014
- •1Аналіз статики і динаміки адсорбції
- •1.1Загальні положення
- •1.2Математичні моделі адсорбційних процесів
- •1.3Розрахункова частина
- •1.3.1Обробка експериментальних даних з рівноваги адсорбції в середовищі Excel
- •1.3.2Розрахунок ізотерми адсорбції, хвильової швидкості та розв’язок хвильового рівняння в середовищі MathCad.
- •1.4Додатковий теоретичний матеріал з динаміки адсорбції [3]
- •1.5Контрольні питання
- •1.6 Література
- •Загальні положення кінетики Ленгмюра-Хіншельвуда
- •2.1Математична обробка експериментальних даних
- •1.1 Механізм 1: взаємодія адсорбованих компонентів а та в з урахуванням адсорбції продукту реакції с
- •2.2Механізм 2: взаємодія адсорбованого компоненту в із компонентом а із газової фази (ударний механізм Ріділа)
- •2.3Механізм 3: взаємодія адсорбованого компоненту а та адсорбованого за дисоціативним механізмом компоненту в з урахуванням адсорбції продукту реакції с
- •2.4Механізм 4: взаємодія адсорбованого за дисоціативним механізмом компоненту в та компоненту а із газової фази
- •3Порядок виконання роботи
- •4Література
- •5Розрахунок фізичних властивостей суміші газів
- •5.2Розрахунки
- •1. Густина газової суміші
- •2. Теплоємність газової суміші
- •3. Динамічна в’язкість газової суміші
- •4. Кінематична в’язкість газової суміші
- •5. Теплопровідність газової суміші
- •6 Кінематичний коефіцієнт дифузії азоту у газовій суміші
- •5.3Індивідуальна самостійна робота.
- •5.4Література
- •6Макрокінетика гетерогенно-каталітичних процесів. Зовнішньо-дифузійна область: Розрахунок окиснення аміаку
- •6.1Загальні положення
- •6.2Алгоритм розрахунку
- •1. Попередні розрахунки
- •2. Розрахунок кількості каталізатора
- •3.4 Розрахунок числа сіток (використати функцію округлвверх):
- •6.3Індивідуальна самостійна робота
- •6.4Література
- •7Макрокінетика гетерогенно-каталітичних процесів. Внутрішньо-дифузійна область: розрахунок колони синтезу метанолу під середнім тиском
- •7.1Алгоритм розрахунку
- •7.2Індивідуальна самостійна робота
- •7.3Контрольні питання
- •7.4Література
- •8Розрахунок теплообміну в колоні синтезу аміаку
- •8.1Мета роботи
- •8.2Короткі теоретичні відомості
- •8.3Опис середовища розробки
- •8.4Розрахунок
- •Початкові температури газових потоків (за рисунком 1 та 2), °c:
- •8.5Алгоритм розрахунку з коментарями
- •8.6Література.
2.1Математична обробка експериментальних даних
1.1 Механізм 1: взаємодія адсорбованих компонентів а та в з урахуванням адсорбції продукту реакції с
Схематичне
зображення механізму протікання
гетерогенної каталітичної реакції, яка
описується рівнянням
![]() ,
механізм якої можна представити як:
,
механізм якої можна представити як:
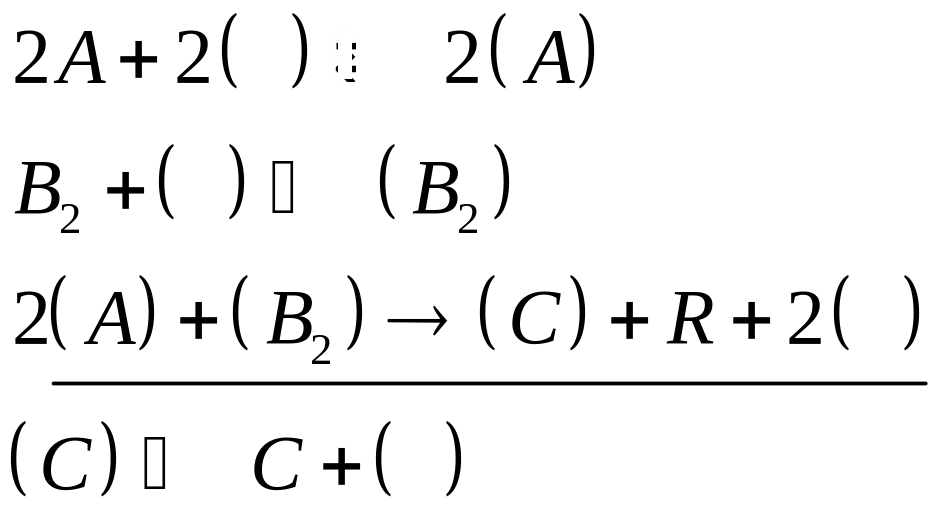
де ( ) – незайняте місце на адсорбційній поверхні.
Підкреслена реакція протікає з найменшою швидкістю тобто є лімітуючою стадією процесу. Відповідно до закону діючих поверхонь, вираз швидкості для реакції має наступний вигляд:
|
(7) |
де k – константа швидкості;
![]() –
адсорбційні коефіцієнти компонентів
A, B, C відповідно;
–
адсорбційні коефіцієнти компонентів
A, B, C відповідно;
![]() –
парціальні тиски компонентів A, B, C
відповідно;
–
парціальні тиски компонентів A, B, C
відповідно;
n1, n2 – порядки реакції за компонентами A, B відповідно;
S = n1 + n2 – величина, що характеризує вплив адсорбції на швидкість хімічної реакції. Відмітимо, що без знаменника рівняння (7) фактично перетворюється на вираз закону діючих мас.
Змінні в ході реакції концентрації компонентів необхідно представити через ступінь перетворення по компоненту А і початкові концентрації компонентів із урахування зміни об’єму в результаті реакції – ∆n=(c+r)-(a+b):
|
(8) |
|
(9) |
|
(10) |
|
(11) |
Величини A, d та С введено для полегшення обробки рівняння на ПК.
Експериментальна дані представлено серіями залежності швидкості реакції від ступеня перетворення базового компоненту, тому швидкість представлену як зміну парціального тиску компоненту в часі необхідно представити як зміну ступеня перетворення в часі:
|
(12) |
де Р – загальний тиск у системі, атм.
Згідно із законом Дальтона представимо парціальний тиск компонента, як добуток тиску в системі (атмосферного) та молярної частки компонента, таким чином рівняння швидкості реакції набуває вигляду:
|
(13) |
де MX – множник, що враховує оборотність реакції: MX=1-Кр/К*.
Константа
![]() - вираз, наприклад, для реакції
,
що має той же вид, що і константа рівноваги
Кр, але в нього входять поточні
парціальні тиски компонентів, а не
рівноважні. Константа рівноваги Кр
розраховується для конкретної рівноваги
за її залежністю від температури.
- вираз, наприклад, для реакції
,
що має той же вид, що і константа рівноваги
Кр, але в нього входять поточні
парціальні тиски компонентів, а не
рівноважні. Константа рівноваги Кр
розраховується для конкретної рівноваги
за її залежністю від температури.
Для подальших перетворень вважати реакцію необоротною: Мх = 1, загальний тиск у системі Р приймається рівним 1 атм, а концентрації компонентів представлено через початкові концентрації та ступінь перетворення за компонентом А:
|
(14) |
Вираз швидкості реакції набуває наступного вигляду:
|
(15) |
де:
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
(15а)
.
(15а)
Для розрахунку
коефіцієнтів
![]() ,
,
![]() ,
,
![]() ,
,
![]() рівняння (15) використовується надбудова
«Пошук рішення»: мінімізується сума
квадратів відхилення КВ експериментальних
We і розрахункових W
значень швидкості процесу
∑(We-W)2→min.
Після чого розраховуються константи
k,
рівняння (15) використовується надбудова
«Пошук рішення»: мінімізується сума
квадратів відхилення КВ експериментальних
We і розрахункових W
значень швидкості процесу
∑(We-W)2→min.
Після чого розраховуються константи
k,
![]() ,
,
![]() ,
,
![]() за вище наведеними формулами (15а).
за вище наведеними формулами (15а).
2.2Механізм 2: взаємодія адсорбованого компоненту в із компонентом а із газової фази (ударний механізм Ріділа)
Із урахуванням адсорбції продукту реакції С
Схематичне зображення механізму протікання гетерогенної каталітичної реакції, яка описується рівнянням:

де ( ) – незайняте місце на адсорбційній поверхні.
Підкреслена реакція протікає з найменшою швидкістю тобто є лімітуючою стадією процесу. Відповідно до закону діючих поверхонь, вираз швидкості для реакції:має наступний вигляд:
 (16)
(16)
Перетворення даного рівняння приводить до наступного рівняння:
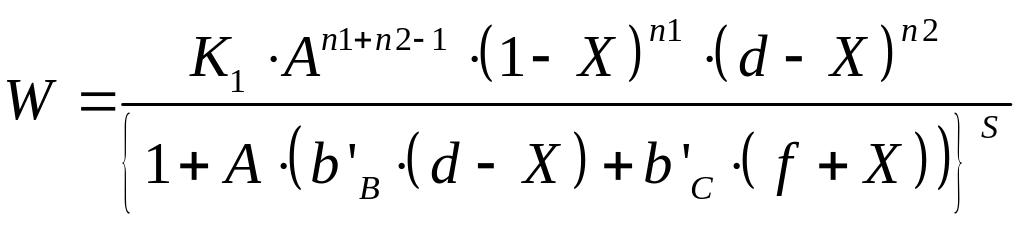 …………………………………….(17)
…………………………………….(17)
Для розрахунку коефіцієнтів , , рівняння (17) використовується надбудова «Пошук рішення»: мінімізується сума квадратів відхилення КВ експериментальних We і розрахункових W значень швидкості процесу ∑(We-W)2→min. Після чого розраховуються константи k, , за вище наведеними формулами (15а).

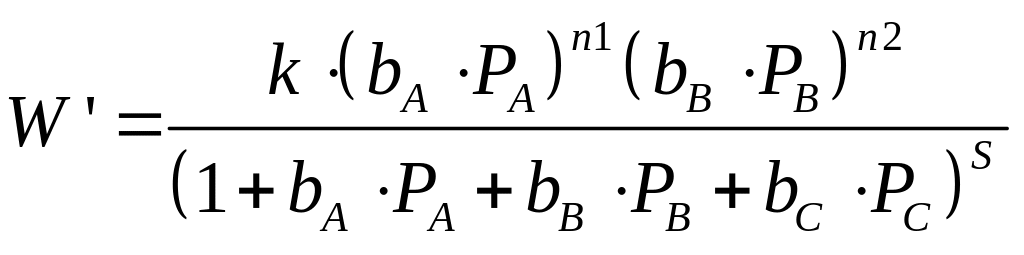
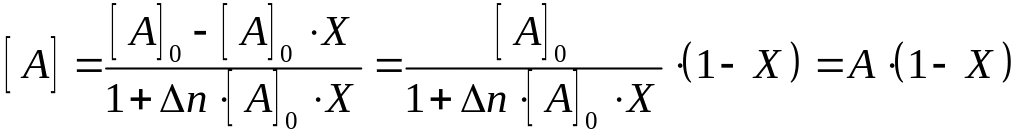 ;
;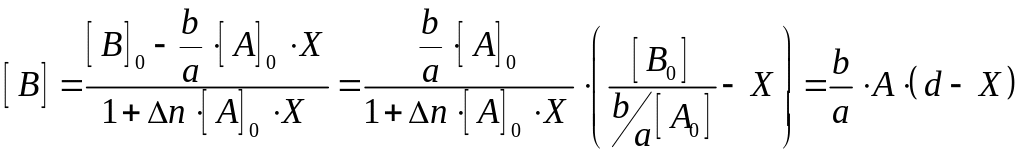 ;
; f
f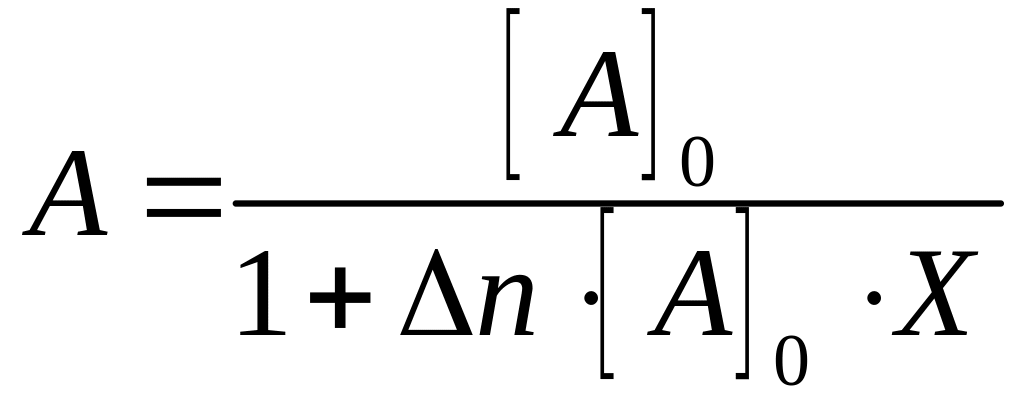 ;
;
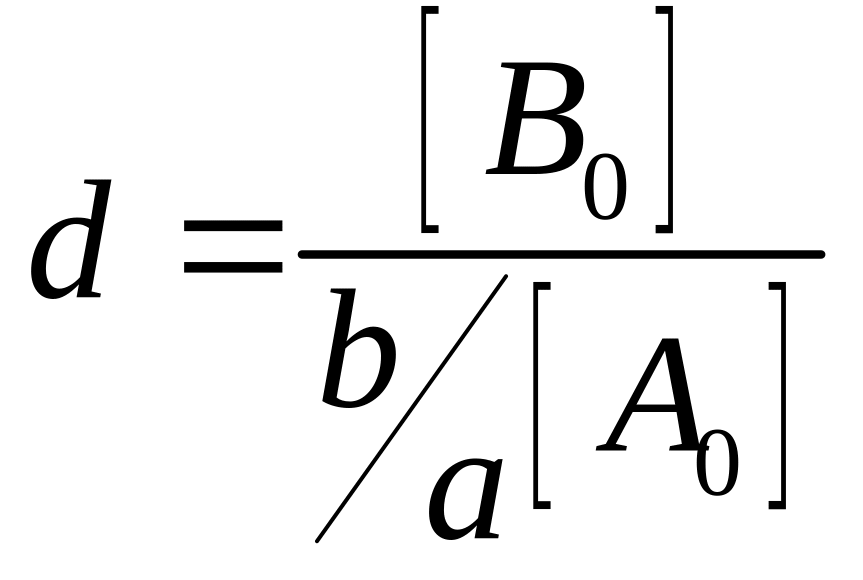 ;
;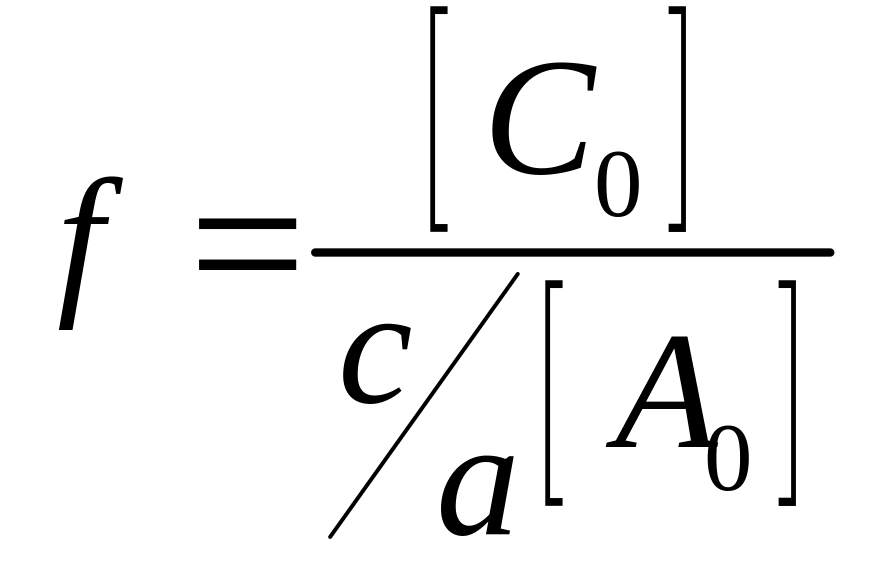 .
. ;
;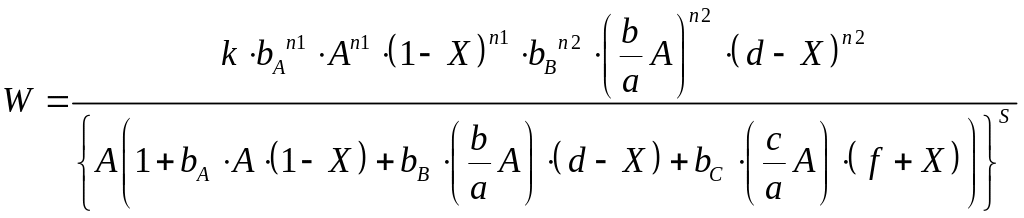
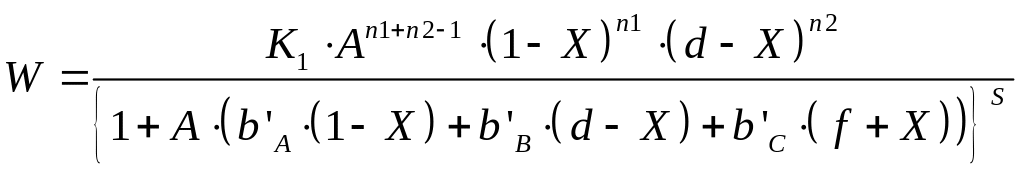 ,
,