
- •Мазмұны
- •Қысқартылған сөздер тізімі
- •1 Бөлім. Ситуациялық есептер
- •1.1 Ерітіндідегі еріген заттың массалық үлесі (проценттік концентрация) Типтік есептерді шығару үлгілері
- •Есеп шартының негізгі түрлерінің үлгілері
- •1.2 Еріген заттың молярлық концентрациясы Есеп шартының негізгі түрлерінің үлгілері
- •1.3 Еріген заттың моляльдық концентрациясы
- •Есеп шартының негізгі түрлерінің үлгілері
- •1.4 Концентрациялары әртүрлі ерітінділерді араластыруға (сұйылтуға немесе қоюлауға) байланысты есептеулер Типтік есептерді шығару үлгілері
- •Есеп шартының негізгі түрлерінің үлгілері
- •1.5 Химиялық реакциялардың жылдамдығы Типтік есептерді шығару үлгілері
- •Есеп шартының негізгі түрлерінің үлгілері
- •1.6 Сутектік көрсеткіш рН. Күшті және әлсіз электролиттердің рН және рОн Есеп шартының негізгі түрлерінің үлгілері
- •1.7 Буферлі жүйелер Типтік есептерді шығару үлгілері
- •1000 Мл – 1 моль ch3cooh
- •Есеп шартының негізгі түрлерінің үлгілері
- •1.8 Комплексті қосылыстар Есеп шартының негізгі түрлерінің үлгілері
- •1.9 Осмос, осмостық қысым Есеп шартының негізгі түрлерінің үлгілері
- •1.10 Бір атомды және көп атомды спирттер
- •1.11 Альдегидтер мен кетондар
- •1.12 Карбон қышқылдары және олардың функционалды туындылары
- •1.13 Амин қышқылдары, ақуыздар
- •1.14 Көмірсулар. Моно–, ди– және полисахаридтер
- •1.15 Нуклеин қышқылдары
- •1.16 Липидтер
- •2 Бөлім. Тесттік тапсырмалар
- •Тесттік тапсырмалардың жауабы
- •3 Бөлім. Дайындыққа арналған сұрақтар тізімі
- •Қолданылған әдебиеттер
1.3 Еріген заттың моляльдық концентрациясы
1 мысал. Күкірт қышқылының 15%-тік ерітіндісінің тығыздығы 1,105 г/мл. Осы ерітіндінің молялдық концентрациясын есептеңіздер.
Шешуі.
Ерітіндінің 1 л көлемін қарастырамыз. Оның массасы 1105 г болады. Енді проценттік концентрация ұғымын пайдаланып, пропорция құрып, ондағы таза күкірт қышқылының массасын табамыз:
Егер 100 г ерітіндіде 15 г еріген H2SO4 болса,
Онда 1105 г ерітіндіде х г еріген H2SO4 болады.
Бұдан: х = 1105 г · 0,15 = 165,75 г.
Судың массасы: 1105 г – 165,75 = 939,25 г.
Енді молялдық концентрация ұғымының анықтамасын пайдаланып, пропорция құрамыз:
Егер 935,25 г суда 165,75 г еріген H2SO4 болса,
Онда 1000 г суда х г еріген H2SO4 болады.
Бұдан:

Оның
зат мөлшері:
 .
.
Демек, ерітіндінің молялдық концентрациясы 1,8 моль/1 кг суда.
Есеп шартының негізгі түрлерінің үлгілері
67%-тік сахароза С12Н22О11 ерітіндісінің молялдық концетрациясын есептеу қажет.
9%-тік сахароза ерітіндісің тығыздығы 1,035 г/мл молялдық концетрациясын есептеу қажет.
20%-тік Н2SО4 ерітіндісінің тығыздығы 1,105 г/мл. Осы ерітіндінің молялдық концетрациясын есептеу қажет.
40%-тік НNO3 ерітіндісінің тызыздығы 1,25 г/мл. тең. Осы ерітіндінің молялдық концетрациясы қандай болады?
1 кг суға 666 г КОН ерітілді; ерітіндінің тығыздығы 1,395 г/мл. Табу керек: a) КОН-тың массалық үлесін; b) молялдық концетрациясын.
1.4 Концентрациялары әртүрлі ерітінділерді араластыруға (сұйылтуға немесе қоюлауға) байланысты есептеулер Типтік есептерді шығару үлгілері
1 мысал (Глинка, 1983, 399). Берілген заттың 25%-тік ерітіндісінің 300 грамын оның 40%-тік ерітіндісінің 400 грамына қосып араластырғанда пайда болатын ерітіндідегі еріген заттың массалық үлесін табыңыздар.
Классикалық (қарапайым) әдіс
Алдымен 25%-тік ерітіндінің 300 грамындағы еріген заттың массасының пропорция құру арқылы табамыз.
Егер 100 г ерітіндіде 25 г еріген зат болса,
Онда 300 г ерітіндіде х г еріген зат болғаны.
Бұдан:

Дәл осылай 40%-тік ерітіндінің 400 грамындағы еріген заттың массасын табамыз.
Егер 100 г ерітіндіде 40 г еріген зат болса,
Онда 400 г ерітіндіде y г еріген зат болғаны.
Бұдан:
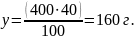
Енді екі ерітіндіні бір-біріне қосып араластырғанда 700 грамм жаңа ерітінді түзіледі. Оның ішінде еріген заттың жалпы массасы х + y = 75 + 160 = 235 г. Жаңа ерітіндідегі еріген заттың массалық үлесін пропорция арқылы табуға болады.
Егер 700 г ерітіндіде 235 г еріген зат болса,
Онда 100 г ерітіндіде x г еріген зат болғаны.
Бұдан:

Демек, пайда болған жаңа ерітіндідегі еріген заттың массалық үлесі 33,6%.
Алгебралық әдіс
Есептің шартында келтірілген араласатын ерітінділердің массалары мен олардағы еріген затттың массалық үлестерін алгебралық теңдеуге қоямыз.
m1w1 + m2w2 = m3w3
Мұндағы: m3 = m1 + m2
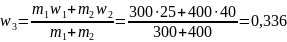 немесе
немесе

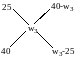
«Крест» әдісі
«Крест» ережесі бойынша:
Бұдан: w3 = 0,336 немесе 33,6%.
Демек, пайда болған ертіндідегі еріген заттың массалық үлесі 33,6%.

Бұдан, w3 = 0,336 немесе 33,6%. Демек, пайда болған ертіндідегі еріген заттың массалық үлесі – 33,6%.
2 мысал (Гольдфард, 1986, 4-66). Тұз қышқылының 26,7%-тік ерітіндісінің 242 грамын дайындау үшін оның 20 және 32,1%-тік ерітінділердің қандай массаларын қосып араластыру керек?
Классикалық (қарапайым) әдіс
Алдымен 26,7%-тік ерітіндінің 242 грамын дайындау үшін қажетті тұз қышқылының массасын есептейміз.
Егер 100 г ерітіндіде 26,7% г еріген HCl болса,
Онда 242 г ерітіндіде х г еріген HCl болғаны.
Бұдан:
 еріген
HCl.
еріген
HCl.
Егер араластыруға арналған 20%-тік қышқылдың массасын х деп белгілесек, онда араластыруға арналған 32,1%-тік ерітіндінің массасы (242–х) г болады.
Енді 20%-тік ерітіндідегі еріген қышқылдың массасын табамыз:
Егер 100 г ерітіндіде 20 г еріген HCl болса,
Онда 400 г ерітіндіде y г еріген HCl болғаны.
Бұдан:

Дәл осылай 32,1%-тік ерітіндідегі қышқылдың массасын табамыз:
Егер 100 г ерітіндіде 32,1 г еріген HCl болса,
Онда (242–х) г ерітіндіде z г еріген HCl болғаны.
Бұдан:

Есептің
шарты бойынша:

Ортақ бөлімге келтіріп, теңдеуді шешсек:
Бұдан: x = 108,9 г
Демек, 26,7%-тік ерітіндісінің 242 грамын дайындау үшін оның 20%-тік ерітіндінің 108,9 грамы мен 32,1%-тік ерітіндісінің (242–108) = 134 грамын қосып араластыру керек.
Алгебралық әдіс
m1w1 + m2w2 = m3w3
Теңдеудегі белгісіздердің орнына олардың есептің шарттарындағы мәндерін қойып, теңдеуді шешеміз:
m1 + m2 = 242
m1·20 + m2·32,1 = 242·26,7
20m1 + (242 – m1)·32,1+6431,4
Бұдан: m1 = 108 г; m2 = 242 – 108 = 134 г
«Крест» әдісі
«Крест» ережесі бойынша:
Бұдан: w3 = 0,336 немесе 33,6%.
Демек, пайда болған ертіндідегі еріген заттың массалық үлесі 33,6%.

Егер ерітіндінің 12,1 масса бөлігі 242 г болса,
Онда оның (20%-тік ерітіндісіне сәйкес) 5,4 масса бөлігі х г.
Бұдан:
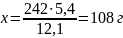 20%-тік ерітінді.
20%-тік ерітінді.
Ал 32,1%-тік ерітіндінің массасы: y = 242–108=134 г. Демек, 242 грамм 26,7%-тік ерітіндісін дайындау үшін 20%-тік ерітіндінің 108 грамын және 32,1%-тік ерітіндісінің 134 грамын қосып араластыру керек.
3 мысал (В.В. Сорокин және т.б., 1989, 13 б., №4-7). Натрий хлоридінің 17,5%-тік ерітіндісін дайындау үшін оның 15,5%-тік ерітіндісінің 100 грамына қанша грамм натрий хлоридін қосу керек?
Классикалық (қарапайым) әдіс
Егер қосатын құрғақ натрий хлоридінің массасын х-деп белгілесек, онда пайда болатын 17,5%-тік ерітіндінің массасы (100+х) г болады.
Енді пропорция құрып, х-ті табамыз:
Егер 100 г ерітіндіде 17,5 еріген зат болса, онда (100+х) г ерітіндіде (15,5+х) еріген зат болады.
(100+х)·17,5 = 100(15,5+х) Бұдан: х = 2,42 г NaCl.
Демек, натрий хлоридінің 17,5%-тік ерітіндісін дайындау үшін оның 15,5%-ті ерітіндісінің 100 грамына 2,42 г құрғақ натрий хлоридің қосу керек.
«Крест» әдісі
Мұнда да құрғақ натрий хлориді 100%-тік ерітінді деп қарастырамыз және оның массасын х деп белгілейміз.
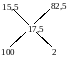
Есептің шартына сүйене отырып «крест» ережесі бойынша араластыратын заттардың массалырының қатынасы мынадай болады.
 82,5·x=200;
82,5·x=200;
 NaCl.
NaCl.
Демек, натрий хлоридінің 17,5%-тік ерітіндісін дайындау үшін оның 15,5%-ті ерітіндісінің 100 грамына 2,42 г құрғақ натрий хлоридің қосу керек.
