
- •Глава 1. Строение и свойства материалов…………………….…..….7
- •Глава 2. Фазовый состав сплавов…………………………………… ....18
- •Глава 3. Дефекты кристаллов………………………………………………...23
- •Точечные дефекты…………………………………………………………………...23
- •Глава 4. Свойства материаЛов……………………………………………..27
- •Глава 5. Формирование структуры литых материалов..………..37
- •5.4. Получение монокристаллов……………………………………………………………41
- •5.5. Аморфные металлы………………………………………………………………..…..42
- •5.6. Нанокристаллические материалы……………………………………………….…43
- •Глава 6. Влияние химического состава
- •Глава 7. Формирование структуры деформированных
- •Глава 9. Термическая обработка металлов……………………......68
- •Глава 10. Химико-термическая обработка сплавов…………….78
- •Глава 1. Строение и свойства материалов
- •1.1. Кристаллические и аморфные тела
- •1.2. Элементы кристаллографии
- •1.2.1. Кристаллическая решетка
- •1.2.2. Кристаллографические индексы
- •1.2.3. Анизотропия
- •1.3. Влияние типа связи на структуру и свойства кристаллов
- •1.3.1. Взаимодействие частиц в кристаллах
- •1.3.2. Молекулярные кристаллы
- •1.3.3. Ковалентные кристаллы
- •1.3.4. Металлические кристаллы
- •1.3.5. Ионные кристаллы
- •Глава 2. Фазовый состав сплавов
- •2.1. Твердые растворы
- •2.1.1. Твердые растворы замещения
- •2.1.2. Твердые растворы внедрения
- •2.2. Промежуточные фазы
- •2.2.1. Промежуточные фазы системы металл – неметалл
- •2.2.2. Промежуточные фазы системы металл-металл
- •Глава 3. Дефекты кристаллов
- •3.1. Точечные дефекты к точечным дефектам относятся вакансии, межузельные атомы основного вещества, чужеродные атомы внедрения (рис.3.2).
- •3.2. Линейные дефекты
- •3.3. Поверхностные дефекты
- •Вопросы для самоконтроля
- •Глава 4. Свойства материалов.
- •4.1. Критерии выбора материала
- •4.2. Механические свойства материалов
- •4.2.1. Механические свойства, определяемые при статических нагрузках
- •4.2.1.1. Испытание на растяжение (гост 1497-84)
- •4.2.1.2. Испытания на изгиб
- •4.2.1.3. Испытания на твердость
- •4.2.1.4. Испытания на динамические нагрузки
- •4.2.2. Механические свойства, определяемые при переменных (циклических) нагрузках
- •4.3. Физические свойства материалов
- •Вопросы для самоконтроля
- •Глава 5. Формирование структуры литых материалов
- •5.1. Самопроизвольная кристаллизация
- •5.2. Несамопроизвольная кристаллизация
- •5.3. Форма кристаллов и строение слитков
- •5.4. Получение монокристаллов
- •5.5. Аморфные металлы
- •5.6. Нанокристаллические материалы
- •Контрольные вопросы
- •Глава 6. Влияние химического состава на равновесную структуру сплавов
- •6.1. Метод построения диаграмм состояния
- •6.2. Диаграммы состояния сплавов, компоненты которых полностью растворимы в жидком и твёрдом состоянии
- •6.3. Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твёрдом состоянии и образуют эвтектику
- •6.4. Диаграмма состояния сплавов, компоненты которой ограниченно растворимы в твёрдом состоянии и образуют перитектику
- •6.5. Диаграмма состояния сплавов с полиморфным превращением одного из компонентов
- •6.6. Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением
- •6.7. Физические и механические свойства сплавов в равновесном состоянии.
- •6.8. Диаграмма состояния железоуглеродистых сплавов
- •6.8.1. Компоненты и фазы в сплавах железа с углеродом
- •6.8.2. Превращения в сплавах железо-графит
- •6.8.3. Влияние легирующих элементов на равновесную структуру сталей
- •6.8.4. Карбиды и нитриды в легированных сталях
- •Вопросы для самоконтроля
- •Глава 7. Формирование структуры деформированных металлов и сплавов
- •7.1. Механизм пластического деформирования
- •7.2. Особенности деформированния монокристаллов
- •7.3. Деформирование поликристаллов
- •7.4. Деформация двухфазных сплавов
- •7.5. Свойства холоднодеформированных металлов
- •7.6. Возврат и рекристаллизация
- •Вопросы для самоконтроля
- •Глава 8. Диффузия в металлах и сплавах
- •8.1. Вывод первого уравнения Фика на основе атомной диффузии
- •В единицу времени между двумя соседними плоскостями 1 и 2 кристаллов решетки,
- •Расположенных на расстоянии ∆
- •8.2. Механизмы диффузии в металлах и полимерах
- •Глава 9. Термическая обработка металлов
- •9.1. Термическая обработка сплавов, не связанная с фазовыми превращениями в твердом состоянии
- •9.1.1. Нагрев для снятия остаточных напряжений
- •9.1.2. Рекристализационный отжиг
- •9.1.3. Диффузионный отжиг
- •9.2. Термическая обработка сплавов с переменной растворимостью компонентов в твердом состоянии
- •9.3. Термическая обработка сплавов с переменной растворимостью и полиморфным превращением (стали)
- •9.3.1.Превращения при нагреве до аустенитного состояния
- •9.3.2. Превращения аустенита при различных степенях переохлаждения
- •9.3.2.1. Перлитное превращение аустенита
- •9.3.2.2. Мартенситное превращение аустенита
- •9.3.2.3. Промежуточное (бейнитное) превращение аустенита
- •9.4. Технология термической обработки стали
- •9.4.1. Отжиг сталей
- •9.4.2. Нормализация сталей
- •9.4.3. Особенности закалки сталей
- •9.4.4. Отпуск закаленных сталей
- •9.4.5. Свойства отпущенной стали
- •Вопросы для самоконтроля
- •Тема 10. Химико-термическая обработка сплавов
- •10.1. Диффузионное насыщение стальных деталей углеродом и азотом
- •10.2. Диффузионное насыщение деталей металлами и неметаллами
- •Вопросы для самоконтроля
- •Тема 11. Конструкционные материалы
- •11.1. Общие требования
- •11.2. Конструкционная прочность материала и методы ее оценки
- •11.3. Методы повышения конструкционной прочности
- •11.4. Классификация конструкционных материалов
- •11.5. Классификация конструкционных сталей
- •11.5.1. Углеродистые стали
- •11.5.2. Легированные стали
- •11.6. Износостойкие материалы
- •11.7. Материалы, устойчивые к действию температур и рабочей среды
- •11.7.1. Жаропрочные материалы
- •Критериями жаропрочности, помимо предела ползучести, является предел длительной прочности и сопротивление релаксации.
- •11.7.1.1. Основные группы жаропрочных материалов
- •11.7.2. Коррозионностойкие нержавеющие стали и сплавы
- •11.8. Инструментальные стали
- •11.9. Штамповочные стали
- •Терминологический словарь
- •Литература
1.3.5. Ионные кристаллы
В сложных кристаллах, состоящих из элементов различной валентности, возможно образование ионного типа связи. Такие кристаллы называются ионными.
В узлах ионного кристалла располагаются ионы, т.к. между элементами происходит перераспределение ē: электроположительный элемент теряет валентные электроны, а электроотрицательный – приобретает их. Например, кристалл FeO, решетка которого состоит из отрицательно-заряженных ионов O2- и положительно-заряженных ионов Fe2+.
В решетке кристалла ионы укладываются как шары разных диаметров. Радиус неметалла больше радиуса металлического иона и поэтому металлические ионы заполняют поры в кристаллической решетке, образованной ионами неметалла.
В ионных кристаллах координационное число определяет число ионов противоположного знака, которые окружают данный ион.
Приведенные ниже значения отношений радиуса металла (Rм) к радиусу неметалла (Rнм) и соответствующие им координационные числа вытекают из геометрии упаковки шаров разных диаметров:
К |
8 |
6 |
4 |
2 |
Rм/Rнм |
1-0,73 |
0,73-0,41 |
0,41-0,22 |
0,22 |
Для FeO К равно 6, т.к. указанное соотношение равно 0.54 (рис. 1.10). Ионы кислорода образуют ГЦК–решетку. Ионы железа занимают в ней поры. Каждый ион железа окружен шестью ионами кислорода и наоборот, каждый ион кислорода окружен шестью ионами Fe. В связи с этим в ионных кристаллах нельзя выделить пару ионов, которые можно было бы считать молекулой. При испарении такой кристалл распадается на молекулы.
При нагревании соотношение радиусов может изменяться, т.к. у неметалла он возрастает интенсивнее, чем у металла. Это приводит к изменению типа кристаллической структуры, т.е к полиморфизму.
Энергия связи ионного кристалла по своему значению близка к энергии связи ковалентного кристалла. И превышает энергию связи металлического, а тем более, молекулярного кристалла. Поэтому ионные кристаллы имеют высокие температуры плавления и модуль упругости и низкие коэффициенты сжимаемости и линейного расширения. Заполнение энергетических зон вследствие перераспределения делает ионные кристаллы полупроводниками или диэлектриками.
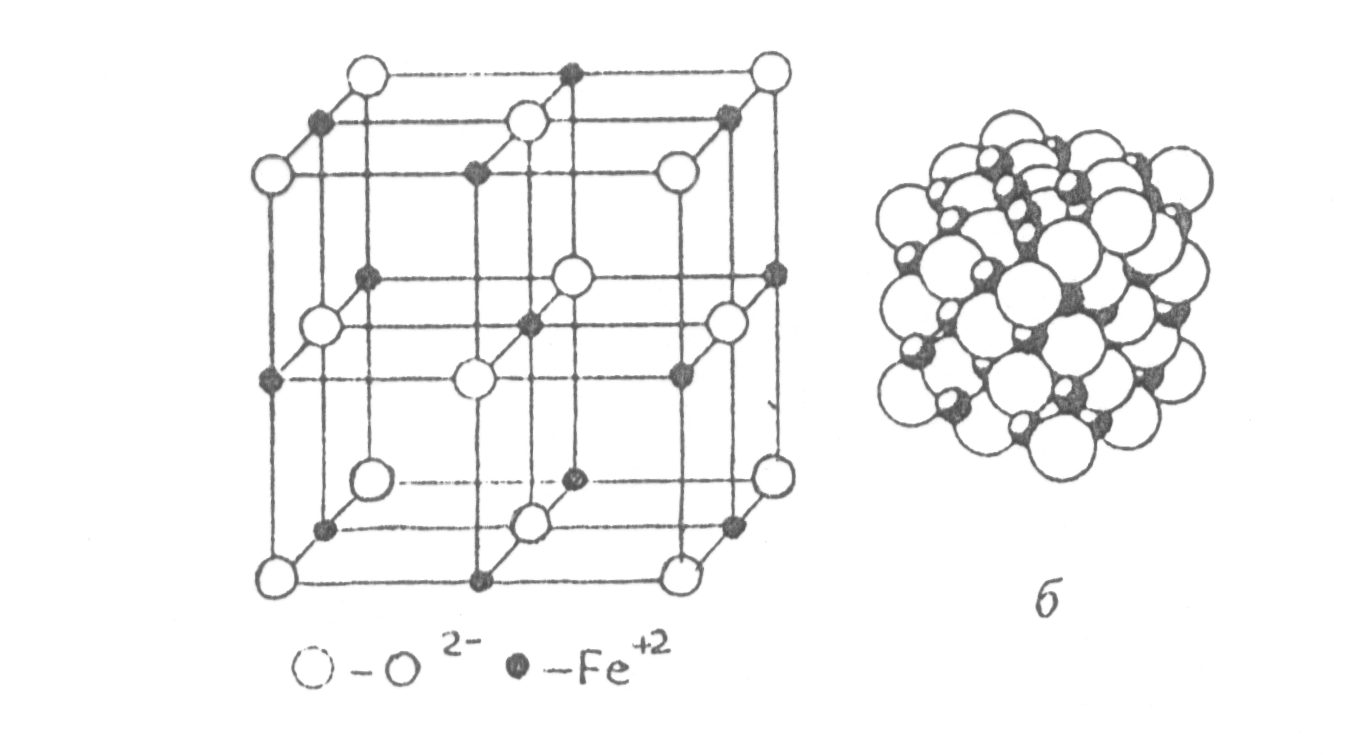
а
Рис. 1.10. Кристаллическая решетка FeO
КОНТРОЛЬНЫЕ вопросы:
Что называется элементарной ячейкой кристалла? Какие величины используют для описания элементарной ячейки?
Как определяют степень сложности элементарной ячейки?
Сколько частиц приходится на элементарную ячейку: простую кубическую, ОЦК, ГЦК?
Что такое координационное число и коэффициент компактности?
Рассмотрите модели кристаллических решеток и посчитайте координационное число в моделях: простой кубической, ОЦК, ГЦК.
Разберите и соберите вновь объемные модели молекул: ГП, ОЦК, ГЦК.
Какие точки пересекают плоскость (211) (рис. 1.2.7)?
Каковы индексы оси Y?
а) [100] б) [010] в) [010]
Какие силы действуют на частицы в кристаллической решетке?
Почему ряд материалов проводит электрический ток, а ряд – является полупроводниками и диэлектриками?
Как подразделяются кристаллы по характеру связи?
Как устроены молекулярные кристаллы, какие свойства обнаруживают?
Назовите примеры молекулярных кристаллов
Почему молекулярные кристаллы – диэлектрики?
Как устроены ковалентные кристаллы, какие свойства обнаруживают?
Назовите примеры ковалентных кристаллов
Почему ковалентные кристаллы – диэлектрики?
Как устроены металлические кристаллы, какие свойства обнаруживают?
Назовите примеры металлических кристаллов
Почему металлические кристаллы – проводники?
Как устроены ионные кристаллы, какие свойства обнаруживают?
Назовите примеры ионных кристаллов
Почему ионные кристаллы – диэлектрики?
Что такое полупроводники?
Что такое полиморфизм?
