
- •Силлабус
- •Силлабус
- •Пререквизиты учебной дисциплины
- •5. Характеристика учебной дисциплины
- •6. Список основной и дополнительной литературы
- •7. Контроль и оценка результатов обучения
- •Политика учебной дисциплины
- •Глоссарий
- •Лекция №1.
- •Лекция № 2. Квантово-механическая модель атома. Квантовые числа, их физический смысл.
- •Лекция № 3
- •Лекция № 4 Теоретические методы, применяемые при изучении строения молекул и химической связи. Основные положения методов валентных связей.
- •Лекция № 5. Энергетика химических реакций. I закон термодинамики. II закон термодинамики
- •II закон термодинамики
- •Контрольные вопросы
- •Лекция № 6. Химическая кинетика
- •Контрольные вопросы
- •Лекция № 7.
- •Контрольные вопросы
- •Лекция №8 Свойства растворов. Растворы электролитов. Теория электролитической диссоциации. Ионное произведение воды.
- •Лекция №9 Растворы неэлектролитов. Закон разбавления Оствальда. План.
- •Контрольные вопросы
- •Окислительно-восстановительные реакции и электрохимические процессы. Процессы окисления и восстановления.
- •Контрольные вопросы
- •1. Коррозия металлов.
- •Методы защиты от коррозии
- •Номенклатура комплексных соединений
- •Методы установления координационных формул
- •Устойчивость комплексных соединений
- •Контрольные вопросы
- •Лекция № 14 Коллоидно-химические основы охраны окружающей среды.
- •Лекция №15 Химическая идентификация: качественный и количественный анализ, физико-химические методы анализа.
- •Тема: Методы очистки веществ. Фильтрование.
- •План занятия:
- •Лабораторный практикум
- •Вопросы и задания
- •Лабораторная работа №3
- •Лабораторный практикум
- •Лабораторная работа №5 Тема: Перегонка. Перекристаллизация.
- •Вопросы и задания:
- •Лабораторная работа № 7 Тема: Скорость химических реакций. Взаимодействие тиосульфата натрия с серной кислотой.
- •Лабораторный практикум
- •Вопросы и задания
- •Лабораторный практикум
- •Лабораторная работа № 8
- •Лабораторный практикум
- •Контрольные вопросы и задачи.
- •Лабораторная работа № 9
- •Лабораторный практикум
- •Лабораторный практикум
- •Вопросы и задания
- •Лабораторный практикум
- •Вопросы и задания
- •Лабораторная работа №12 Тема: Водород. Получение и химические свойства водорода.
- •Лабораторный практикум
- •Лабораторная работа №13 Тема: Кислород. Получение и химические свойства кислорода.
- •Упражнения и задача
- •Лабораторная работа № 14 Тема: Комплексные соединения. Химические свойства комплексных соединений.
- •Получение и свойства окиси кобальта
- •Получение аммиаката никеля
- •Упражнения
- •Лабораторная работа№ 15 Тема: Химия металлов и их соединений. Химия неметаллов и их соединений.
- •1) Плавление серы. Получение пластической серы
- •2) Получение ромбической серы
- •Получение калийной селитры
- •Реакция открытия ионов Na- и к'
- •Вопросы
Лекция №15 Химическая идентификация: качественный и количественный анализ, физико-химические методы анализа.
Цель: рассмотреть основные методы химической идентефикации.
План
Сущность химической идентификации.
Качественный анализ.
Количественный анализ.
Методы количественного анализа.
Химическая идентификация – это установление вида и состояния молекул, ионов, радикалов, атомов и других частиц на основе сопоставления экспериментальных данных с соответствующими справочными данными для известных частиц. Идентификация — установление тождества неизвестного соединения с другим известным. Для этого сопоставляют физико-химические константы, свойства и реакции обоих веществ. Перед идентификацией вещества тщательно очищают, проводят предварительное его исследование: сопоставляют агрегатное состояние, цвет, вязкость, испытывают на растворимость в воде, органических растворителях, основаниях и кислотах, определяют горючесть и другие свойства .Например, в молекулярном анализе идентификация - установление химической формулы соединений или ее важнейших фрагментов. Идентификация - цель качественного анализа, который, как правило, предшествует количественным определениям. А) Свойства вещества зависят от его чистоты Б) Молекулярный анализ-установление качества и количества состава химических соединений и их смесей. При качественном анализе смеси химического соединения обычно предварительно разделяют различными методами (хроматографией, ректификацией, кристаллизацией, экстракцией, осаждением, термической диффузией и др.); затем для разделенных веществ определяют так называемые интегральные молекулярные признаки, к которым относятся молярная масса, суммарный элементный состав, плотность, растворимость, температуры фазовых переходов, показатели преломления, потенциалы ионизации, а также спектры поглощения электромагнитного излучения, масс-спектры и т. п. Эти характеристики химических соединений сопоставляют с соответствующими константами и спектрами образцов сравнения, устанавливают отсутствие депрессии (понижение и увеличение интервала) температуры плавления смеси идентифицируемого соединения и эталонного вещества (т.е. известного вещества, отождествляемого с исследуемым). В) Изотопный анализ — определение изотопного состава химического элемента. Изотопный анализ различных элементов можно реализовать на различных физических принципах. Наиболее распространенным является масс-спектрометрический метод, с помощью которого можно проводить изотопный анализ всех, без исключения, элементов периодической системы. Масс-спектрометры для определения изотопного состава должны быть очень точными. Для анализа изотопного состава легких элементов (углерод, водород, кислород, сера, азот и т. д.) используется ионизация электронным ударом. В этом случае годятся все методы ввода газовой фазы, как и в органических масс-спектрометрах. Г) Фазовый анализ - определение химического состава и количества отдельных фаз в гетерогенных системах или индивидуальных форм соединения элементов в рудах, сплавах, полупроводниках и др. Объектом фазового анализа всегда является твердое тело. Предметом аналитической химии является химическая идентификация( качественный анализ) и измерения(количественный анализ). 1.1Качественный анализ Качественный анализ имеет своей целью обнаружение определенных веществ или их компонентов в анализируемом объекте. Обнаружение проводится путем идентификации веществ, то есть установления тождественности (одинаковости) АС анализируемого объекта и известных АС определяемых веществ в условиях применяемого метода анализа. Для этого данным методом предварительно исследуют эталонные вещества, в которых наличие определяемых веществ заведомо известно. Например, установлено, что присутствие спектральной линии с длиной волны 350,11 нм в эмиссионном спектре сплава, при возбуждении спектра электрической дугой, свидетельствует о наличии в сплаве бария; посинение водного раствора при добавлении к нему крахмала является АС на присутствие в нем I2 и наоборот. Детально разработанный качественный химический анализ позволяет определять элементный (атомный), ионный, молекулярный (вещественный), функциональный, структурный и фазовый составы неорганических и органических веществ. При анализе неорганических веществ основное значение имеют элементный и ионный анализы, так как знание элементного и ионного состава достаточно для установления вещественного состава неорганических веществ. Свойства органических веществ определяются их элементным составом, но также и структурой, наличием разнообразных функциональных групп. Поэтому анализ органических веществ имеет свою специфику. Качественный химический анализ базируется на системе химических реакций, характерных для данного вещества - разделения, отделения и обнаружения. К химическим реакциям в качественном анализе предъявляют следующие требования. 1. Реакция должна протекать практически мгновенно. 2. Реакция должна быть необратимой. 3. Реакция должна сопровождаться внешним эффектом (АС): а) изменением окраски раствора; б) образованием или растворением осадка; в) выделением газообразных веществ; г) окрашиванием пламени и др. 4. Реакция должна быть чувствительной и по возможности специфичной. Реакции, позволяющие получить внешний эффект с определяемым веществом, называют аналитическими, а добавляемое для этого вещество -реагентом. Аналитические реакции, проводимые между твердыми веществами, относят к реакциям «сухим путем», а в растворах - «мокрым путем». К реакциям «сухим путем» относятся реакции, выполняемые путем растирания твердого исследуемого вещества с твердым реагентом, а также путем получения окрашенных стекол (перлов) при сплавлении некоторых элементов с бурой. Значительно чаще анализ проводят «мокрым путем», для чего анализируемое вещество переводят в раствор. Реакции с растворами могут выполняться пробирочным, капельным и микрокристалли-ческим методами. При пробирочномполумикроанализе его выполняют в пробирках вместимостью 2-5см3. Для отделения осадков используют центрифугирование, а выпаривание ведут в фарфоровых чашечках или тиглях. Капельный анализ (Н.А. Тананаев, 1920 г.) осуществляют на фарфоровых пластинках или полосках фильтрованной бумаги, получая цветные реакции при добавлении к одной капле раствора вещества одной капли раствора реактива. Микрокристаллический анализ основан на обнаружении компонентов с помощью реакций, в результате которых образуются соединения с характерным цветом и формой кристаллов, наблюдаемых в микроскоп. 1.2Количественный анализ Количественный анализ - определение содержания (массы, концентрации и т.п.) или количественных соотношений компонентов в анализируемом образце. Определяемыми компонентами могут быть атомы, молекулы, изотопы, функциональные группы, фазы и т. п. Обычно количественный анализ основан на использовании зависимости доступных измерению физических свойств изучаемого объекта или продукта его преобразования от состава. В основе количественного химического анализа лежит химическая реакция между определяемым веществом и веществом реагентом. К химическим реакциям, применяемым в этом анализе, предъявляют следующие требования: 1) реакция должна протекать достаточно быстро и быть практически необратимой; 2) вещества, вступившие в реакцию, должны реагировать в строго определенных количественных соотношениях, т.е. реакция должна быть стехиометрической и не сопровождаться побочными реакциями; 3) в результате реакции должны получаться соединения с определенным молекулярным составом; 4) на ход реакции не должны оказывать влияние примеси, присутствующие в анализируемом веществе; 5) реакция должна позволять достаточно просто устанавливать момент ее окончания, а также массу продукта реакции или объем раствора реагента, затраченный на ее проведение. 2. Методы количественного анализа 2.1Амперометрическое титрование Амперометрическое титрование, метод количественного анализа, основанный на волътамперометрии с линейной разверткой потенциала. Конечную точку титрования устанавливают по зависимости диффузионного тока Idпри постоянном потенциалеЕс индикаторного электрода от объема V прибавленного титранта. 2.2Потенциометрическое титрование Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Это наблюдается, конечно, лишь тогда когда хотя бы один из участников реакции титрования является участником электродного процесса. 2.3Кислотно-основное титрование В кислотно-основном титровании в качестве индикаторного обычно используют стеклянный электрод, как правило, входящий в комплект серийно выпускаемых промышленностью pH-метров. Потенциометрический метод позволяет провести количественное определение компонентов в смеси кислот, если константы диссоциации различаются не менее чем на три порядка. Например, при титровании смеси, содержащей хлороводородную (HCl) и уксусную кислоты, на кривой титрования обнаруживается два скачка. Первый свидетельствует об окончании титрования HCl, второй скачок наблюдается при оттитровывании уксусной кислоты. Также несколько скачков имеют кривые титрования многоосновных кислот, константы диссоциации которых существенно различаются (хромовая, фосфорная и др.). Широкие возможности анализа многокомпонентных смесей без разделения открывает применение неводных растворителей. Например, определение содержания хлороводородной и монохлоруксусной кислот в смеси титрованием водного раствора является сложной задачей в связи с трудностью обнаружения двух скачков титрования. При титровании в ацетоне оба скачка выражены достаточно четко и содержание каждой кислоты в смеси может быть рассчитано. 2.4Комплексонометрическое титрование Потенциометрическое титрование катионов комплексоном III (ЭДТА) можно проводить с использованием в качестве индикаторного электрода соответствующего металла: титрование солей меди с медным электродом, солей цинка с цинковым и т.д. или подходящего ионоселективного электрода. Однако, многие металлические индикаторные электроды необратимы, а число ионоселективных электродов невелико. Для комплексонометрических титрований может быть использован универсальный электрод Hg|HgY2- или Au(Hg)|HgY2- где Au(Hg) - амальгамированное золото; HgY2- - комплекс ртути с анионом этилендиаминтетрауксусной кислоты. С помощью ртутного электрода этого типа могут быть оттитрованы любые ионы, которые образуют с Y4- комплексы с константой устойчивости, не превышающей константу устойчивости ртутного комплекса. Это, например, ионы магния (Mg2+), кальция (Ca2+), кобальта (Co2+), никеля (Ni2+), меди (Cu2+), цинка (Zn2+) и др. 2.5Титрование по методу осаждения Индикаторными электродами в методах потенциометрического титрования, использующих реакции осаждения, служат металлические или мембранные электроды, чувствительные к определяемому иону или иону-осадителю. Практически по методу осаждения могут быть определены катионы серебра, ртути, цинка, свинца, анионы хлора, брома, иода и некоторые другие. Смесь галогенидов, например I- и Cl-, может быть оттитрована без разделения нитратом серебра. Серебряный электрод позволяет фиксировать два скачка в ходе такого титрования. Первый скачок свидетельствует об оттитровываниииодид-иона и может быть использован для расчета содержания этого иона, второй скачок относится к окончанию осаждения хлорид-иона. По второму скачку можно рассчитать суммарное содержание галогенидов или концентрацию хлорид-иона, если концентрация иодид-иона будет известна из данных по титрованию до первого скачка. 2.6Окислительно-восстановительное титрование Кривые окислительно-восстановительного титрования могут быть построены в координатах или pM - V (титранта) или E - V (титранта), если pM=-lg[M] ([M] - концентрация участника реакции, E - потенциал системы, V (титранта) - объем титранта. Кривые титрования первого типа представляют практический интерес, когда имеется индикаторный электрод, чувствительный к M. Кривые второго типа имеют более общее значение, так как любое окислительно-восстановительное титрование может быть проведено по измерению E с использованием индикаторного электрода из благородного металла, чаще всего платины.
Контрольные вопросы
Что такое химическаяидентефикация?
Какиевиы анализа существуют?
Каковы критерии качественного анализа?
Какие виды титрования вы знаете?
На чем основано окислительно-восстановительное титрование?
На чем основано потенциометрическое титрование?
Какой электрод используют чаще всего в кислотно-основном титровании?
Лабораторная работа №1.
Тема: Правила техники безопасности и методика проведения работ в химической лаборатории.
Цель занятия: Ознакомление с правилами работы в химической лаборатории и техникой безопасности, лабораторным оборудованием и химической посудой.
План занятия:
Правила по технике безопасности (правила работы в лаборатории).
Лабораторное оборудование, химическая посуда, реактивы.
Материалы и оборудование: аппарат Киппа, штатив с пробирками, горелка, шпатели, стеклянные палочки, стеклянные трубки, стаканы, плоскодонные, конические и круглодонные колбы, цилиндры, мензурки, пипетки.
Лабораторный практикум
Техника безопасности и меры предосторожности
Все опыты, связанные с применением или образованием ядовитых или вредных веществ, следует проводить только в вытяжном шкафу при включенной вентиляции.
Запрещается проводить опыты со всевозможными взрывчатыми или огнеопасными смесями. Опыты с небольшими количествами (1-2 мл) легко воспламеняющихся веществ необходимо проводить вдали от открытого огня или включенных нагревательных приборов.
При нагревании или кипячении в пробирке необходимо пользоваться держателями и следить за тем, чтобы отверстие пробирки не было направлено в сторону самого работающего или соседа Это особенно важно соблюдать при нагревании концентрированных растворов кислот и щелочей.
Не следует наклоняться над сосудом, в котором происходит нагревание или кипячение жидкости, во избежание попадания брызг в лицо или глаза.
При необходимости определить запах выделяющихся паров или газов нельзя вдыхать их непосредственно из рабочего сосуда. Необходимо легкими движениями руки направить пары или газы к себе и осторожно вдохнуть.
При разбавлении концентрированных кислот или щелочей следует небольшими порциями вливать кислоту или щелочь в воду, а не наоборот.
Зажженную спиртовую горелку категорически запрещается наклонять во избежание «проскока» пламени внутрь горелки.
Если была разлита легко воспламеняющаяся жидкость, следует тотчас же погасить все находящиеся поблизости горелки, засыпать разлитую жидкость песком, собрать его и перенести в предназначенную для этого емкость.
Общие правила работы в химической лаборатории
До начала занятия необходимо внимательно ознакомиться с темой работы, используя методические указания, учебники и конспект лекций.
В химической лаборатории следует работать в халате
В лаборатории категорически запрещается принимать пищу, курить, включать или выключать рубильники, а также трогать приборы, не относящиеся к данной работе.
Рабочее место необходимо содержать в чистоте, не загромождая его предметами, не относящимися к данной работе.
Реактивы, пролитые или рассыпанные на столе или на полу, следует тотчас же нейтрализовать и убрать.
Лишние книги, журналы и тетради не должны находиться на рабочем столе. Методические пособия, рабочие тетради следует оберегать от попадания на них воды, кислот, щелочей и других химических реактивов.
Реактивы, предназначенные для общего пользования, нельзя уносить на свое рабочее место.
Если реактив взят в избытке или полностью не израсходован, категорически воспрещается выливать его обратно в склянку с реактивом.
После окончания работы необходимо убрать рабочее место, отключить электрические приборы, закрыть воду.
Категорически запрещается проводить опыты, не относящиеся к даннойработе.
Оказание первой помощи
При воспламенении горючей жидкости на одежде работающего необходимонемедленнопогасить пламя на пострадавшем, завернув его в шерстяное илипроасбестованное одеяло.
При ожогах концентрированными растворами кислот пораженное место следует промыть сильной струей холодной воды в течение нескольких минут. Затем 2-3%-ным раствором соды, после чего наложить повязку, смоченную 1-2%-ным раствором перманганата калия. При сильных ожогах следует после оказания первой помощи обратиться к врачу.
При ожогах концентрированными растворами щелочей пораженное место следует промыть большим количеством холодной воды до тех пор, пока кожа перестанет казаться скользкой, затем 1-2%-ным раствором борной или уксусной кислоты, после чего наложить повязку, смоченную спиртовым раствором танина или 1-2%-ным раствором перманганата калия.
При термических ожогах пострадавшее место необходимо многократно смочить раствором перманганата калия и спиртом, затем смазать мазью от ожогов.
При попадании какого-либо химического реактива в глаза следует промыть их обильным количеством воды и немедленно обратиться к врачу.
При отравлении газообразными веществами следует немедленно вывести пострадавшего на свежий воздух, а затем направить к врачу.
При отравлении соединениями мышьяка или ртути необходимо немедленно обратиться к врачу.
Химическая посуда и лабораторное оборудование
Стеклянная посуда общего назначения.
Основным требованием, предъявляемым к стеклянной посуде, является ее химическая и термическая устойчивость. Химическая устойчивость - это свойство стекла противостоять разрушающему действию растворов щелочей, кислот и других веществ. Термическая устойчивость -способность посуды выдерживать резкие колебания температуры.
Лучшим стеклом для изготовления лабораторной посуды считается пирекс. Этот тип стекла обладает термической и химической устойчивостью, имеет малый коэффициент термического расширения. Пирексное стекло содержит 80% оксида кремния (IV). Температура размягчения его около +620°С. Для проведения опытов при высоких температурах используют посуду из кварцевого стекла. Кварцевое стекло содержит 99,95% оксида кремния (IV), температура размягчения его +1650°С.
Лабораторную посуду изготавливают в основном из стекла типов ТУ (термически устойчивое), ХУ-1 и ХУ-2 (химически устойчивое). Содержание оксида кремния (IV) в обычном лабораторном стекле составляет 70%.
В лабораторной практике наибольшее распространение получили следующие виды стеклянной посуды:
Пробирки простые и калиброванные (с делениями, указывающими объем) (рис. 1) используют для проведения опытов с небольшим количеством реактивов. Объем реактива в пробирке не должен превышать половины ее объема.
Лабораторные стаканы (рис. 2) выпускают различных размеров, с носиком и без носика, простые и калиброванные. Стаканы предназначены для выполнения самых разнообразных процедур.

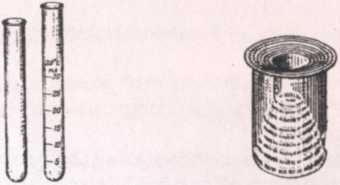
Рис. 1Рис. 2
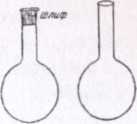
Колбы различного размера и формы (круглые, конические, плоскодонные - рис.3, круглодонные - рис. 4). Например, в лабораторной практике широко применяют конические плоскодонные колбы (колбы Эрленмейера). Колба Вюрца (рис. 5) представляет собой круглодонную колбу с отводной трубкой под углом 60-80°. Ее используют для получения газов и для отгонки жидкостей при атмосферном давлении
Воронки химические служат для переливания жидкостей и фильтрования; капельные воронки (рис. 6) используют для введения в
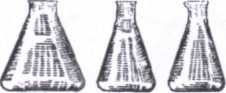
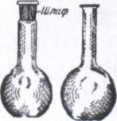
Рис. 3 Рис.4
 .
.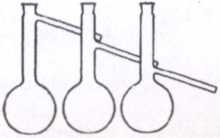
Рис.5 Рис.6
реакционную среду жидкихреактивов небольшими порциями. Воронки делительные (рис. 7) применяют для разделения несмешивающихся жидкостей.
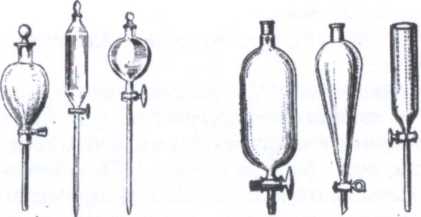
Рис. 7
Рис. 6

Капельницы используют для введения реактивов малыми порциями, по каплям.
Бюксы предназначены для взвешивания и хранения жидких и твердых веществ.
Часовые стекла используют для проведения реакций в малых объемах (капельные реакции) и для взвешивания твердых веществ.
Холодильники применяются для охлаждения и конденсации паров, образующихся при нагревании различных веществ. При перегонке применяют прямые холодильники (Либиха) (рис. 8), а при кипячении растворов и жидкостей, экстракции и других подобных процессах используют обратные холодильники (рис. 9).
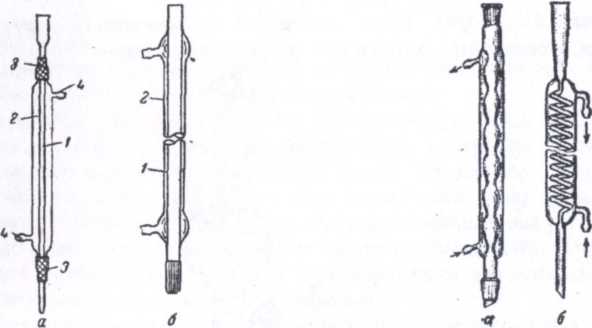
Рис. 8. А - с резиновыми муфтами; б - со шлифом; 1 - форштос; 2 - рубашка; 3 - соединительные резиновые трубки (муфты); 4 - отростки
Кристаллизаторы (рис. 10) применяют для получения кристаллов веществ из насыщенных растворов или для охлаждения химических стаканов или колб с реагирующими веществами.
Аллонжи (рис. 11) играют роль соединительных элементов в установках по пергонке веществ.
Рис.
12

 ксикаторы
(рис. 12)
применяют для медленного высушивания
и хранения веществ, легко поглощающих
влагу из воздуха. Нижнюю часть эксикатора
заполняют водопоглощающими веществами
(прокаленный хлорид кальция,
концентрированная серная кислота, оксид
фосфора (V) и др.). Над поглотителем на
фарфоровом вкладыше помещают бюксы или
тигли с веществами, подлежащими осушке.
Различают два основных типа эксикаторов:
обычные эксикаторы
и вакуум-эксикаторы.
ксикаторы
(рис. 12)
применяют для медленного высушивания
и хранения веществ, легко поглощающих
влагу из воздуха. Нижнюю часть эксикатора
заполняют водопоглощающими веществами
(прокаленный хлорид кальция,
концентрированная серная кислота, оксид
фосфора (V) и др.). Над поглотителем на
фарфоровом вкладыше помещают бюксы или
тигли с веществами, подлежащими осушке.
Различают два основных типа эксикаторов:
обычные эксикаторы
и вакуум-эксикаторы.
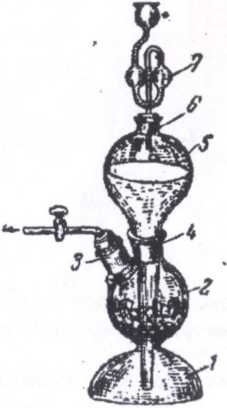
Аппарат Киппа (рис. 13) - прибор для периодического получения водорода, сероводорода, оксида углерода (IV) и других газов в лаборатории.
Рис. 13. Аппарат Киппа: 1 - резервуар; 2 - шарообразное расширение; 3 - тубус для отвода газа; 4 - горло шарообразного расширения; 5 - грушевидная воронка; б - горло воронки; 7 - предохранительная воронка
Фарфоровая посуда
По сравнению со стеклянной обладает большей химической устойчивостью к кислотам и щелочам, большей термостойкостью. Фарфоровые изделия можно нагревать до температуры около 1200°С. Недостатком ее является непрозрачность и сравнительно большая масса. Фарфоровая посуда также разнообразна по форме и назначению.Стаканы бывают различной емкости, с ручкой и без ручки, с носиком и без носика.
Фарфоровые кружки так же бывают различной емкости (обычно от 250 мл до 2-х литров.)
Выпарительные чашки используют для выпаривания и нагревания жидкостей.
Тигли - сосуды, применяемые для прокаливания различных твердых веществ (осадков, минералов и т.п.), а также для сплавления и сжигания. При прокаливании веществ на пламени газовой горелки тигли закрепляют в проволочных треугольниках с фарфоровыми трубками.
Фарфоровые ступки спестикамприменяют для измельчения твердых веществ. Перед работой ступка должна быть тщательно вымыта и высушена. Вещество насыпают в ступку в количестве не более 1/3 ее объема (иначе оно будет высыпаться из ступки при измельчении). При растворении твердого вещества в ступке (с одновременным растиранием) вначале насыпают твердое вещество, а затем к нему постепенно небольшими порциями при круговом движении пестика добавляют жидкость. Всю жидкость, которую берут для растворения, употреблять не следует: не менее 1/3 количества ее оставляют для того, чтобы по окончании растворения сполоснуть ступку и обмыть пестик, после чего этот раствор добавляют к ранее полученному раствору.
Фарфоровые ложки-шпатели применяют для отбора веществ, для снятия осадков с фильтров и при многих других работах.
Воронки Бюхнера и фарфоровые сетки применяют для фильтрования жидкостей при пониженном давлении (под вакуумом).
Мерная посуда.
Для измерения объемов жидкостей используют разнообразную мерную посуду: мерные колбы, мерные цилиндры, мензурки, пипетки и др.
Мерные колбы служат для приготовления растворов точной концентрации и представляют собой круглые плоскодонные колбы с длинным и узким горлом, на котором нанесена тонкая черта. Эта отметка показывает границу, до которой следует наливать жидкость, чтобы ее объем соответствовал указанному на колбе значению. Цифры на колбе показывают объем жидкости (мл), на который она рассчитана. Мерные колбы обычно имеют притертые пробки. Применяют колбы на 50,100,250, 500 и 1000 мл.
Мерные колбы меньшего объема, использующиеся для определения плотности жидкостей, называются пикнометрами.
Мерные цилиндры представляют собой стеклянные сосуды, которые для большей устойчивости имеют широкое основание (дно) или специальную подставку. Снаружи на стенках цилиндров нанесены деления, указывающие объем (в мл). Мерные цилиндры бывают различной емкости: от 5 мл до 2 л Их назначение - измерять (с определенной погрешностью) различные объемы жидкости.
Мензурки -это сосуды конической формы с делениями на стенке.
Пипетки служат для отбора точно определенных относительно небольших объемов жидкостей. Они представляют собой стеклянные трубки небольшого диаметра с делениями. Некоторые пипетки имеют расширение посредине (пипетки Мора). Нижний конец пипетки слегка оттянут и имеет внутренний диаметр до 1 мм. На верхнем конце пипетки имеется метка, до которой набирают жидкость. Некоторые пипетки снабжены двумя метками. Обычно пипетки имеют емкость от 1 до 100 мл.
Бюретки служат для отмеривания точных объемов жидкостей, преимущественно при химико-аналитических работах (титрование). Они могут иметь различную конструкцию и иметь разный объем.
Пластмассовая посуда
В лабораторной практике используют посуду, изготовленную из полимерных материалов (полиэтилен, полипропилен, фторопласт и др.) При высокой химической устойчивости такая посуда обладает низкой термостойкостью, и поэтому ее обычно используют в работах, не требующих нагревания. Из полиэтилена изготовляют воронки для жидких и сыпучих веществ, промывалки, капельницы, флаконы и банки для транспортировки и хранения химических реактивов, пробирки для центрифугирования, пипет-дозаторы и наконечники к ним и др.
Металлическое оборудование.
В химических лабораториях широко применяют разнообразное металлическое оборудование, преимущественно стальное.
Штативы с набором муфт, лапок и колец используют для закрепления на них во время работы различных приборов, стеклянной посуды (холодильников, колб, делительных воронок и пр.). Кольца, закрепленные на штативе, используют также при нагревании химической посуды на металлических асбестированных сетках газовыми горелками.
Треноги применяют в качестве подставок для различных приборов, колб и пр. Они особенно удобны при нагревании крупных по размеру колб и громоздких приборов.
Держатели для пробирок - приспособления, которые используются при непродолжительном нагревании пробирок.
Пинцеты - приспособления дня захватывания мелких предметов, а также веществ, которые нельзя брать руками, например, металлический натрий.
Тигельные щипцы применяют для захватывания горячих тиглей при извлечении их из муфельной печи, снятия раскаленных тиглей с фарфоровых треугольников и при всех работах, когда приходится иметь дело с раскаленными предметами.
Зажимы - приспособления, используемые для зажимания резиновых трубок. Обычно применяют пружинные зажимы (зажимы Мора) и винтовые (зажимы Гофмана). Последние позволяют легко регулировать скорость вытекания жидкости или интенсивность прохождения газов.
Лабораторные нагревательные приборы.
В лаборатории применяют различные нагревательные приборы: газовые горелки, электрические плитки, бани, сушильные шкафы, муфельные печи и т. п.
Газовые горелки. Наиболее часто применяют газовые горелки Бунзена и Теклю. В газовых горелках предусмотрено регулирование поступления воздуха с помощью вращения диска (горелка Теклю) или поворотом хомутика (горелка Бунзена). Горелка Теклю с регулировочным диском - более совершенный прибор, так как в ней можно точнее регулировать не только доступ воздуха, но и приток газа (с помощью винта). Зажигать газовую горелку нужно только через 1-2 с после пуска газа и при небольшом доступе воздуха. Затем следует отрегулировать доступ воздуха так, чтобы пламя стало несветящимся.
ВНИМАНИЕ! Необходимо помнить, что природный газ ядовит и образует с воздухом взрывоопасные смеси. Поэтому нельзя допускать утечки газа!
Бани. Для продолжительного нагревания в пределах температуры 100-300 С применяют бани: водяную, песчаную и др. Они представляют собой, как правило, металлические чаши, заполненные водой (водяная баня) или сухим, чистым песком, прокаленным для удаления из него органических примесей (песчаная баня). Нагревание бань проводят пламенем газовой горелки. Используются также водяные и песчаные бани с электрообогревом.
Электрические плитки. В тех случаях, когда требуется нагревание, а пользоваться горелками нельзя (например, при перегонке воспламеняющихся легколетучих жидкостей) применяют электрические плитки.
Для нагревания круглодонной стеклянной посуды применяют колбонагреватели.
Печи. Для получения температуры 600-1400 С применяются электрические муфельные печи. С помощью особого регулировочного устройства печь может нагреваться до определенной, заранее заданной температуры.
Сушильные шкафы имеют электрический обогрев и терморегулятор, позволяющий поддерживать постоянную температуру. Для наблюдения за температурой шкаф снабжен термометром. Высушиваемое вещество помещается в сушильный шкаф, отрегулированный на требуемую температуру, и выдерживается в нем при заданной температуре определенное время. В работах количественного характера сушку проводят несколько раз до достижения высушиваемым веществом постоянной массы.
Лабораторная работа № 2
