
- •Тематичний план
- •Тема 7.1 Облік на заводах по виробництву
- •Тема 7.2 Облік на заводах безалкогольних напоїв 268
- •Вступ План
- •Запитання для самоконтролю
- •Питання для самоконтролю
- •Розділ 2. Загальні методи контролю у виробництві солоду, пива та безалкогольних напоїв
- •Тема 2.1. Визначення масової частки вологи План
- •Лабораторне заняття №1
- •Лабораторне заняття №2
- •Тема 2.2. Визначення масової частки розчинних сухих речовин в розчинах. План
- •Поправки на температуру до показників цукроміра
- •Питання для самоконтролю.
- •1. Визначення масової частки сухих речовин в пивному суслі пікнометром.
- •2. Визначення масової частки сухих речовин у пивному суслі ареометром.
- •Лабораторне заняття №4
- •Тема 2.3. Визначення масової і об’ємної частки етилового спирту у водно-спиртових розчинах. План
- •Питання для самоконтролю
- •Лабораторне заняття №5
- •1. Визначення вмісту спирту у водно-спиртових розчинах скляним спиртоміром.
- •2. Визначення спирту у водно-спиртових розчинах пікнометром
- •3. Визначення вмісту спирту у водно-спиртовому розчині рефрактометром.
- •Тема 2.4. Визначення масової частки вуглеводів. План
- •Лабораторне заняття №6
- •Тема 2.5. Визначення масової частки білкових речовин. План
- •Питання для самоконтролю
- •Лабораторне заняття № 7
- •Тема 2.6. Визначення загальної та активної кислотності План
- •Питання для самоконтролю
- •Лабораторне заняття №8
- •1. Визначення загальної кислотності пивного сусла титруванням.
- •2. Визначення активної кислотності рН-метром
- •Тема 2.7. Колориметричні методи аналізу План
- •Питання для самоконтролю
- •Лабораторне заняття № 9
- •2. Визначення забарвленості пива фотоелектроколориметром .
- •Розділ 3 . Аналіз якості сировини для виробництва солоду, пива та безалкогольних напоїв
- •1. Відбір середньої проби ячменю
- •2. Визначення кольору та запаху ячменю згідно гост 10967 - 90. Зерно Методи визначення запаху і кольору
- •3. Визначення вмісту смітної і зернової домішок, дрібного зерна і крупності, згідно гост 13586.2-81 Зерно. Методи визначення смітності, зернової домішки.
- •4. Визначення маси 1000 зерен згідно гост 10842 - 89 Зерно. Метод визначення маси 1000 зерен.
- •5. Визначення зараженості шкідниками. Гост 135864 - 83 Зерно.
- •5.1 Визначення зараженості зерна комахами і кліщами в явній формі.
- •6. Визначення натури зерна (гост 10840-64)
- •7. Визначення енергії і здатності проростання згідно гост 10968 — 88 Зерно. Методи визначення енергії проростання і здатності проростання.
- •8. Визначення вологості згідно гост 13586.5 - 93 Зерно. Метод визначення вологості
- •9. Визначення вмісту крохмалю.
- •10. Визначення вмісту білків згідно з гост 10846 91 Зерно і продукти його переробки. Метод визначення білка.
- •11. Визначення екстрактивності.
- •Хід роботи
- •Визначення зовнішнього вигляду, кольору, аромату хмелепрепарату.
- •2. Визначення масової частки вологи хмелю.
- •________________________________________________________________________________________________________________________________________3. Визначення зольності
- •4. Визначення загальної кількості гірких речовин.
- •5. Визначення зараженості гранул пліснявою у гранульованому (брикетованому) хмелі.
- •6. Аналіз со2-екстракту хмелю
- •6.1. Метод відбору проб.
- •6.2. Визначення зовнішнього вигляду і аромату.
- •6.3. Визначення масової частки сухих речовин.
- •Лабораторне заняття №12
- •Хід роботи
- •1. Відбір середньої проби.
- •3. Визначення вологості цукру-піску. Гост 12570 - 67 «Цукор. Методи визначення вологи».
- •3.1. Визначення вологості цукру методом висушування до постійної маси
- •3.2 Прискорений метод висушування
- •4. Визначення масової частки цукрози . Гост 12571 - 86 «Цукор. Метод визначення сахарози»
- •! Питання з охорони праці, на які необхідно звернути увагу
- •1. Відбір середньої проби.
- •2. Визначення смаку, аромату, кольору, прозорості соків.
- •3. Визначення вмісту спирту в спиртованих плодово-ягідних соках
- •3.1. Метод: дистиляційний, ареометричний.
- •3.2. Метод: дистиляційний, пікнометричний.
- •3.2.1.Підготовка пікнометра до аналізу
- •3.2.2. Визначення маси пікнометра з водою.
- •3.2.3. Визначення маси пікнометра з досліджуваним дистилятом.
- •4. Визначення вмісту екстрактивних речовин у спиртованих соках.
- •5. Визначення кислотності соків
- •Хід роботи
- •Відбір середньої проби
- •2. Визначення масової частки вологи
- •3. Визначення амілолітичної здатності
- •4. Визначення оцукрюючої здатності .
- •5. Результати аналізу.
- •6. Висновки
- •Хід роботи
- •Відбір проби
- •2. Визначення запаху
- •2.1.Визначення запаху при 20с.
- •2.2. Визначення запаху при 60с.
- •3. Визначення смаку.
- •4. Визначення мутності
- •5.Визначення сухого залишку
- •6.Визначення завислих речовин
- •7. Визначення загальної твердості.
- •8. Визначення кальцію і магнію
- •9. Визначення лужності
- •10. Визначення окислюваності
- •Хід роботи
- •1. Лимонна кислота
- •1.1. Відбір проб
- •1.2 Визначення вмісту лимонної кислоти.
- •1.3 Вміст золи в лимонній кислоті .
- •2. Молочна кислота
- •2.1.Відбір проби
- •2.2 Визначення прозорості, смаку
- •2.3. Визначення загальної кількості молочної кислоти
- •Розділ 4 . Аналіз підсобних та допоміжних матеріалів
- •Хід роботи
- •1. Діатоміт. Туу 18329-96 Кізельгур
- •1.2 Визначення масової частки вологи
- •1.3 Визначення густини
- •1.4 Визначення рН водної витяжки
- •2. Аналіз хлорного вапна
- •2.1 Визначення активного хлору
- •3. Гідроксид натрію (сода каустична)
- •4. Карбонат натрію (сода кальцинована)
- •5. Контроль пляшок
- •5.1 Зовнішній вигляд, колір, якість скла пляшок контролюють візуально.
- •5.2. Випробування термічної стійкості
- •Розділ 5 . Аналіз напівфабрикатів та відходів виробництва
- •Хід роботи
- •1.Відбір проб
- •2. Органолептичні показники
- •3. Визначення кількості пророслих і пліснявих зерен
- •4.Визначення масової частки вологи
- •5. Амілолітична активність
- •6. Визначення вмісту вуглеводів (крохмалю)
- •Лабораторне заняття №19
- •Хід роботи
- •1. Відбір середньої проби
- •2. Органолептичні показники солоду: колір, запах, смак
- •2.1 Визначення запаху
- •2.2 Визначення кольору
- •2.3 Визначення смаку
- •3. Фізичні показники: кількість зернових, сміттєвих домішок і крупних зерен солоду; кількість борошнистих, склоподібних і темних зерен
- •3.1.Визначення кількості зернових, сміттєвих домішок і крупності
- •3.2.Визначення кількості борошнистих, склоподібних і темних зерен
- •4.1 Визначення масової частки вологи
- •4.2.Визначення екстрактивності.
- •4.3. Визначення тривалості оцукрювання
- •4.4 Визначення якості фільтрування затору
- •4.5. Визначення активної і титрованої кислотності
- •4.6. Визначення кольору лабораторного сусла
- •4.6.1. Метод колориметричного титрування.
- •4.6.2. Фотоелектроколориметричний метод.
- •4.7 Визначення ступеня розчинення солоду (метод Кольбаха).
- •Хід роботи
- •1. Відбір середньої проби
- •2. Визначення загальної (титрованої) кислотності
- •3. Визначення активної кислотності.
- •4. Визначення вмісту розчинних сухих речовин .
- •5. Визначення в’язкості
- •6. Визначення амінного азоту
- •7. Визначення цукрів оптичним методом (метод Лернера)
- •8. Визначення кінцевого ступеня зброджування.
- •10. Розрахунок відношення цукрів до нецукрів
- •11. Визначення кольору пивного сусла
- •11.1 Метод колориметричного титрування
- •11. 2 Фотоелектроколориметричний метод
- •Лабораторне заняття №21
- •4. Визначення вмісту інвертного цукру
- •Лабораторне заняття № 22
- •Хід роботи
- •1. Визначення вмісту сухих речовин при 20°с
- •2. Визначення загальної кислотності.
- •Лабораторне заняття №23
- •Хід роботи
- •1. Метод відбору проб пивної дробини
- •2.3Овнішній вигляд
- •3. Визначення масової частки вологи
- •4.Визначення вимивного екстракту
- •5. Визначення загального екстракту.
- •6. Визначення не вимивного екстракту
- •Лабораторне заняття №24
- •Хід роботи
- •1. Відбір проб
- •2. Зовнішня оцінка.
- •3.Загальний вміст домішок
- •4. Лужність
- •5. Окислююча спроможність
- •6. Загальна кислотність
- •Розділ 6 . Аналіз готової продукції лабораторне заняття № 25
- •Хід роботи
- •1. Відбір середньої проби
- •2. Визначення видимого екстракту.
- •3. Визначення вмісту спирту (дистиляційний метод).
- •4. Визначення вмісту дійсного екстракту.
- •6. Визначення кінцевого ступеня зброджування.
- •7. Визначення кислотності.
- •8. Визначення кольору.
- •9 Визначення вмісту диоксиду вуглецю.
- •10. Визначення ізогумулона.
- •11. Визначення стійкості пива.
- •12. Дегустаційна оцінка.
- •Лабораторне заняття № 26
- •Хід роботи
- •1. Органолептичні показники якості.
- •2. Визначення кислотності.
- •3. Визначення вмісту сухих речовин.
- •4.Визначення вмісту диоксиду вуглецю.
- •Лабораторне заняття № 27
- •Хід роботи
- •1. Органолептична оцінка якості.
- •2. Визначення загальної кислотності.
- •3. Визначення вмісту спирту.
- •4. Визначення вмісту сухих речовин .
- •Лабораторне заняття №28
- •Хід роботи.
- •Відбір проб.
- •Аналіз герметичності упаковки та повноти наливу.
- •Органолептичне оцінювання якості мінеральних вод.
- •Визначення вмісту аміаку.
- •Визначення вмісту сірководню.
- •Визначення вмісту диоксиду вуглецю.
- •Визначення вмісту наявності катіонів і аніонів.
- •Визначення вмісту гідрокарбонат-іонів.
- •Визначення вмісту іонів кальцію.
- •Визначення вмісту іонів магнію.
- •Питання з охорони праці, на які необхідно
- •Розділ 7 . Облік виробництва солоду, пива та безалкогольних напоїв
- •Тема 7. 1. Облік на заводах по виробництву
- •Тема 7.1.1 Облік сировини. Облік виробництва
- •Облік виробництва солоду.
- •Облік відходів при виробництві солоду.
- •Питання для самоконтролю
- •Тема 7.1.2. Облік виходу та втрат у варильному цеху. План
- •Питання для самоконтролю
- •Тема 7.1.3 Зняття залишків незавершеного виробництва. План
- •Питання для самоконтролю
- •Тема 7.1.4 Розрахунок витрат сировини на 1 дал пива. План
- •Питання для самоконтролю
- •Тема 7.1.5 Складання виробничих звітів План
- •Питання для самоконтролю
- •Практичне заняття №1
- •Теоретичне обгрунтування
- •Розв'язок типової задачі
- •Розв'язок задачі
- •Задачі для самостійного розв’язування
- •Розв’язок задачі
- •Задачі для самостійного розв'язування
- •Розв’язок типової задачі
- •Література
- •Теоретичне обгрунтування
- •Розв’язок типової задачі
- •Задача для самостійного розв’язку
- •Задача для самостійного розв’язку
- •Література
- •Тема 7.2 Облік на заводах безалкогольних
- •Тема 7.2.1 Облік цукру та інших інгредієнтів. План
- •Питання для самоконтролю
- •Практичне заняття № 3
- •Теоретичне обґрунтування
- •Розв’язок типової задачі №1
- •Розв’язок типової задачі №2
- •Розв’язок типової задачі №3
- •Розв’язок типової задачі №4
- •Задачі для самостійного розв’язку
- •Література
- •Література
- •Технологічний журнал солодового цеху
- •Технологічний журнал варильного цеху
- •Технологічний журнал бродильного цеху
- •Технологічний журнал лагерного відділення
- •Журнал обліку передачі пива з лагерного підвалу в цех пляшкового (бочкового) розливу
- •Технологічний журнал цеху пляшкового (бочкового) розливу
2. Визначення активної кислотності рН-метром
Метод оснований на вимірюванні електрорушійної сили, яка виникає в системі двох електродів, занурених в досліджувану рідину і яка лінійно залежить від рН досліджуваного розчину.
Перед початком вимірювань прилад прогрівають протягом 60 хвилин . Потім перевіряють прилад по буферному розчину, який має при температурі 20ºС рН 4,0. Електроди перед занурюванням в досліджуваний розчин ретельно промивають дистильованою водою а потім декілька раз досліджуваним розчином. Температуру сусла або пива доводять до (20,0 ± 0,5)ºС. Після того електроди поміщають в досліджувану рідину і перемикач приладу «Пределы измерения» встановлюють в положення, яке відповідає діапазону рН сусла або пива і здійснюють відлік показів по шкалі приладу.
Обробка результатів. За кінцевий результати приймають середньоарифметичне значення результатів двох паралельних вимірювань рН, відхилення між якими не перевищує 0,1. Результат виражають з точністю до першого десяткового знаку.
Результати :
№ п/п ана-лізу |
Величина рН пивного сусла |
Середнє арифмети-чне значення величини рН |
Розбіжність фактична |
Розбіжність допустима |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Висновки : ________________________________________________________
________________________________________________________________________________________________________________________________________
Підпис викладача ___________ _______________________________________
(прізвище, ім’я, по батькові )
?
Питання для самоконтролю
Що характеризує загальна (титрована) кислотність?
В яких одиницях вимірюється титрована кислотність?
Як визначають титровану кислотність пивного сусла?
В яких межах знаходиться загальна кислотність для конкретних сортів пива і безалкогольних напоїв? (Привести приклади).
Що характеризує активна кислотність? В яких межах вона змінюється?
Які методи використовують для визначення активної кислотності?
В чому полягає суть потенціометричного методу визначення активної кислотності?
Які електроди використовують в якості електродів стандартних та індикаторних (порівняльних)?
Яка будова лабораторного рН-метра ЛПУ-01?
Правила користування приладом ЛПУ-01?
Тема 2.7. Колориметричні методи аналізу План
1. Колориметрія. Закон Бугера- Ламберта – Беєра.
2. Методи візуальної колориметрії:
- метод стандартних серій;
- колориметричне титрування;
- метод порівняння кольору .
3. Об’єктивні методи аналізу. Фотоколориметрія. Будова фотоелектроколориметра.
4. Визначення кольору розчинів фотоколориметром.
Забарвленість напоїв ( пива, квасу, безалкогольних напоїв) визначають колориметричними методами.
Колориметричним аналізом називається кількісне визначення концентрації речовин, які утворюють забарвлені розчини. Методи аналізу, які засновані на зрівнюванні інтенсивності забарвлення досліджуваного розчину і розчину визначеної концентрації – стандартного, називаються колориметричними (колориметрією).
Будь-яка речовина поглинає і відображає електромагнітні випромінювання. Характер і величина поглинання і відображення світла залежать від природи речовини і його концентрації в розчині. Це і використовують для якісного і кількісного аналізу оптичними методами, в частості методами світлопоглинання (світлопропускання).
Якщо пропустити через шар розчину пучок світла з інтенсивністю Іо, то після проходження через цей шар інтенсивність світла зменшиться до Іt.
В основі колориметричних методів аналізу лежить основний закон колориметрії закон Бугера – Ламберта –Беера . Згідно цього закону інтенсивність світлового потоку, що пройшов через розчин або речовину зменшується пропорційно інтенсивності падаючого потоку світла, товщині шару, концентрації розчину і виражається рівнянням:
Іt = Іо * 10 –εСL ,
де Іt – інтенсивність світлового потоку після проходження через розчин концентрацією С і товщиною шару L;
Іо – інтенсивність падаючого світлового потоку;
ε –коефіцієнт, який залежить від довжини хвилі падаючого світла, природи розчинної речовини і температури розчину, його називають молярним коефіцієнтом гасіння.
С – концентрація досліджуваного розчину;
L – товщина шару розчину, м
Відношення інтенсивності світлового потоку, який пройшов через розчин Іt, до інтенсивності падаючого світлового потоку Іо називається пропусканням або прозорістю, і позначається буквою Т:
Іt
Т = Іо = 10 - εСL ,
Прозорість або пропускання визначене для шару розчину товщиною 1 см , називається коефіцієнтом пропускання.
Логарифм величини, зворотній пропусканню, носить назву гасіння Е або оптична густина D:
1 Іо
Е=D
= lg
Т = lg
Іt
= lg
Послідовно, гасіння Е або оптична густина прямопропорційна концентрації речовини в розчині, товщині шару розчину, довжині хвилі природи речовини і температури розчину. Якщо графічно зобразити залежність гасіння від концентрації, відклавши по осі абсцис концентрацію, а по осі ординат – гасіння, то отримаємо пряму лінію, яка йде від початку координат.
гасіння |
Т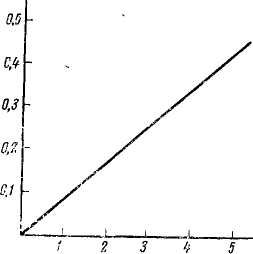 акий
графік дає можливість зробити висновок
про застосування до досліджуваного
розчину основного закону колориметрії.
Якщо розчин підчиняється цьому закону,
то графік, який виражає залежність
гасіння від концентрації, буде
представлений прямою лінією. Якщо розчин
цьому
акий
графік дає можливість зробити висновок
про застосування до досліджуваного
розчину основного закону колориметрії.
Якщо розчин підчиняється цьому закону,
то графік, який виражає залежність
гасіння від концентрації, буде
представлений прямою лінією. Якщо розчин
цьому
Концентрація, мг/дм 3 закону не підчиняється, то прямолі- Залежність гасіння від концентрації нійність порушується на деякій діль-
ниці кривої або по всій її довжині.
3. Розрізняють візуальну колориметрію і фотоелектричну колориметрію.
Візуальна колориметрія основана на порівнянні забарвленості досліджуваного розчину із забарвленістю стандартного розчину за допомогою ока спостерігача. Це є суб’єктивний метод аналізу.
Методи візуальної колориметрії.
Візуальна колориметрія здійснюється по одному з наступних методів:
метод стандартних серій;
метод колориметричного титрування або дублювання;
метод порівняння кольору .
Перші два методи не потребують дотримання основного закону колориметрії; метод порівнювання кольору вимагає дотримуватися цього закону.
Метод стандартних серій
Заснований на зрівнюванні забарвлення досліджуваного розчину з забарвленням набору стандартних розчинів, які відрізняються один від одного інтенсивністю забарвлення на 10-15%. При цьому обов’язковою умовою являється дотримання однакової товщини шару розчину в стандартній серії і досліджуваному розчині. Невідома концентрація досліджуваного розчину рівна концентрації стандартного розчину, забарвлення якого співпадає з забарвленням досліджуваного розчину або знаходиться між двома найближчими більш слабо або більш сильно забарвленими.
Метод стандартних серій використовують у спиртовому виробництві, а саме для визначення вмісту в ректифікованому спирті домішок - альдегідів, сивушного масла, метилового спирту. Забарвлення зрівнюють в пробірках з притертими пробками однакового діаметра з безбарвного скла однакової товщини. Пробірки поміщають в спеціальний штатив і на фоні матового скла або білого паперу зрівнюють забарвлення досліджуваного розчину з забарвленням типових розчинів.
Вміст сивушного масла в спирті можна визначити по реакції з пара-диметиламінобензальдегідом. Метод заснований на кольоровій реакції ізоамілового, ізобутилового і пропілового спиртів з пара-диметиламінобензальдегідом.
Хід роботи . Відміряють піпеткою на 1 см3 0,5 см3 досліджуваного спирту в чисту суху колбу з довгим горлишком, куди додають з мірного циліндра 10 см3 розчину пара-диметиламінобензальдегіду. Вмістиме перемішують , колбу занурюють в киплячу водяну баню і витримують при кипінні води рівно 20 хв. Після 20 хв. колбу охолоджують. При цьому вмістиме колби набуває світло-жовтувато-рожевого забарвлення, яке переходить в рожевий різної інтенсивності в залежності від вмісту сивушного масла.
Вмістиме колби переливають в пробірку з притертою пробкою і зрівнюють з забарвленням типових розчинів, які піддавалися такій же обробці, що і досліджуваний спирт. По зрівнюванню забарвлення визначають вміст сивушного масла в досліджуваному спирті.
Метод колориметричного титрування.
В цьому випадку певний об’єм забарвленого досліджуваного розчину невідомої концентрації зрівнюють з таким же об’ємом дистильованої води, до якої додають стандартний розчин відомої концентрації. В якості стандартного розчину використовують розчин йоду концентрацією 0,1 моль/дм3 .
Найчастіше цей метод застосовують в пивоварному і безалкогольному виробництві та у виробництві квасу при визначенні напою ( пива, квасу), напівфабрикатів ( молоде пиво, пивне сусло), а також забарвленості солоду.
Хід роботи. Два однакових хімічних стакана ємкістю 150-200 см3 ставлять на білий папір або на білу фарфорову пластинку. В один наливають 100 см3 пива, в другий – 100 см3 дистильованої води. В стакан з водою добавляють з бюретки при помішуванні йод концентрацією 0,1 моль/дм3 до тих пір, доки колір рідин не стане однаковим при розгляданні як зверху, так і збоку.
Одиниці вимірювання кольорності: см3 розчину йоду концентрацією 0,1 моль/дм3, що пішов на титрування 100 см3 дистильованої води.
Метод порівняння кольору.
Уявимо собі, що маємо два забарвлених розчина, які містять одну й ту ж забарвлюючу речовину, але в різних концентраціях. Гасіння кожного з розчинів буде відповідно дорівнювати
Е1=ε С1L1 і Е2= ε С2L2
Змінюючи товщину шару цих розчинів(l), можна добитися такого стану, при якому, не дивлячись на різні концентрації, інтенсивність світлового потоку, який пройшов через два розчини, буде однакова – наступить оптична рівновага. Це відбудеться тоді, коли два розчини будуть поглинати одну й ту ж долю світла, тобто коли гасіння розчинів будуть рівні; при цьому Е1=Е2 і ε С1L1 = εС2 l2. Коефіцієнт погашення обох розчинів один і той же. Звідси,
С1L1 = С2 l2
Або L1 C2
L2 = C1
Тобто товщина шарів розчинів при однаковому спостереженню забарвлення обернено пропорційна концентрації розчинів. Ця залежність між товщиною шару і концентрацією лежить в основі методу порівняння кольору.
Порівняння кольору проводять в спеціальних приладах – колориметрах. Найбільш розповсюдженим являється колориметр системи Дюбоска. Світловий потік від дзеркала проходить через шар досліджуваного розчину в кюветі, завантажувач, призму, лінзи і попадає в окуляр, освітлюючи праву половину оптичного поля. Другий світловий потік проходить через шар стандартного розчину в кюветі, завантажувач, призму, лінзи і попадає в окуляр, освітлюючи ліву сторону оптичного поля. Змінюючи з допомогою кремальєру висоту столів розчинів, досягають оптичної рівноваги – зникнення границі розподілу.
Цей метод застосовують у лікеро-горілчаному виробництві для визначення забарвленості напоїв.
Фотоелектроколориметрія відноситься до об’єктивних методів аналізу, здійснюється за допомогою фотоелементу, який є основною складовою частиною приладу, який називається фото-електроколориметром.
Фотоелектрична колориметрія зв’язана з використанням фотоелементів. В основі фотоелектричного методу аналізу лежить явище фотоелектричного ефекту (фотоефекту).
Фотоефектом називається явище відриву електронів від атомів речовини під дією світлового потоку.
Фотоефект підчиняється наступним закономірностям :
величина фотоефекту збільшується з збільшенням інтенсивності світлового потоку;
фотоефект виникає при освітленні світлом тільки до визначеної довжини хвилі ( червона границя фотоефекту).
Прилад, в якому світлова енергія перетворюється в електричну, називається фотоелементом.
Для фотоколориметричних аналізів використовують фотоелектроколориметри. В них встановлено два фотоелемента. Світловий потік попадає на них, утворюючи два світло потоки, які направлені в противоположні сторони і взаємно компенсують друг друга. При цьому електричний струм не виникає. Якщо на шляху одного світлового потоку поставити досліджуваний розчин, компенсація порушується і стрілка мікроампер метра відхилиться на величину, яка пропорційна концентрації досліджуваного розчину.
З допомогою фотоелектроколориметрів визначають оптичну густину розчинів.
Щоб визначити вміст в розчині тих чи інших речовин, будують калібрувальну пряму по розчинам з відомою концентрацією речовин. На осі абсцис відкладають концентрацію розчину, а на осі ординат – оптичну густину. Вимірявши оптичну густину досліджуваного розчину, знаходять його значення на осі ординат, а потім на осі абсцис – значення концентрації. В лабораторній практиці використовуються фотоелектроколориметри КФК -3 ;ФЕК-М,ФЕК-Н-75, ФЕК -56 і ін. В лабораторії безалкогольного і пивоварного виробництва з їх допомогою визначають кольорність, вміст вуглеводів, білків і інших речовин в напівфабрикатах і готових напоях.
Література: [1, с. 74-78] ; [2, с.108-120].
