
- •IV. Химический состав организмов
- •I. Особенности строения и свойств белков
- •II. Элементарный состав белков
- •Элементарный состав белков
- •VI. Оценка гомогенности белка
- •VIII. Оценка формы белковых молекул
- •IX. Аминокислотный состав белков
- •X. Пептиды. Методы их синтеза и биологическая активность (на самостоятельное изучение)
- •XI. Структура белковой молекулы
- •Четвертичная структура белка
- •XIII. Свойства белков
- •XIV. Номенклатура и классификация белков
- •XV. Функции белков в организме (на самостоятельное изучение; стр. 84, 85 в «Основах биохимии» ю.Б. Филипповича).
X. Пептиды. Методы их синтеза и биологическая активность (на самостоятельное изучение)
XI. Структура белковой молекулы
Основной теорией строений белка является полипептидная. Она была предложена Э. Фишером в 1902 году на базе выдвинутых А.Я.Данилевским идей о роли пептидной связи –C(O)–NH– в строении белков. Согласно теории Э. Фишера молекула белка представляет собой гигантский полипептид, построенный из десятков и сотен аминокислотных остатков, соединенных друг с другом пептидными связями. На примере участка полипептидной цепи рассмотрим углы между связями и расстояния между атомами в молекуле белка:
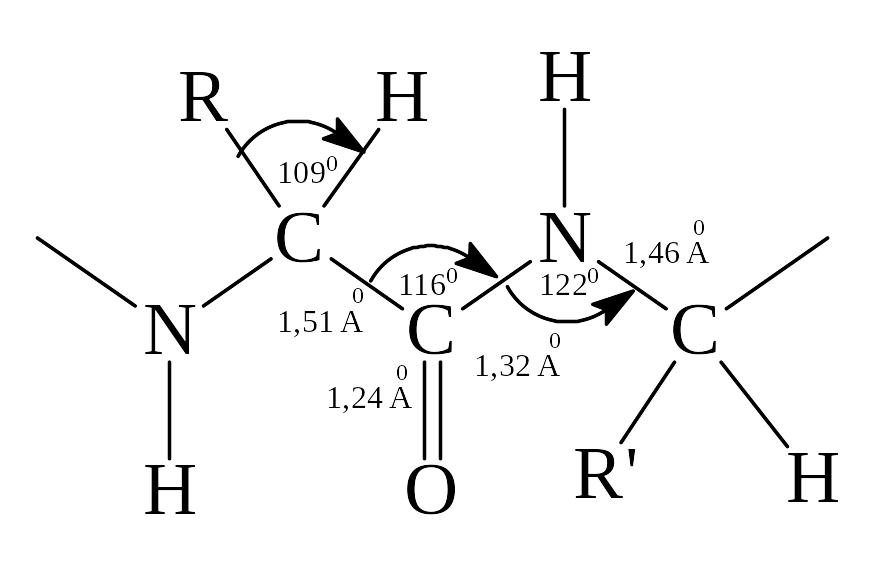
где A0 – ангстрем; 1 A0 = 10–10 м.
Для полипептидной цепи характерны некоторые особенности строения:
1) Характерной особенностью строения полипептидной цепи является то, что атомы углерода и азота в её хребте расположены приблизительно в одной плоскости, а атомы водорода и радикалы направлены к этой плоскости под углом 109028’.
2) Другой особенностью строения полипептидной цепи является особый характер пептидной связи, которая имеет промежуточный характер между одинарной и двойной связями, что видно по её длине – 1,32 A0. Это связано с наличием таутомерии, в которой атом водорода может переходить от атома кислорода к атому азота:
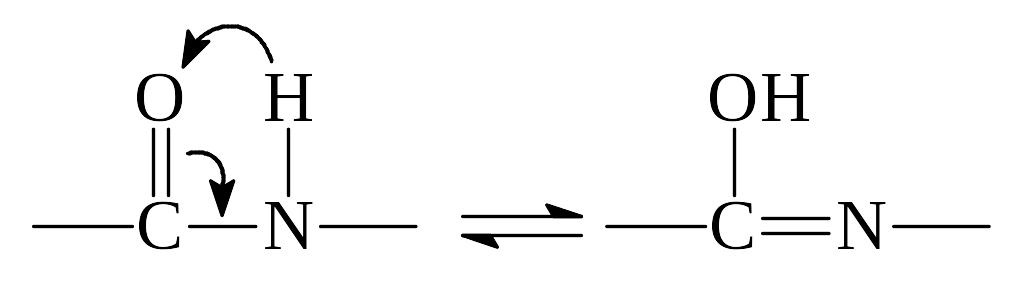
Енольная форма пептидной связи наиболее реакционноспособна. Благодаря этому белки дают цветные реакции.
3) Ещё одним важным свойством полипептидной цепи является то, что главная монотонно построенная цепь («хребет») окружена (обрамлена) разнообразными по своей химической природе радикалами, которые в основном и определяют круг химических реакций, свойственных белковой молекуле.
Последовательность расположения аминокислотных остатков в полипептидной цепи в белковой молекуле называется первичной структурой белка.
Установление первичной структуры – определяющий этап в установлении полной химической формулы белка. Впервые этой проблемой стал заниматься английский биохимик, лауреат Нобелевской премии, Ф. Сенгер. Он разработал стратегию, которая используется и до сих пор.
Для определения первичной структуры белковой молекулы необходимо осуществить 6 основных стадий исследований.
I стадия:
Определение аминокислотного состава белка. Белок подвергают полному гидролизу и с помощью аминокислотного анализа устанавливают качественный и количественный аминокислотный состав. Анализ проводят хроматографическим методом.
II стадия:
Идентификация амино- и карбоксиконцевых остатков полипептидной цепи. Началом полипептидной цепи считают тот конец, который содержит аминогруппу, а окончанием – конец, содержащий карбоксильную группу:
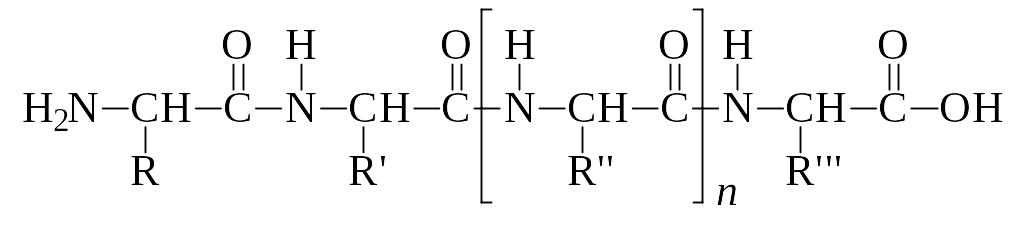
Существует несколько методов определения N-концевых аминокислот:
а) Взаимодействие полипептидной цепи с 2,4-динитрофторбензолом.
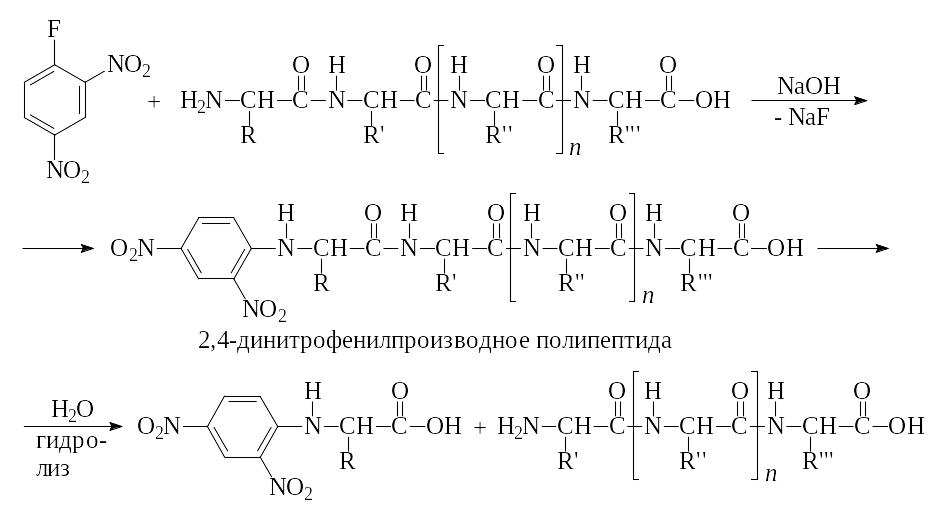
б) Взаимодействие полипептидной цепи с дансилом с образованием соответствующего дансильного производного N-концевой аминокислоты.
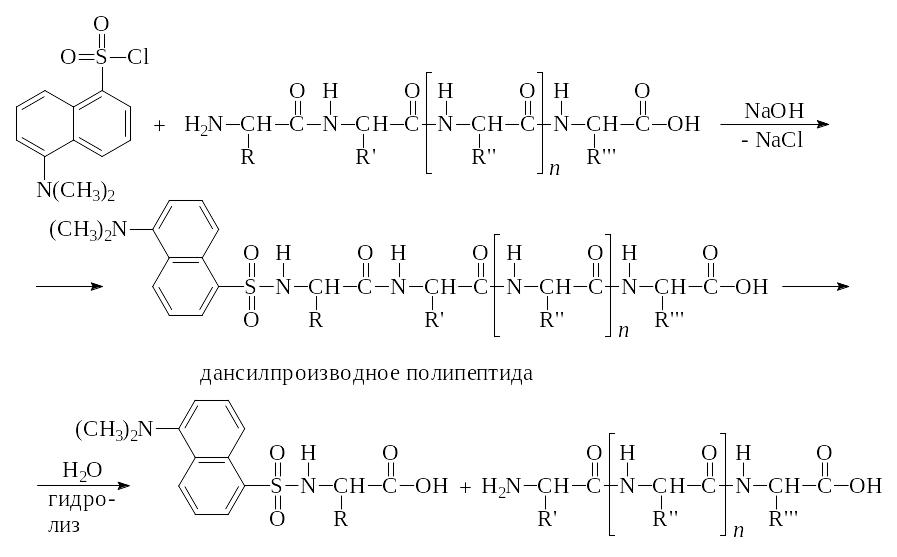
Вторую с N-конца аминокислоту можно определить по методу Ф. Сенгера с помощью гидразинолиза:
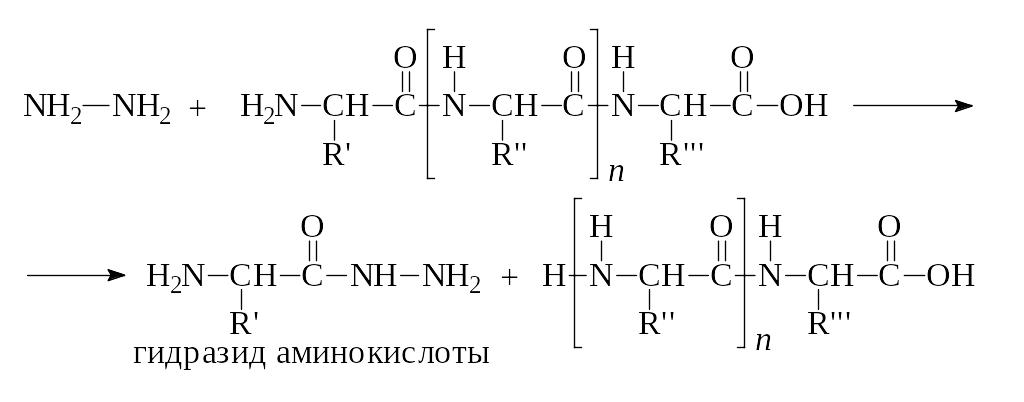
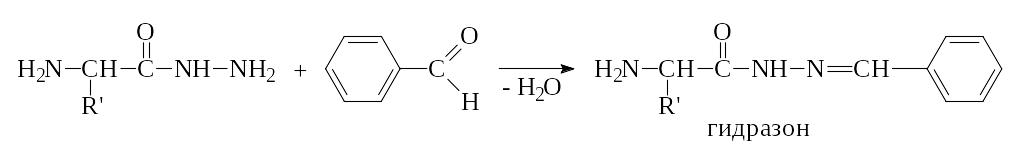
Образовавшийся гиразид аминокислоты вводят в реакцию с бензальдегидом. При этом образуется гидразон, который может быть легко идентифицирован.
III стадия:
Расщепление полипептидной цепи на фрагменты, содержащие 15–30 аминокислотных остатков с помощью специальных ферментов по определенным пептидным связям.
Так, например, трипсин расщепляет пептидные связи в том месте, где содержатся остатки лизина или аргинина, химотрипсин – по остаткам триптофана, фенилаланина или тирозина. Далее производят разделение олигопептидов с помощью хроматографии.
IV стадия:
Определение последовательности аминокислотных остатков в каждом олигопептиде методом Эдмана. В 1950 г. Эдман предложил так называемый фенилизотиоцианатный метод определения аминокислотной последовательности в небольших по длине полипептидных остатках.
Методика Эдмана использует прибор, называемый секвенатор. Современные секвенаторы способны определять аминокислотную последовательность не только в коротких олигопептидах, но и в небольших белках. Секвенатор работает по реакции Эдмана:
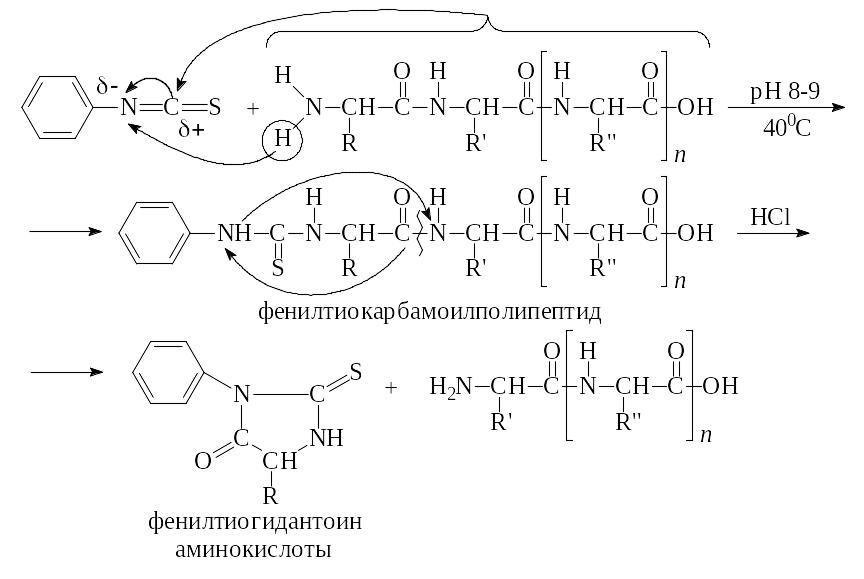
По фенилтиогидантоину аминокислоты легко устанавливают природу N-концевой аминокислоты.
V стадия:
Расщепление исходной полипептидной цепи белка ещё каким-либо способом с использованием реагентов специфического действия, отличного от действия трипсина или химотрипсина. Например, бромциан BrCN расщепляет пептидные связи со стороны карбоксиконцевой аминокислоты.
В результате получают другой набор олигопептидов, который разделяют хроматографически и анализируют фенилизотиоцианатным методом (стадия IV).
VI стадия:
Установление порядка расположения полипептидных остатков по перекрывающимся участкам. Проводят тщательное сравнение с помощью компьютерной программы чередования аминокислот в олигопептидах и выявляют олигопептиды из второго набора с перекрывающимися последовательностями первого набора, что в итоге позволяет правильно соединить олигопептидные фрагменты, полученные в результате первичного расщепления исходной полипептидной цепи.
Если полипептидная цепь слишком сложная, то проводят 3-е, 4-е и последующие расщепления, пока не удастся однозначно в правильном порядке соединить олигопептидные фрагменты.
Однако пространственное строение любого, даже самого простого белка, значительно отличается от той нитевидной формы, которую придает белку первичная структура – аминокислотная последовательность. Практически полностью трёхмерная модель белка соответствует линейной полипептидной цепи лишь в фиброине шелка. Все остальные белки, даже фибриллярные, практически не содержат линейных растянутых полипептидных цепей. На основании рентгеноструктурных анализов белковых молекул были предложены модели свёртывания полипептидных цепей и формирования так называемых вторичной, третичной и четвертичной структуры белков.
Вторичная структура белка.
В 1949 г. Л. Полинг и Р. Кори произвели квантовохимический расчёт термодинамики полипептидных цепей. На основании расчётов они осуществили структурное моделирование полипептидных белковых цепей с учетом длины связей, валентных углов, электроотрицательности атомов, возможных конформационных положений молекулы. В результате они получили модель правозакрученной спирали, стабилизированной за счёт образования водородных связей между атомами водорода и кислорода группировок –NH– и –C(O)– соответственно.
Л. Полинг и Р. Кори выдвинули 2 возможных модели спиралей: -спираль и -спираль. При этом наличие -спиралевидной конформации полностью подтвердилось и является сейчас общепринятым представлением о вторичной структуре белковой молекулы.
-Структурные участки полипептидной цепи стабилизированы, как уже отмечалось, с помощью водородных связей атомов водорода и кислорода, находящихся на противоположных витках спирали. Один полный виток спирали включает 3,6 аминокислотных остатка; «шаг» спирали, соответствующий одному аминокислотному остатку, имеет длину 0,15 нм; расстояние между витками или полный «шаг» – 0,54 нм; угол подъёма витка 260; период идентичности 2,7 нм (18 аминокислотных остатков). Радикалы аминокислот направлены во внешнее пространство, а не внутрь спирали.
Последующие исследования привели к открытию других типов конформации полипептидной цепи – уже упоминавшейся -спирали, -спирали, а также -конформации. При этом было выяснено, что после -спирали второй по распространенности реализованной в природе моделью строения является -слоистая структура. Линейная конформация фрагментов -структуры удерживается также благодаря возникновению водородных связей между параллельно идущими и сближенными на расстояние 0,272 нм (длина водородной связи между –C(O)– и –NH–группами) участками полипептидной цепи.
Возникновение двух способов укладки полипептидной цепи – -спирали и -конформации возможно в результате того, что одни аминокислоты (аланин, глутаминовая кислота, глутамин, лейцин, лизин, метионин и гистидин) являются как бы «спиралеобразующими», т.е. склонными к образованию -спирали, в то время как другие (валин, изолейцин, треонин, тирозин и фенилаланин) способствуют образованию -слоёв. Существует также ряд аминокислот (глицин, серин, аспарагиновая кислота, аспарагин и пролин), которые не позволяют полипептидной цепи в том месте, где они доминируют, упорядочиваться и стимулируют возникновение неупорядоченных фрагментов.
Вообще же белок приобретает свою вторичную и третичную структуры по мере синтеза на рибосоме. При этом водородные связи начинают образовываться, когда соответствующие атомы приближаются друг к другу на расстояние 2,7 А0.
Третичная структура белка.
Первичная и вторичная структуры белка определяют дальнейший способ укладки полипептидных цепей, входящих в состав белка и соединённых ковалентными связями, в трёхмерном пространстве – так называемую третичную структуру, придающую белку его функциональную активность и нативные свойства. Третичная структура является как бы своеобразной архитектоникой белка.
Основные успехи в выяснении сложного вопроса существования третичной структуры белка были связаны с возникновением рентгеноструктурного анализа (РСА) и усовершенствованием его для изучения пространственного строения органических соединений. Это стало возможным, когда разрешение приборов для РСА повысилось до 0,14 нм.
Благодаря этим достижениям в 1957 г. была впервые установлена третичная структура белка миоглобина (Дж. Кендрю).
Формирование третичной структуры обусловлено межрадикальными взаимодействиями аминокислот друг с другом, т.е. в конечном счете первичной структурой белка.
Межрадикальные взаимодействия подразделяются на ковалентные и слабые.
а) К ковалентным взаимодействиям при формировании третичной структуры белка относится образование дисульфидных связей (мостиков) между остатками аминокислоты цистеина, находящимися в разных участках полипептидной цепи, возможное при сближении этих радикалов. По своей сути образование дисульфидных мостиков представляет собой окислительно-восстановительную реакцию:
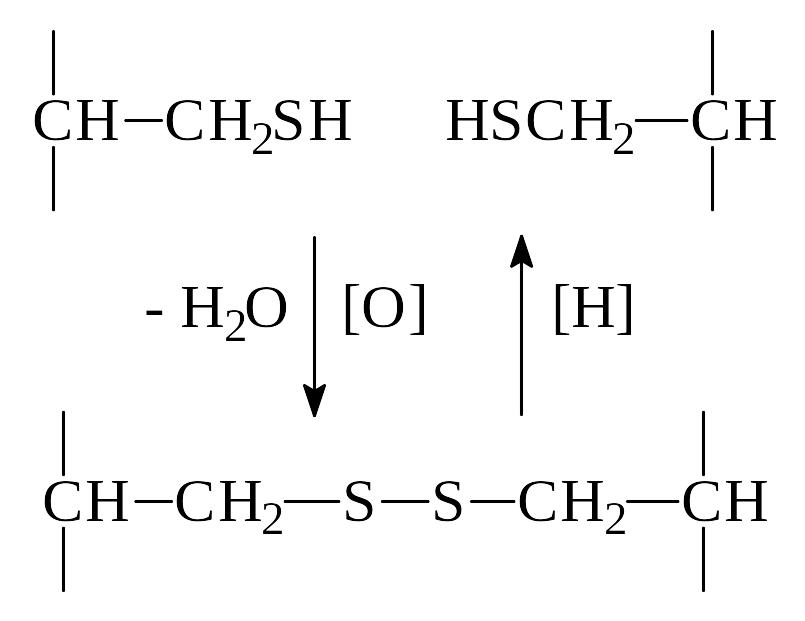
б) К слабым взаимодействиям относятся:
– образование водородных связей (между спиртовыми, фенольными и карбоксильными группами радикалов аминокислот, находящимися на соседствующих участках полипептидной цепи);
– ионные электростатические взаимодействия между радикалами диаминомонокарбоновых кислот и моноаминодикарбоновых кислот;
– взаимодействие между сопряженными -электронными системами в радикалах ароматических аминокислот;
– образование гидрофобных зон («гидрофобных ядер») путём выталкивания алкильных радикалов в «сухую» зону молекулами растворителя и т.д.
На основании представлений о третичной структуре полипептидной цепи в последние десятилетия сформировалось представление о доменной структурной организации белка. Домен – обособленная область молекулы белка, обладающая определенной структурной и функциональной автономией. Таким образом белок может иметь несколько доменов, различающихся по своему пространственному строению и выполняемым функциям и формирующихся благодаря определенной аминокислотной последовательности полипептидной цепи, а также под действием рН среды, ионной силы раствора, взаимодействия белковой молекулы с другими веществами.
