
- •IV. Химический состав организмов
- •I. Особенности строения и свойств белков
- •II. Элементарный состав белков
- •Элементарный состав белков
- •VI. Оценка гомогенности белка
- •VIII. Оценка формы белковых молекул
- •IX. Аминокислотный состав белков
- •X. Пептиды. Методы их синтеза и биологическая активность (на самостоятельное изучение)
- •XI. Структура белковой молекулы
- •Четвертичная структура белка
- •XIII. Свойства белков
- •XIV. Номенклатура и классификация белков
- •XV. Функции белков в организме (на самостоятельное изучение; стр. 84, 85 в «Основах биохимии» ю.Б. Филипповича).
VI. Оценка гомогенности белка
Гомогенность или однородность белка – важнейший его параметр, поскольку свойства белка, его аминокислотный состав, особенности вторичной и третичной структуры, функциональную активность имеет смысл определять только тогда, когда белок индивидуален и не содержит даже мельчайших примесей других белков.
Существует несколько способов оценки гомогенности белка. Самым простейшим, доступным, не требующим сложного оборудования, является хроматографический.
Для этого используется так называемый метод ТСХ – тонкослойной хроматографии (зарисовать установку для ТСХ).
Последовательность действий такова:
На пластинку наносят адсорбент (крахмальный, полиакриламидный гель или силикагель), подсушивают. Выделенный в индивидуальном кристаллическом состоянии белок растворяют в чистом растворителе и наносят небольшое количество раствора белка на хроматографическую пластинку. После этого её помещают в сосуд, на дно которого налито небольшое количество элюента (растворителя, который может хорошо передвигаться по хроматографической пластинке и увлекать за собой белок). Закрывают сосуд для хроматографии. Элюент поднимается вверх по пластинке, увлекая за собой белок. После того, как растворитель дойдет практически до края пластинки, её вынимают, сушат и проявляют парами йода, или смотрят в УФ-лучах.
Если белок индивидуальный, то пятнышко белка, переместившееся из точки ввода белка на пластинке на небольшое расстояние, будет одно. Если же белок загрязнен, пятен будет как минимум два. Однако в случае, если подвижность примесей в данном элюенте схожа с подвижностью белка, хроматографический метод может оказаться неэффективным для оценки гомогенности белка.
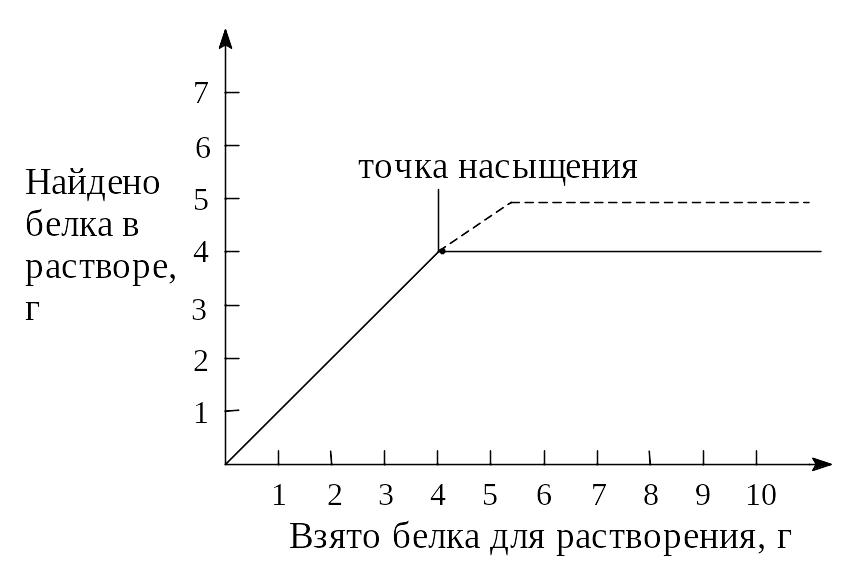
Более эффективен метод оценки гомогенности белка по растворимости. Полученный белок растворяют в чистом растворителе, периодически измеряя оптическими методами количество белка в растворе. При этом количество белка в растворе поначалу увеличивается пропорционально вводимому в раствор кристаллическому белку, достигая через некоторое время точки насыщения, в которой дальнейшее увеличение количества белка в твердой фазе не приводит к увеличению его количества в растворе. Если же график имеет излом в точке насыщения, то анализируемый белок не гомогенен.
VII. Определение молекулярной массы белков
Молекулярная масса белков является очень большой величиной и измеряется в дальтонах (1 Дальтон = 1 а.е.м.). Точное установление её – достаточно сложная задача, требующая выяснения первичной структуры белка, что не всегда представляется возможным. Поэтому чаще всего пользуются приблизительным значением молекулярной массы белков – так называемым физическим значением молекулярной массы белка; она определяется с точностью до нескольких сотен, а иногда и тысяч дальтон.
Существует множество более или менее точных способов определения молекулярной массы белков. Перечислим некоторые из них:
– вискозиметрический (неточный метод; определяется вязкость белкового раствора, а по ней рассчитывается молекулярная масса);
– оптический (не является универсальным; оценивается светорассеивающая способность белкового раствора);
– химический (количественно определяют химический элемент или аминокислоту, содержащуюся в белке в наименьшем количестве; затем производят расчет молекулярной массы, исходя из того, что в молекуле белка не может быть меньше одного атома данного элемента или одного аминокислотного остатка; метод не точен и даёт кратные ошибки, поскольку не учитывается точное число атомов и аминокислотных остатков);
– гельфильтрационный (состоит в определении объема элюента, необходимого для выноса белкам из колонки с сефадексом и соотнесении его со свободным объемом колонки; далее результат соотносят с калибровочными графиками для известных белков и определяют молекулярную массу белков);
Самым точным способом определения, предложенным еще в 20-е годы прошлого века Т. Сведбергом, является гравиметрический. Он основан на ультрацентрифугировании белкового раствора. Белковый раствор окрашивают определенным способом и помещают в небольшую прозрачную для световых лучей ячейку, которую вставляют в специальное гнездо ротора ультрацентрифуги. Ротор начинает вращаться с огромной скоростью, обеспечивая центробежное ускорение в 300 тыс. – 1 млн. 200 тыс. раз превышающее ускорение силы тяжести. Под действием такого ускорения частицы белка достаточно быстро оседают на дно. Фотоприставка к ультрацентрифуге позволяет делать снимки содержимого ячеек через определенные интервалы времени и фиксировать таким образом скорость оседания (седиментации) молекул белка.
Определение массы белка с помощью ультрацентрифуги ведут двумя способами:
– по скорости седиментации молекул;
– по седиментационному равновесию.
В первом случае находят константу седиментации s:
![]() ,
,
где – скорость перемещения белковых молекул в процессе ультрацентрифугирования; 2r – центробежное ускорение, см/с2, – величина, являющаяся технической характеристикой прибора.
Размерность константы седиментации s выражают в секундах. Считается, что 10–13 сек – единица константы седиментации, названная сведбергом (св).
Молекулярная масса белка по методу Сведберга с использованием экспериментально найденной константы седиментации s рассчитывается следующим образом:
![]() ,
,
где R – универсальная газовая постоянная, T – абсолютная температура, D – коэффициент диффузии (зависит от используемого растворителя), – плотность используемого растворителя, – плотность белковых частиц или окрашенного раствора.
С помощью ультрацентрифугирования можно определить молекулярные массы любых растворимых белков, выделенных в индивидуальном состоянии. Для достижения максимального результата и предотвращения ошибок молекулярную массу белков находят несколькими способами, суммируют полученные результаты и находят среднее арифметическое значение массы (при условии сходимости результатов).
