
- •Лекция № 3 поверхностные явления
- •Адсорбция
- •Адсорбция на границе жидкость-жидкость
- •Адсорбция твердыми телами
- •Адсорбция на границе твердое тело-газ (т–г)
- •Лекция № 4
- •Адсорбция растворенного вещества из раствора на твердом адсорбенте (т–ж)
- •Хроматография
- •Классификация хроматографических методов
- •I) По цели проведения
- •II) По агрегатному состоянию подвижной фазы на газовую и жидкостную
- •III) По применяемой технике эксперимента хроматография делится на
- •IV) По механизму разделения хроматографию подразделяют на:
- •Сущность метода осадочной хроматографии
Адсорбция твердыми телами
Твердая поверхность при рассмотрении в электронной микроскоп – шероховата, имеет неровности и выступы. На них возникают не полностью скомпенсированные поля притяжения, обусловленные межмолекулярными силами. Эти неровности и выступы называются активными центрами. На них и происходит в первую очередь адсорбция.
Хорошими адсорбентами являются активированный уголь, силикагель (H2SiO3), аллюмогель (Al(OH3)). Для улучшения их адсорбционных свойств им придают пористость. При этом увеличивается площадь поверхности.
Для
угля, например, это достигается путем
термической обработки. Так получают
активированный уголь. Адсорбцию на
твердых адсорбентах нельзя описать
уравнением Гиббса, так как для твердых
веществ невозможно измерить величину
поверхностного натяжения δ. В данном
случае адсорбцию Г выражают числом
молей, приходящихся на единицу массы
адсорбента
![]() .
.
Адсорбция на границе твердое тело-газ (т–г)
Для газов вместо концентрации используют величину давления. Влияние давления газа на процесс адсорбции имеет сложный характер. Одновременно с адсорбцией идет десорбция адсорбированных молекул в газовую фазу. Скорость адсорбции на легкодоступной поверхности больше, а в порах пористых адсорбентов – меньше.
Графическая зависимость удельной адсорбции Г от концентрации (давления) поглощаемого веществ при постоянной температуре называется изотермой адсорбции.
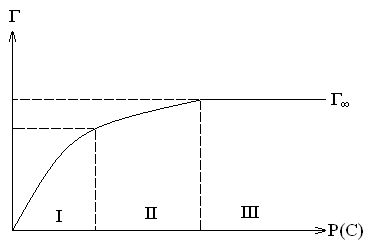
Изотерма содержит 3 участка:
При малых давлениях (I) удельная адсорбция прямо пропорциональна величине P.
При больших давлениях (III) участок изотермы имеет горизонтальной прямой, так как удельная адсорбция, достигнув некоторой величины Г∞, далее не изменятся. Это предельная адсорбция, которая отвечает полному насыщению поверхности адсорбента молекулами адсорбтива и образованию мономолекулярного слоя.
Средний участок (II) изотермы адсорбции соответствует неполному насыщению поверхности.
Лекция № 4
Закономерность, которая выявляет изотерма адсорбции, описывается теорией мономолекулярной адсорбции Лэнгмюра, имеющей следующие основные положения:
Адсорбция происходит не на всей поверхности адсорбента, а только на активных центрах (вершины и впадины неровностей), где имеются участки с некомпенсированными силовыми полями.
Каждый активный центр может удерживать только одну молекулу адсорбтива, при этом адсорбированные молекулы не взаимодействуют со свободными, и поэтому образуется мономолекулярный слой.
Адсорбированные молекулы удерживаются активными центрами только определенное время, затем происходит десорбция.
Исходя из этих положения, Лэнгмюр предложил уравнеие:
![]()
где Г – адсорбция
Г∞ – предельное значение адсорбции, когда все активные центры заняты
K – константа адсорбционного равновесия
P – равновесное давление газа
Это уравнение хорошо описывает приведенную выше изотерму адсорбции.
При P→0, KP<<1, этой величиной в знаменателе можно пренебречь, тогда Г = Г∞·KP – это участок (I) на изотерме.
При P→∞, KP>>1, и в знаменателе можно пренебречь единицей, тогда
Г = Г∞ – это участок (III) на изотерме.
Уравнение Лэнгмюра не описывает II участок изотермы, соответствующий средним значениям давления. Этот участок описывает уравнение Фрейндлиха:
![]()
где Г – адсорбция
x – число молей адсорбента
m – масса адсорбента
P – равновесное давление газа
K и n – эмпирические константы
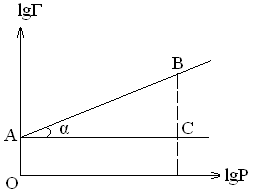
Для определения эмпирических констант используется логарифмическая форма уравнения Фрейндлиха.
![]()
![]()
![]()
При больших концентрациях (давлениях) адсорбтива, на изотерме адсорбции после участка, соответствующего насыщению поверхности, обычно наблюдается резкое увеличение удельной адсорбции. Это происходит из-за перехода от мономолекулярной адсорбции к полимолекулярной, вследствие взаимодействия между адсорбированными молекулами и наслаивания их друг на друга.
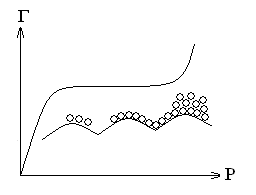
Для пористых адсорбентов полимолекулярная адсорбция при адсорбции паров, сопровождается их капиллярной конденсацией. Сначала пар адсорбируется в порах, а затем конденсируется в жидкость, заполняя самые тонкие капилляры.
