
- •Поверхневі явища та дисперсні системи збірник задач та конторольних питань
- •051301«Хімічна технологія», 051401«Біотехнологія»,
- •051701«Харчова інженерія», 120201«Фармація»
- •Поверхневі явища та їх класифікація. Вплив дисперсності на властивості тіл
- •Програма теоретичного курсу
- •Поверхневі явища та їх класифікація
- •Методи визначення поверхневого натягу
- •Внутрішня енергія поверхні. Залежність поверхневого натягу від температури
- •Адгезія, когезія, змочування і розтікання
- •Вплив дисперсності на властивості тіл
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування1
- •Адсорбційні рівноваги
- •Програма теоретичного курсу
- •Адсорбція газів на однорідній твердій поверхні
- •Адсорбція на пористій поверхні
- •Адсорбція на межі тверде тіло – рідкий розчин
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Електричні явища на поверхні
- •Програма теоретичного курсу
- •Теорії будови подвійного електричного шару
- •Електрокінетичні явища
- •Будова міцел ліофобних золів
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантна задача
- •Агрегативна стійкість та руйнування дисперсних систем. Молекулярно – кінетичні та оптичні властивості дисперсних систем
- •Програма теоретичного курсу
- •Теорія стійкості дисперсних систем длфо
- •Кінетика коагуляції
- •Молекулярно – кінетичні властивості дисперсних систем
- •Седиментація та седиментаційна стійкість
- •Оптичні властивості дисперсних систем
- •Контрольні питання
- •Приклади розв’язування задач
- •4.5 Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Список літератури
- •Навчальне видання поверхневі явища та дисперсні системи збірник задач та конторольних питань
Адсорбційні рівноваги
Програма теоретичного курсу
Адсорбція - це самочинний нерівноважний процес перерозподілу компонентів системи між поверхневим шаром та об’ємною фазою. При цьому відбувається концентрування (накопичення) газу чи розчиненої речовини на межі поділу фаз. Речовина, що перерозподіляється, називається адсорбатом, а рідина чи тверде тіло, на поверхні яких відбувається перерозподіл - адсорбентом.
Внаслідок теплового руху одночасно з адсорбцією відбувається зворотній процес - десорбція.
Кількісно адсорбція може бути виражена:
1. Адсорбція «А» - це кількість адсорбату віднесеного до одиниці маси адсорбенту, [моль/кг], або до одиниці площі поверхні адсорбенту [моль/м2].
2.Адсорбція за Гіббсом «Г», - це різниця між кількістю молів адсорбату в поверхневому шарі (nS) та кількістю його молів в шарі об’єму розчину такої ж товщини (nV), віднесена до одиниці площі міжфазної поверхні [моль/м2].
Г = (nS – nV)/S ( 2.0)
Якщо концентрація адсорбату в поверхневому шарі більша за об’ємну, адсорбцію Г вважають додатною, а якщо навпаки - від’ємною.
Залежності величини адсорбції від рівноважного тиску (або концентрації) адсорбату при сталій температурі: a=f(p) та a=f(c) називають ізотермами адсорбції.
Рушійною силою адсорбції є вирівнювання хімічних потенціалів компонентів в об’ємі та у поверхневому шарі.
Розрізняють фізичну, або Ван-дер-ваальсову, адсорбцію та хімічну, або хемосорбцію.
В залежності від природи адсорбату і адсорбенту адсорбцію можна класифікувати наступним чином:
адсорбцію газів на твердій поверхні;
адсорбцію розчиненої речовини на межі розчин – тверде тіло;
адсорбцію розчиненої речовини на межі розчин – газ.
Адсорбція газів на однорідній твердій поверхні
Адсорбція в мономолекулярному шарі при невеликих значеннях тиску або концентрації описується рівнянням ізотерми адсорбції Генрі:
А=КГс, або А=КГр ( 2.0)
Адсорбція в мономолекулярному шарі при довільних значеннях тиску або концентрації описується рівнянням ізотерми адсорбції теорії Ленгмюра:
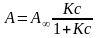 або
або
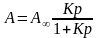 (
2.0)
(
2.0)
Для розрахунку параметрів рівняння Ленгмюра його зручно використовувати в лінійній формі:
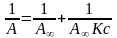 (
2.0)
(
2.0)
В координатах 1/А=f(1/с) це - рівняння прямої лінії, яка відтинає на осі ординат відрізок рівний 1/А∞ з тангенсом кута нахилу
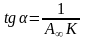 (
2.0)
(
2.0)
За значенням А∞ можна розрахувати питому поверхню адсорбенту:
Sпит = A∞NАSо, де ( 2.0),
де Sо – площа, яку займає одна молекула в поверхневому шарі.
Адсорбцію в мономолекулярному можна також описати емпіричним рівнянням адсорбції Фрейндліха
A = KFс1/n , або A = KFр1/n ( 2.0)
В лінійній формі рівняння Фрейндліха має вигляд:
ln A = ln KF +1/n∙lnс ( 2.0)
В координатах ln А = f(ln с) рівняння Фрейндліха є рівнянням прямої лінії, яка відтинає на осі ординат відрізок рівний ln KF з тангенсом кута нахилу 1/n.
Адсорбція на однорідній поверхні в полімолекулярному шарі описується рівнянням ізотерми адсорбції БЕТ.
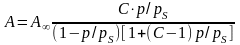 (
2.0)
(
2.0)
Лінійна форма рівняння БЕТ
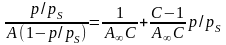 (
2.0)
(
2.0)
дозволяє графічним методом визначити його константи А∞ і С.
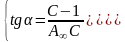 …………………(
2.0)
…………………(
2.0)
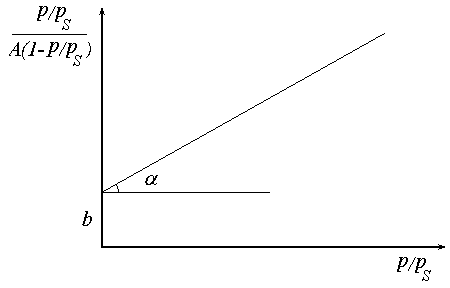
Рис. 3. Ізотерма адсорбції БЕТ в лінійних координатах.
