
- •Поверхневі явища та дисперсні системи збірник задач та конторольних питань
- •051301«Хімічна технологія», 051401«Біотехнологія»,
- •051701«Харчова інженерія», 120201«Фармація»
- •Поверхневі явища та їх класифікація. Вплив дисперсності на властивості тіл
- •Програма теоретичного курсу
- •Поверхневі явища та їх класифікація
- •Методи визначення поверхневого натягу
- •Внутрішня енергія поверхні. Залежність поверхневого натягу від температури
- •Адгезія, когезія, змочування і розтікання
- •Вплив дисперсності на властивості тіл
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування1
- •Адсорбційні рівноваги
- •Програма теоретичного курсу
- •Адсорбція газів на однорідній твердій поверхні
- •Адсорбція на пористій поверхні
- •Адсорбція на межі тверде тіло – рідкий розчин
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Електричні явища на поверхні
- •Програма теоретичного курсу
- •Теорії будови подвійного електричного шару
- •Електрокінетичні явища
- •Будова міцел ліофобних золів
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантна задача
- •Агрегативна стійкість та руйнування дисперсних систем. Молекулярно – кінетичні та оптичні властивості дисперсних систем
- •Програма теоретичного курсу
- •Теорія стійкості дисперсних систем длфо
- •Кінетика коагуляції
- •Молекулярно – кінетичні властивості дисперсних систем
- •Седиментація та седиментаційна стійкість
- •Оптичні властивості дисперсних систем
- •Контрольні питання
- •Приклади розв’язування задач
- •4.5 Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Список літератури
- •Навчальне видання поверхневі явища та дисперсні системи збірник задач та конторольних питань
Внутрішня енергія поверхні. Залежність поверхневого натягу від температури
Для процесів що відбуваються на поверхні внутрішня енергія одиниці поверхні Us дорівнює:
Us = + TSs = + qs ( 1.0),
де qs – теплота утворення одиниці поверхні.
З врахуванням Ss = -(∂Gs/∂T)p = -(∂/∂T)p можна записати рівняння Гіббса - Гельмгольца для поверхневого шару:
Us = -T(∂/∂T)p ( 1.0)
де (∂/∂T) = a – температурний коефіцієнт поверхневого натягу.
Рівняння температурної залежності поверхневого натягу має вигляд:
= o + a(T – To) ( 1.0)
Адгезія, когезія, змочування і розтікання
Взаємодію між поверхнями конденсованих тіл різної природи називають адгезією або прилипанням. Адгезійні взаємодії виникають при контакті двох конденсованих тіл, якщо відстань між ними співмірна з міжмолекулярною.
Притягання молекул і атомів всередині окремої фази називають когезією або злипанням. Це явище обумовлене міжмолекулярними силами притягання.

Рис. 1. Взаємодія між тілами різної природи.
Для системи, що складається з двох конденсованих тіл 2 і 3, що знаходяться у газовій фазі 1, з поверхневими натягами 2,1 i 3,1 , роботу адгезії Wa можна вирахувати за рівнянням Дюпре:
Wa = -G = Gпоч-Gкін=3,1+2,1-3,2 ( 1.0),
а роботу когезії WK – за рівнянням:
WK=2 ( 1.0),
де 3,2 – поверхневий натяг міжфазної поверхні.
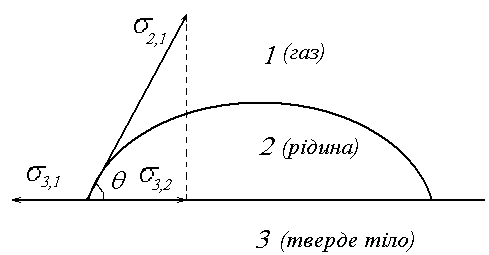
Рис. 2. Сили, що діють на краплю на поверхні.
Змочування – це поверхневе явище, яке полягає у взаємодії рідини з іншою конденсованою фазою, при умові одночасного контакту трьох фаз, одна з яких - газ (повітря).
Мірою змочування є крайовий кут змочування, це кут між площиною поверхні, що змочується і дотичною до поверхні рідини в одній із точок контуру змочування.
Для краплини (2) рис.2, яка в умовах рівноваги знаходиться на поверхні (3) в оточенні газової фази (1) крайовий кут змочування визначається за рівнянням Юнга:
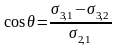 (
1.0).
(
1.0).
Параметри змочування часто зручно визначати з об’єднаного рівняння Дюпре- Юнга:
 (
1.0).
(
1.0).
Здатність рідин до розтікання характеризується різницею між роботою адгезії і когезії (коефіцієнт розтікання за Гаркінсом f) .
f =Wa-Wk=3,1-2,1-2 ( 1.0)
Якщо f >0, то рідина розтікається по поверхні. Якщо f <0, то рідина знаходиться на поверхні у формі краплин.
Поверхневий натяг на межі рідина-рідина двох взаємонасичених рідин 2,1нас дорівнює різниці поверхневих натягів їх насичених розчинів на межі з повітрям (правило Антонова).
2,1нас-3,1нас=3,2нас ( 1.0)
Вплив дисперсності на властивості тіл
Міжфазна поверхня характеризується питомою поверхнею, яка дорівнює відношенню площі міжфазної поверхні до одиниці об’єму для рідин, або одиниці маси дисперсної фази для порошків.
Sпит=Sпов/V [м2/м3=1/м], Sпит=Sпов/m [м2/кг]
Питома поверхня частинок правильної форми:
Sпит.сфер.=d2/(d3/6)=6/d
Sпит.куба=6l2/l3=6/l
З появою кривизни поверхні виникає додатковий внутрішній тиск Δр, який для сферичної поверхні дорівнює:
pсфер=2/r ( 1.0),
а для циліндричної поверхні:
pцил=/r ( 1.0)
Реакційна здатність G при T=const для частинок сферичної форми:
G=±2V/r ( 1.0),
плюс або мінус в рівнянні відповідають додатній, або від’ємній кривизні поверхні.
Тиск насиченої пари над викривленою поверхнею розраховується за рівнянням Кельвіна (Томсона):
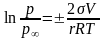 (
1.0),
(
1.0),
де - р - тиск пари над дисперсною фазою, - р∞ - тиск пари над рівною поверхнею
Рівняння Кельвіна (Томсона) для розчинності дрібних частинок має вигляд:
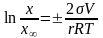 (
1.0),
(
1.0),
де - x - розчинність частинок дисперсної фази, фази а x∞ - розчинність крупної фази; відношення x/x∞=γ називають ступенем пересичення.
