
- •Поверхневі явища та дисперсні системи збірник задач та конторольних питань
- •051301«Хімічна технологія», 051401«Біотехнологія»,
- •051701«Харчова інженерія», 120201«Фармація»
- •Поверхневі явища та їх класифікація. Вплив дисперсності на властивості тіл
- •Програма теоретичного курсу
- •Поверхневі явища та їх класифікація
- •Методи визначення поверхневого натягу
- •Внутрішня енергія поверхні. Залежність поверхневого натягу від температури
- •Адгезія, когезія, змочування і розтікання
- •Вплив дисперсності на властивості тіл
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування1
- •Адсорбційні рівноваги
- •Програма теоретичного курсу
- •Адсорбція газів на однорідній твердій поверхні
- •Адсорбція на пористій поверхні
- •Адсорбція на межі тверде тіло – рідкий розчин
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Електричні явища на поверхні
- •Програма теоретичного курсу
- •Теорії будови подвійного електричного шару
- •Електрокінетичні явища
- •Будова міцел ліофобних золів
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантна задача
- •Агрегативна стійкість та руйнування дисперсних систем. Молекулярно – кінетичні та оптичні властивості дисперсних систем
- •Програма теоретичного курсу
- •Теорія стійкості дисперсних систем длфо
- •Кінетика коагуляції
- •Молекулярно – кінетичні властивості дисперсних систем
- •Седиментація та седиментаційна стійкість
- •Оптичні властивості дисперсних систем
- •Контрольні питання
- •Приклади розв’язування задач
- •4.5 Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Список літератури
- •Навчальне видання поверхневі явища та дисперсні системи збірник задач та конторольних питань
Приклади розв’язування задач
Приклад 4.1.
У три колби налито по 100 см3 золю Fe(OH)3. Щоб викликати коагуляцію золю, потрібно додати: в першу колбу 10,5см3 розчину KCl концентрацією С(KCl)=1М; у другу колбу – 62,5см3 розчину Na2SO4; концентрацією С(½Na2SO4)=0,01М; у третю колбу – 37,0 см3 розчину Na3PO4 концентрацією С(1/3Na3PO4)=0,001М. Обчисліть пороги коагуляції і визначте знак заряду частинок золю.
Визначаємо, скільки молів KCl міститься в 10,5см3 розчину KCl концентрацією С(KCl)=1М:
 моль
моль
Визначаємо загальний об’єм розчину (золь і розчин електроліту):
 дм3.
дм3.
Обчислюємо поріг коагуляції електроліту KCl
 моль/
дм3
моль/
дм3
Подібним чином розраховуємо пороги коагуляції для Na2SO4 і Na3PO4
 моль
моль
 моль/ дм3
моль/ дм3
 моль
моль
 моль/ дм3
моль/ дм3
Електроліти KCl, Na2SO4 і Na3PO4 містять катіони з однаковим зарядом, а заряд їх аніонів різний. Чим більший заряд аніона, тим поріг коагуляції стає меншим. Найменший поріг коагуляції і, відповідно, найбільша коагулюючи здатність у іонів . На основі отриманих результатів можна зробити висновок, що частинки золю Fe(OH)3 заряджені позитивно.
Приклад 4.2.
На коагуляцію золю йодиду срібла з 1,0·10-2 м3 стічних вод витратили 8,0·10-4 м3 10%-го розчину NaCl (густина 1,07·103 кг/м3). Розрахуйте розхід 28%-го розчину Al2(SO4)3 (густина 1,30·103 кг/м3) для вилучення AgI з 100 м3 стічних вод, якщо електричний заряд колоїдних частинок йодиду срібла в цих водах: а) додатній; б) від’ємний.
Кількість молів n NaCl в 8,0·10-4 м3 10%-го розчину NaCl: n1=v1·ρ1·g1 (100·М1) = 8,0·10-4·1,07·10-3·10/(100·0,0586) = 1,46 моль, де: v1; ρ1; g1 – відповідно об’єм (м3), густина (кг/м3) та концентрація, (%) розчину NaCl; М1 – молярна маса NaCl (кг/моль). Звідси поріг коагуляції стічних вод
 ммоль/м3
ммоль/м3
де: V – об’єм зразка колоїдної системи; Vе – об’єм розчину електроліту коагулятора.
Якщо електричний заряд колоїдних частинок додатній, то іонами-коагуляторами в Al2(SO4)3 будуть іони (z=2). Поріг коагуляції розглянутого гідрозолю за іонами
 моль/м3
моль/м3
Отже, для коагуляції 100 м3 стічних вод знадобиться іонів
n2 = 2,12 · 100 = 212 моль
Маса
 ,
що містить таку кількість іонів
,
що містить таку кількість іонів
 кг
кг
де: М2 – молярна маса Al2(SO4)3 (кг/моль); n2 – кількість молів Al2(SO4)3; 3 – число іонів в молекулі Al2(SO4)3.
Об’єм, що містить таку масу солі:
 м3
м3
де ρ1 і g1 –густина (кг/м3) та концентрація, (%) розчину Al2(SO4)3.
При від’ємному заряді колоїдних частинок, іонами коагуляторами в Al2(SO4)3 стануть (z=3). Поріг коагуляції гідрозолю, що розкладається на іони
 моль/м3
моль/м3
До коагуляції стічних вод у цьому випадку знадобиться іонів n2 =0,186 · 100 = 16,6 моль. Маса , що містить таку кількість іонів
 кг
кг
де: 2 – число іонів в молекулі Al2(SO4)3.
Об’єм, що містить таку масу солі:
 м3
м3
Приклад 4.3.
Експериментально отримана залежність загальної кількості n∑ частинок гідрозолю золота в 1 м3 від часу коагуляції τ, викликаної електролітом KCl. В’язкість середовища η=1,8·10-3 Па·с, температура Т=293 К.
τ, с |
0 |
125 |
250 |
375 |
425 |
n∑ ∙ 10-14, част/м-3 |
20,2 |
8,08 |
5,05 |
3,67 |
3,31 |
Перевірте застосовність теорії Смолуховського для опису кінетики коагуляції даного золю.
Обчисліть час половинної коагуляції з експериментальними даними.
Розрахуйте константу швидкості коагуляції за експериментальними даними й порівняйте її з розрахованою теоретично, зробіть висновки.
Розрахуйте й побудуйте криві зміни числа первинних, подвійних і потрійних частинок з часом.
Використовуємо
прямолінійнійну форму залежності
загальної кількості частинок від часу
:
 .
.
Обчислюємо значення n0/n∑ при різному часі коагуляції:
τ, с |
0 |
125 |
250 |
375 |
425 |
n0/n∑ |
1 |
2,5 |
4,0 |
5,5 |
6,1 |
Будуємо графік залежності n0/n∑ = f(τ).
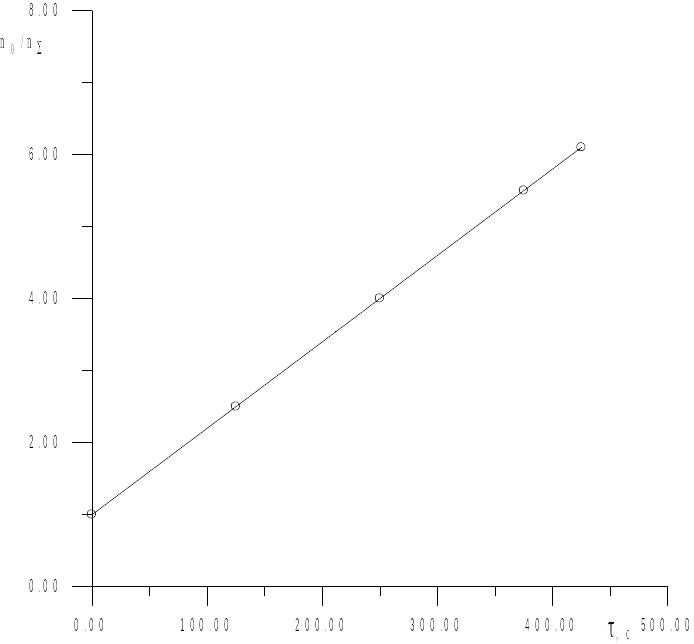
Рис. 15. Залежність загальної кількості частинок від часу.
Як видно з графіка, експериментальні дані відповідають лінійній залежності, що вказує на застосовність рівняння Смолуховського.
Із графіка
знаходимо
 с.
с.
Експериментальна та теоретично розрахована константи швидкості коагуляції рівні:
 м3/с;
м3/с;
 м3/с
м3/с
Величини констант швидкі коагуляції є близькі, таким чином коагуляція гідрозолю золота є швидкою.
Кінетична зміна
загального числа частинок в теорії
Смолуховського описується рівнянням:
 .
.
Для розрахунку кількості подвійних і потрійних частинок використовуємо рівняння:

Та будуємо графік залежності кількості частинок від часу n = f(τ).
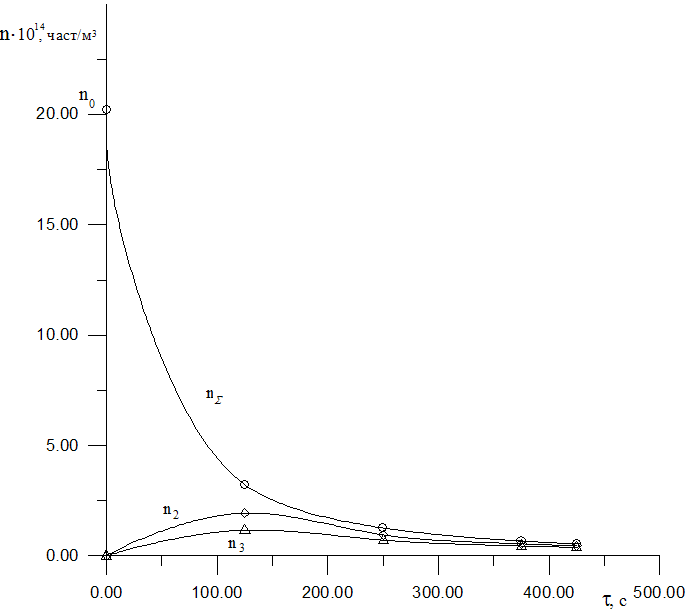
Рис. 16. Залежність кількості частинок від часу.
Приклад 4.4.
Розрахуйте і побудуйте потенціальну криву взаємодії частинок у водному розчині NaCl, якщо потенціал φδ = 20 мВ, константа Гамакера А=0,4·1019 Дж, параметр χ = 1·108 м-1 і температура 293 К. Значення сумарної енергії взаємодії частинок визначте при відстанях між їх поверхнями (h): 4; 8; 12; 18; 24; 32 нм.
Значення сумарної енергії взаємодії частинок розраховують додаванням енергії електростатичного відштовхування Ue і енергії молекулярного притягання UМ:
Для малих значень потенціалу поверхні (φδ ≤ 25мВ) енергія відштовхування частинок дорівнює:
Відносна діелектрична проникність води ε, = 81; електрична стала ε0=8,854·10-12 Ф/м. Енергія відштовхування частинок при відстані між її поверхнями h = 4нм дорівнює :
 =
3,85·10-5
Дж
=
3,85·10-5
Дж
Енергія UМ змінюється обернено пропорційно квадрату відстані між частинками. На відстані 4 нм ця енергія буде рівна:
 Дж
Дж
Відповідно, сумарна енергія взаємодії частинок на відстані 4 нм буде рівна:
 Дж
Дж
Аналогічно розраховуємо енергію взаємодії частинок при інших відстанях, отримані дані заносимо в таблицю:
h, нм |
|
|
|
4 |
3,85 |
-6,63 |
-2,78 |
8 |
2,58 |
-1,66 |
0,92 |
12 |
1,73 |
-0,74 |
0,99 |
18 |
0,95 |
-0,33 |
0,62 |
24 |
0,52 |
-0,18 |
0,34 |
32 |
0,23 |
-0,10 |
0,13 |
За
даними розрахунків будуємо графік
залежностей =f(h).
=f(h).
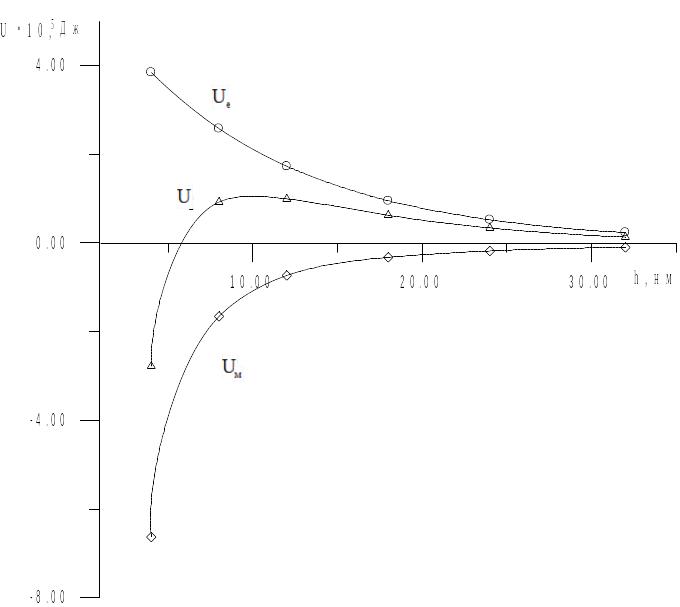
Рис. 17. Залежність енергії взаємодії частинок від відстані.
Приклад 4.5
Порівняти інтенсивності світлорозсіювання емульсій бензолу у воді (показник заломлення n1 = 1,50) і н-пентану у воді (n2 = 1,36) при 293 К. Показник заломлення води n3 = 1,33. Розмір частинок і концентрації емульсій однакові.
Відношення інтенсивностей світлорозсіювання розраховуємо за рівнянням:

Емульсія бензолу розсіює світло в 30,8 рази інтенсивніше, ніж емульсія н-пентану.

 Дж
Дж Дж
Дж Дж
Дж