
- •Поверхневі явища та дисперсні системи збірник задач та конторольних питань
- •051301«Хімічна технологія», 051401«Біотехнологія»,
- •051701«Харчова інженерія», 120201«Фармація»
- •Поверхневі явища та їх класифікація. Вплив дисперсності на властивості тіл
- •Програма теоретичного курсу
- •Поверхневі явища та їх класифікація
- •Методи визначення поверхневого натягу
- •Внутрішня енергія поверхні. Залежність поверхневого натягу від температури
- •Адгезія, когезія, змочування і розтікання
- •Вплив дисперсності на властивості тіл
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування1
- •Адсорбційні рівноваги
- •Програма теоретичного курсу
- •Адсорбція газів на однорідній твердій поверхні
- •Адсорбція на пористій поверхні
- •Адсорбція на межі тверде тіло – рідкий розчин
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Електричні явища на поверхні
- •Програма теоретичного курсу
- •Теорії будови подвійного електричного шару
- •Електрокінетичні явища
- •Будова міцел ліофобних золів
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантна задача
- •Агрегативна стійкість та руйнування дисперсних систем. Молекулярно – кінетичні та оптичні властивості дисперсних систем
- •Програма теоретичного курсу
- •Теорія стійкості дисперсних систем длфо
- •Кінетика коагуляції
- •Молекулярно – кінетичні властивості дисперсних систем
- •Седиментація та седиментаційна стійкість
- •Оптичні властивості дисперсних систем
- •Контрольні питання
- •Приклади розв’язування задач
- •4.5 Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Список літератури
- •Навчальне видання поверхневі явища та дисперсні системи збірник задач та конторольних питань
Молекулярно – кінетичні властивості дисперсних систем
Зв’язок між рухом частинок та їх молекулярно кінетичними властивостями визначені Ейнштейном та Смолуховським середньоквадратичним зміщенням частинки Δ у вибраному напрямку за час t за рівнянням:
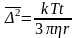 (4.16).
(4.16).
У неоднорідній у вихідному стані системі відбувається самочинний процес переносу речовини, зумовлений вирівнюванням її концентрації, який називається дифузією. Дифузія відбувається внаслідок теплового руху молекул а також більш крупних частинок дисперсної фази в колоїдних системах.
Коефіцієнт дифузії можна визначити за рівнянням Ейнштейна:
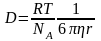 (4.17).
(4.17).
Седиментація та седиментаційна стійкість
Явище направленого руху частинок дисперсної фази під дією сили тяжіння або відцентрової сили називають седиментацією. Здатність дисперсної системи зберігати постійним розподіл частинок в об’ємі називають седиментаційною або кінетичною стійкістю.
Радіус частинок r, що осідають у гравітаційному полі можна розрахувати за швидкістю осідання u, та відомими значеннями в’язкості η і густини середовища 0 та дисперсної фази
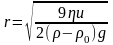 (4.18),
(4.18),
А у відцентровому полі - за рівнянням:
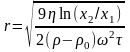 (4.19),
(4.19),
Де x - відстань частинки від осі обертання; – кутова швидкість; τ –час
Оптичні властивості дисперсних систем
Опалесценція – це розсіювання світла в результаті дифракції. Це явище, характерне тільки для колоїдних систем - воно спостерігається тоді, коли розмір частинок дисперсної фази менший за довжину світлової хвилі.
Загальну інтенсивність розсіяного світла IP сферичною частинкою, що не проводить електричний струм, в розбавленій колоїдній системі визначає рівняння Релея:
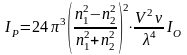 (4.20);
(4.20);
де Iо - інтенсивність світла, що падає; n1, n2 - показники заломлення дисперсної фази та дисперсійного середовища; - кількість частинок в одиниці об’єму; v - об’єм частинки; - довжина світлової хвилі.
Радіус r сферичної частинки, що спостерігається в ультрамікроскопі можна визначити за формулою:
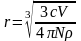 (4.21),
(4.21),
де с – концентрація диспергованої речовини, v - об’єм золю, N – число частинок в об’ємі v, – густина дисперсної фази.
Контрольні питання
У чому полягає відмінність між термодинамічною і агрегативною стійкістю колоїдних систем?
Які колоїдні системи щодо їх стійкості називаються ліофільними, а які ліофобними?
Наведіть і охарактеризуйте всі термодинамічні й кінетичні фактори агрегативної стійкості. Вкажіть методи їх нейтралізації.
Охарактеризуйте процеси руйнування колоїдних систем які вам відомі. Які з них можливі в системах з твердим, а які з легкорухомим дисперсійним середовищем? За рахунок яких параметрів і якою мірою зменшується поверхнева енергія в кожному з процесів?
З яких стадій складається процес ізотермічної перегонки? До якого типу процесів належить кожна стадія?
Від яких параметрів і як залежить перенос речовини в ізотермічній перегонці?
Які процеси в колоїдних системах називають коагуляцією, флокуляцією, агрегацією, пептизацією?
Яка коагуляція в теорії кінетики коагуляцій Смолуховського називається швидкою, а яка повільною?
Які зіткнення в теорії коагуляції називаються ефективними?
Покажіть, як можна за загальним числом частинок дисперсної фази перевірити, чи підпорядковуються отримані дані теорії швидкої коагуляції; обчислити константу швидкості коагуляції і час половинної коагуляції?
Поясніть аналітичну і графічну залежність зміни кількості частинок кратності 1, 2, 3 та загальної кількості частинок на підставі теорії швидкої коагуляції.
Які параметри дисперсної системи і як впливають на швидкість коагуляції частинок відповідно до теорії Смолуховського? Чим відрізняються константи швидкості швидкої і повільної коагуляції?
Як перейти від константи швидкої до константи повільної коагуляції згідно з теорією Фукса?
Що таке розклинюючий тиск і які причини його виникнення? Назвіть і охарактеризуйте його складові.
Сформулюйте правила коагуляції: Шульце-Гарді, Ейлерса – Корфа та ін.
Які потенціал і концентрацію при коагуляції називають критичними? В чому суттєва відмінність між цими параметрами?
Яка коагуляція називається концентраційною, а яка нейтралізаційною?
Що називається порогом швидкої коагуляції? Наведіть вираз і покажіть відмінності для частинок з великим і малим потенціалами.
Які складові розклинюючого тиску розглядає теорія стійкості ДЛФО?
Наведіть приклади потенціальних кривих взаємодії між частинками для дисперсних систем , що відповідають: агрегативній стійкості; коагуляції; порогу швидкої коагуляції; швидкій коагуляції. Які особливості коагуляції частинок, що відповідають першому й другому енергетичному мінімуму згідно з теорією ДЛФО?
Встановлено, що знак електричних зарядів глобул натурального латексу від’ємний. Яким електролітом найвигідніше відділяти каучук від серіуму: CH3COONa; Na2SO4; Zn(CH3COO)2; ZnSO4; Al(CH3COO)3; Al2(SO3)2. Біля якого електрода буде концентруватися каучук, якщо латекс помістити в сильне електричне поле?
В поверхневих водах району Чорнобиля містяться колоїдні радіоактивні частинки (ізотопи цезію і стронцію). При електрофорезі частинки рухаються до анода. Якому з електролітів Са(ОН)2 чи Na3PO4 слід надати перевагу при коагуляції і осадженні цих частинок?
Поясніть, чому для зупинки кровотечі організм виділяє в крові катіони Са+2, хоча їх вміст в біологічних рідинах малий порівняно з іонами Na+.
Для зменшення кислотності ґрунту застосовують Са(ОН)2 або добриво – аміачну воду NH4OH – також луг. Розглядаючи ґрунт як колоїдну систему з частинками гумусових речовин, вкажіть, який з наведених лугів понижує ξ – потенціал ґрунту на більшу величину і тим самим збільшує родючість. Назвіть іони коагулятори. (Гумусові речовини – високомолекулярні органічні речовини з карбоксильними групами.
Напишіть формулу золю золота, стабілізованого KAuO2. В якому з електролітів NaCl, BaCl2, FeCl3 поріг коагуляції матиме менше значення?
Напишіть формули міцел золів: Al(OH)3, стабілізованого AlCl3 і SiO2, стабілізованого H2SiO3. Для якого з наведених золів кращим коагулянтом буде розчин FeCl3 чи Na2SO4.
Пороги коагуляції електролітів для заданого золю, ммоль/л: С(KAlO2)=50,0; C(MgCl2)=0,717; C(AlCl3)=0,093; C(NaCl)=51,0; C(MgSO4)=0.810; C(Al(NO3)3)=0,095. Визначити знак заряду частинок золю.
При нагріванні озерної, або річкової води до 90-95оС відбувається інтенсивне утворення бурих пластівців. Поясніть це явище. Чому таке явище не спостерігається при нагріванні дистильованої води?
Для освітлення води в неї вводять: Al2(SO4)3 або FeSO4, після чого відбувається інтенсивне випадання осаду. Поясніть це явище, виходячи з того, що частинки, завислі в природній воді, мають від’ємні електричні заряди, а іонні солі, що вводяться при розчинені, гідролізуються.
Карбонати Ca2+, Cr2+, Ba2+ в момент утворення мають пухку структуру. При стоянні, особливо при нагріванні осади помітно ущільнюються, стають грубокристалічними – визрівають. Чим пояснити це явище?
Помічено, що вершкове масло збивається легше зі сметани, що постояла, ніж із свіжої. Поясніть це явище, враховуючи також і деяке прокисання сметани при стоянні.
Вершки й молоко здатні відстоюватися. Чому не відстоюється синтетичний латекс?
