
- •Поверхневі явища та дисперсні системи збірник задач та конторольних питань
- •051301«Хімічна технологія», 051401«Біотехнологія»,
- •051701«Харчова інженерія», 120201«Фармація»
- •Поверхневі явища та їх класифікація. Вплив дисперсності на властивості тіл
- •Програма теоретичного курсу
- •Поверхневі явища та їх класифікація
- •Методи визначення поверхневого натягу
- •Внутрішня енергія поверхні. Залежність поверхневого натягу від температури
- •Адгезія, когезія, змочування і розтікання
- •Вплив дисперсності на властивості тіл
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування1
- •Адсорбційні рівноваги
- •Програма теоретичного курсу
- •Адсорбція газів на однорідній твердій поверхні
- •Адсорбція на пористій поверхні
- •Адсорбція на межі тверде тіло – рідкий розчин
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Електричні явища на поверхні
- •Програма теоретичного курсу
- •Теорії будови подвійного електричного шару
- •Електрокінетичні явища
- •Будова міцел ліофобних золів
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантна задача
- •Агрегативна стійкість та руйнування дисперсних систем. Молекулярно – кінетичні та оптичні властивості дисперсних систем
- •Програма теоретичного курсу
- •Теорія стійкості дисперсних систем длфо
- •Кінетика коагуляції
- •Молекулярно – кінетичні властивості дисперсних систем
- •Седиментація та седиментаційна стійкість
- •Оптичні властивості дисперсних систем
- •Контрольні питання
- •Приклади розв’язування задач
- •4.5 Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Список літератури
- •Навчальне видання поверхневі явища та дисперсні системи збірник задач та конторольних питань
Агрегативна стійкість та руйнування дисперсних систем. Молекулярно – кінетичні та оптичні властивості дисперсних систем
Програма теоретичного курсу
Під агрегативною стійкістю дисперсної системи розуміють її здатність зберігати незмінною свою дисперсність в усьому об’ємі. Руйнування дисперсної системи може відбуватись за рахунок злипання частинок дисперсної фази (коагуляція), за рахунок їх злиття (коалесценція) або за рахунок перенесення дрібних частинок (розмір яких відповідає дії ефекту Кельвіна) до крупніших (ізотермічна перегонка).
Теорія стійкості дисперсних систем длфо
Сучасна фізична теорія стійкості колоїдних систем була запропонована Б.В. Дєрягіним і Л.Д.Ландау та Фервеєм і Овербеком і названа за першими літерами їх прізвищ – теорія ДЛФО. Енергію відштовхування приймають за додатну, а притягання - від’ємну. Сумарну енергію системи із двох частинок одержують додаванням енергії відштовхування і енергії притягання:
U = Ue + Uм ( 4.1)
Енергія відштовхування частинок з малим потенціалом поверхні (<25 мВ):
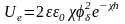 (4.2),
(4.2),
з великим потенціалом поверхні:
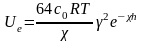 (4.3).
(4.3).
Енергія молекулярного притягання між частинками:
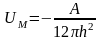 (4.4),
(4.4),
де h – відстань між частинками. cо – концентрація іонів в розчині; – коефіцієнт, що залежить від потенціалу поверхні, та заряду іонів; А – стала Гамакера; ε – відносна діелектрична проникність середовища.
Згідно теорії ДЛФО коагуляція, що відбувається в наслідок зменшення потенціалу частинок, називається нейтралізаційною, а внаслідок стискання дифузійного шару - концентраційною. При нейтралізаційній коагуляції критична концентрація електроліту залежить від потенціалу частинки і обернено пропорційна квадрату заряду іона
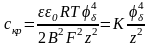 (4.5).
(4.5).
Критична концентрація концентраційної коагуляції обернено пропорційна заряду іона в шостому степені.
с1:с2:с3 = (1/1)6:(1/2)6:(1/3)6 = 1:(1/64):(1/726) (4.6).
Кінетика коагуляції
Зіткнення частинок, які приводять до їх злипання називають ефективними. Коагуляцію при якій всі зіткнення між частинками ефективні називають швидкою, якщо не всі зіткнення ефективні, то - повільною.
Загальну кількість частинок дисперсної фази в одиниці об’єму n в будь який момент часу можна розрахувати за рівнянням:
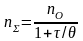 (4.7)
(4.7)
а кількість частинок будь якої кратності - за рівнянням:
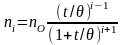 (4.8),
(4.8),
де: n0,– початкова кількість частинок; і – кратність частинок, і = 2; 3, 4…
В лінійній формі рівняння залежності загальної кількості частинок від часу має вигляд:
nо/n = t/ + 1 (4.9),
K - константа швидкості швидкої коагуляції визначається:
експериментально
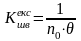 (4.10),
(4.10),
теоретично
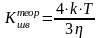 (4.11).
(4.11).
Час напівкоагуляції можна розрахувати з експериментальних даних за рівнянням:
= 1/(Кno) (4.12),
а також теоретично:
= 3 ∕ (4kTn0) (4.13).
При повільній коагуляції:
= 3 ∕ (4kTn0 α ) (4.14),
де - коефіцієнт злипання:
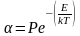 (4.15),
(4.15),
де P - стеричний фактор, що враховує розташування та форму частинок;
E - енергія відштовхування частинок.
