
- •Поверхневі явища та дисперсні системи збірник задач та конторольних питань
- •051301«Хімічна технологія», 051401«Біотехнологія»,
- •051701«Харчова інженерія», 120201«Фармація»
- •Поверхневі явища та їх класифікація. Вплив дисперсності на властивості тіл
- •Програма теоретичного курсу
- •Поверхневі явища та їх класифікація
- •Методи визначення поверхневого натягу
- •Внутрішня енергія поверхні. Залежність поверхневого натягу від температури
- •Адгезія, когезія, змочування і розтікання
- •Вплив дисперсності на властивості тіл
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування1
- •Адсорбційні рівноваги
- •Програма теоретичного курсу
- •Адсорбція газів на однорідній твердій поверхні
- •Адсорбція на пористій поверхні
- •Адсорбція на межі тверде тіло – рідкий розчин
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Електричні явища на поверхні
- •Програма теоретичного курсу
- •Теорії будови подвійного електричного шару
- •Електрокінетичні явища
- •Будова міцел ліофобних золів
- •Контрольні питання
- •Приклади розв’язування задач
- •Задачі для самостійного розв’язування
- •Багатоваріантна задача
- •Агрегативна стійкість та руйнування дисперсних систем. Молекулярно – кінетичні та оптичні властивості дисперсних систем
- •Програма теоретичного курсу
- •Теорія стійкості дисперсних систем длфо
- •Кінетика коагуляції
- •Молекулярно – кінетичні властивості дисперсних систем
- •Седиментація та седиментаційна стійкість
- •Оптичні властивості дисперсних систем
- •Контрольні питання
- •Приклади розв’язування задач
- •4.5 Задачі для самостійного розв’язування
- •Багатоваріантні задачі
- •Список літератури
- •Навчальне видання поверхневі явища та дисперсні системи збірник задач та конторольних питань
Електричні явища на поверхні
Програма теоретичного курсу
Теорії будови подвійного електричного шару
У поверхневому шарі фаз, що контактують, може відбувається перерозподіл електронів, іонів, або орієнтація полярних молекул, завдяки чому вони набувають зарядів, рівних за значенням і протилежних за знаком. В результаті цього утворюється подвійний електричний шар (ПЕШ) з відповідним зарядом, потенціалом і ємністю, який викликає зменшення поверхневого натягу.
Згідно з теорією будови ПЕШ Гуі-Чепмена залежніть електричного потенціалу від відстані x при малих значеннях потенціалу поверхні (o<25мВ), має вигляд:
x = oe-∙x (3.1),
де згідно теорії сильних електролітів Дебая – Гюккеля величина обернена до товщини іонної атмосфери:
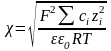 (3.2).
(3.2).
При великих значеннях потенціалу поверхні (o > 25 мВ):
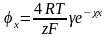 (3.3),
(3.3),
де
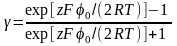 (3.4).
(3.4).
Товщина ПЕШ згідно з теорією Гуі-Чепмена:
 (3.5).
(3.5).
Ємність дифузійного шару визначається з рівнянняня:
С = ε ε0/ λ (3.6).
Електрокінетичні явища
При переміщені дисперсної фази відносно дисперсійного середовища відбувається розрив ПЕШ по межі ковзання розташованій в дифузійному шарі. Потенціал, що виникає на межі ковзання називається електрокінетичним, або - (дзета) потенціалом.
Явище переміщення рідини в пористих тілах під дією електричного поля називається електроосмосом, а переміщення частинок дисперсної фази в рідині – електрофорезом. Зворотне явище виникнення різниці потенціалів при русі рідини в пористих тілах під дією тиску називається потенціалом течії, а - при русі (седиментації) частинок в рідині називається потенціалом седиментації.
Лінійна швидкість руху рідини відносно твердої фази vo при електроосмосі і електрофорезі вираховується за формулою:
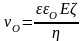 (3.7);
E = U/l
(3.8),
(3.7);
E = U/l
(3.8),
де l – відстань між електродами;
E – напруженість електричного поля;
U – різниця потенціалів.
Для розрахунку електрокінетичного потенціалу в явищах електроосмосу і електрофорезу використовують рівняння Гельмгольца – Смолуховського:
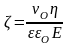 (3.8),
(3.8),
а також рівняння ζ = η v / ε ε0 I (3.9),
де v - об’ємна швидкість руху рідини відносно твердої фази v = v0S (3.10),
S – поперечний переріз капілярів в пористій мембрані.
Для розрахунку - потенціалу за значенням потенціалу течії U використовують рівняння:
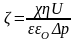 (3.11),
(3.11),
де– - питома електропровідність рідини; р – різниця тисків.
Будова міцел ліофобних золів
Розглянемо утворенню золю йодиду срібла за реакцією:
AgNO3 + KI = AgI↓ + KNO3
на поверхні мікрокристалів важкорозчинної солі AgI, що містять т молекул і називаються агрегатом, виникає ПЕШ. При надлишку КІ на поверхні агрегату адсорбується шар родинних потенціалвизначальних іонів йоду І-. Агрегат разом з потенціалвизначальними іонами називають ядром. Під дією електростатичних сил до ядра будуть притягуватися позитивні іони калію К+(протиіони), які компенсують заряд ядра. Частина протиіонів (п-х) міцно утримується біля ядра і утворює адсорбційний шар протиіонів. Ядро разом з протиіонами адсорбційного шару називається колоїдною частинкою, або гранулою. Решта протиіонів утворюють дифузійний шар. Агрегат разом з подвійним шаром іонів називається міцелою. Структуру міцели ліофобного золю можна показати схематично або записати формулою.
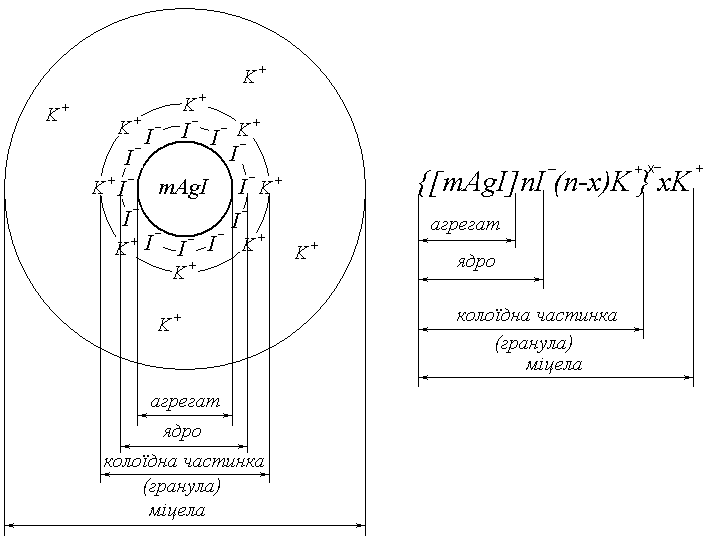
Рис. 11. Схема будови та формула міцели золю AgI в розведеному розчині KI.
