
- •Раздел 1. Метрология и стандартизация методов аналитического контроля
- •Тема 1.1. Метрология и стандартизация методов аналитического контроля
- •Раздел 2. Теоретические основы аналитической химии
- •Тема 2.1. Химическое равновесие и теория электролитической диссоциации
- •Способы выражения концентрации раствора
- •Практическое занятие №2. Способы выражения концентрации растворов
- •Контрольные задания
- •Тема 2.2. Окислительно-восстановительные реакции
- •Раздел 3. Химические методы анализа
- •Тема 3.1. Гравиметрический (весовой) анализ
- •Тема 3.2. Титриметрический (объемный) анализ
- •Раздел 4. Физико-химические методы анализа
- •Тема 4.1. Фотометрические методы анализа
- •Тема 4.2. Электрохимические методы анализа
- •Раздел 5. Физические методы анализа
- •Тема 5.1. Эмиссионый спектральный анализ
- •Тема 5.2. Рентгеноспектральный анализ
- •1 Рентгеновская трубка, 2 образец, 3,5 коллиматоры, 4 кристалл – анализатор, 6 детектор
Тема 3.2. Титриметрический (объемный) анализ
Лабораторная работа №9. Приготовление и стандартизация раствора перманганата калия
Цель: ознакомиться с методикой приготовления и стандартизации растворов перманганата калия, освоение приемов работы с мерной посудой, бюретками, принципов расчета и обработки результатов испытания.
Теория. Перманганат калия реагируете щавелевой кислотой по уравнению:
2КМnО4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + 10CO2 + K2SO4 + 8H2O
Mn7+ + 5e = Мп2+ │1│ окислитель
С3+ - е = С4+ │5│ восстановитель
Эта реакция протекает в кислотной среде, создаваемой добавлением серной кислоты; при этом степень окисления марганца изменяется от Мn7+ до Мn2+, за счет присоединения 5e.
В этом случае
 г/экв
г/экв
Для приготовления 0,1H раствора КМnО4следует растворить 3,161г. перманганата в 1 л. воды. Для стандартизации раствора перманганата используется 0,1H раствор щавелевой кислоты, приготовляемый растворением х.ч. (свежеперекристализированной) щавелевой кислоты в воде.
 г
г
Обычно готовится не более 250-500мл. 0,1Н раствора щавелевой кислоты, т.к. раствор не хранится.
Расчет производится по формулам:
 ,
г/мл
,
г/мл


 ,
г/мл
,
г/мл
Оборудование. Водяная баня, бюретки, пипетки, колбы конические, колбы мерные, химический стакан, аналитические весы.
Реактивы. Щавелевая кислота (х.ч.), перманганат калия (х.ч.), дистиллированная вода
Ход работы.
Приготовление 0,1Н раствора перманганата калия.
Для приготовления 0,1Н раствора взвешивают ~ 3,2г. перманганата (х.ч.), пересыпают навеску в химический стакан вместимостью 1л. и добавляют дистиллированную воду. Раствор нагревают до кипения и выдерживают на водяной бане при этой температуре в течение часа. Затем раствор фильтруют через фильтрующую воронку в колбу с притертой крышкой. После охлаждения можно устанавливать концентрацию и титр раствора.
Приготовление 0,1Н раствора щавелевой кислоты.
Для приготовления 250мл. 0,1Н раствора щавелевой кислоты требуется 0,25 · 0,1 · 63,04=1,576 г. х.ч. реактива. Взвешивание производится на аналитических весах в бюксе.
Результаты взвешивания:
масса бюкса m1,
масса бюкса навеской m2,
масса навески

Затем навеску пересыпают в мерную колбу емкостью 250мл. и растворяют в дистиллированной воде, доведенной до метки колбы. Рассчитывается титр и концентрация приготовленного установочного раствора:
Стандартизация раствора перманганата калия (титрование).
В коническую колбу при помощи пипетки переносится 25мл. приготовленного раствора щавелевой кислоты, добавляется 15мл. 2Н раствора H2SO4 и нагревается почти до кипения (но не кипятится). Горячий раствор титруется налитым в бюретку раствором перманганата при постоянном перемешивании содержимого колбы. Титрование ведется до появления бледно-розового окрашивания, не исчезающего в течений 1 мин.
Фиксируется объем раствора КМnО4, пошедший на титрование. Проделывается испытание 3-4 раза, определяется среднее значение объема раствора КМnО4.
Обработка результатов.
Результаты титрования:
1)
2)
3)
Среднее
По результатам титрования рассчитывается концентрация и титр рабочего раствора-раствора КМnО4.
Контрольные вопросы.
Сущность метода окислительно-востановительного титрования?
Преимущества перманганатометрии?
Как изменяется степень окисленности марганца в зависимости от реакции среды
Лабораторная работа № 10. Приготовление раствора заданной молярной концентрации
Работа выполняется на РМС «Стехиометрия» или УРМС.
Цель: приготовить раствор заданной молярной концентрации.
Теория. Молярная концентрация – количество вещества в 1 литре раствора. Для приготовления раствора заданной молярной концентрации берут навеску вещества, содержащую его определенное количество, количественно (т.е. без потерь) переносят в мерную колбу, растворяют в воде и доводят объем раствора до метки.
Оборудование. Весы, мерная колба определенного объема, химический стакан на 50 мл, фарфоровая ложечка.
Реактивы. K2CO3, или K2Cr2O7, или K3[Fe(CN)6]. Можно использовать другие реактивы, пригодные как первичные стандарты.
Ход работы. Получают реактив и мерную колбу. Уточняют у преподавателя необходимую концентрацию раствора. Рассчитывают необходимую навеску. Стакан для взвешивания ставят на весы и обнуляют тару. Ложечкой насыпают реактив в стакан для взвешивания до тех пор, пока масса реактива в стакане не превысит расчетную. После чего из стакана начинают ложечкой отбирать реактив. Если масса реактива по-прежнему превышает расчетную, отобранный реактив отбрасывают в емкость для слива, если оказывается ниже расчетной – из шпателя потихоньку насыпают реактив в стакан для взвешивания до тех пор, пока его масса не сравняется с расчетной. Не высыпать реактив обратно в банку!
Взятую навеску заливают в стакане дистиллированной водой, перемешивают круговым движением и переносят в мерную колбу. Так до тех пор, пока весь реактив не окажется в мерной колбе. После чего перемешивают круговыми движениями реактив в мерной колбе и, когда он полностью растворится, объем раствора доводят водой до метки. Затыкают мерную колбу пробкой и перемешивают ее содержимое, опрокидывая колбу не менее 15 раз.
Отчет. В отчете должна быть формулировка задачи с указанием конкретного вещества, объема и концентрации раствора, который предполагается приготовить. Также должны быть приведены формулы для расчета навески и указана навеска вещества.
Контрольные вопросы.
Что такое молярная концентрация раствора?
Почему нельзя пересыпать излишки реактива обратно в банку?
Перечислите способы выражения концентрации растворов.
Практическое занятие №7. Решение расчетных задач по результатам кислотно-основного титрования
Цель: ознакомиться с основными методами приготовления и стандартизации титрованных растворов для кислотно-основного титрования; научиться выполнять необходимые расчеты.
ОСНОВНЫЕ СВЕДЕНИЯ
При кислотно-основном титровании применяют титрованные (рабочие) растворы кислот (серной H2SO4, соляной НСl или азотной HNO3) и растворы щелочей(NaOH, КОН и Ba(OH)2). Приготовляют растворы с концентрацией 0,1н; 0,05н или 0,02н; 0,01-02м.
Титрованными являются растворы, титр которых точно известен. Титром называется количество вещества в граммах, содержащееся в 1 мл раствора.
При приготовлении растворов из химически чистых негигроскопичных и устойчивых при хранении на воздухе веществ, взвешивают на аналитических весах точную навеску рассчитанного количества вещества, переносят её в мерную колбу и доводят объём раствора дистиллированной водой до метки колбы. Титр и нормальную концентрацию полученного раствора рассчитывают по формулам:
Т =
 ,
г/мл; N
=
,
г/мл; N
= ,где
m-
навеска вещества, г;
V-
объем раствора,
мл; Э- эквивалент
вещества.
,где
m-
навеска вещества, г;
V-
объем раствора,
мл; Э- эквивалент
вещества.
Этот способ называется приготовлением титрованного раствора по точной навеске и применяется, в основном, для приготовления установочных растворов.
Поскольку кислоты и щелочи гигроскопичны, нестойки при хранении на воздухе и т.д., для приготовления титрованных растворов этих веществ используют другой способ, при котором точную концентрацию раствора устанавливают путём титрования раствора установочного вещества.
Готовится раствор кислоты или щелочи приблизительной концентрации, а затем им титрируется раствор установочного вещества. Титрование проводится способом пипетирования или способом отдельных навесок.
При способе пипетирования готовят раствор установочного вещества в мерной колбе (растворяют точную навеску в дистиллированной воде, доведенной до метки). Затем при помощи пипетки переносят определенный объём этого раствора в колбу для титрования и титруют раствором кислоты или щелочи из бюретки. Это проделывается не менее трёх раз. Концентрацию рабочего раствора кислоты или щелочи рассчитывают по формуле:
NР
=
 ,
где NР
–
нормальная
концентрация рабочего раствора кислоты
или щелочи; Ny-
нормальная
концентрация установочного раствора;
Vy-
объём установочного
раствора, отмеренный пипеткой, мл; Vp-
объём раствора
кислоты или щелочи, пошедший на титрование,
мл.
,
где NР
–
нормальная
концентрация рабочего раствора кислоты
или щелочи; Ny-
нормальная
концентрация установочного раствора;
Vy-
объём установочного
раствора, отмеренный пипеткой, мл; Vp-
объём раствора
кислоты или щелочи, пошедший на титрование,
мл.
Тр
=
 ,г/мл.,
где Эр-
эквивалент кислоты
или щелочи, г.
,г/мл.,
где Эр-
эквивалент кислоты
или щелочи, г.
При способе отдельных навесок точную навеску установочного вещества, взвешенную на аналитических весах, растворяют в колбе для титрования в произвольном количестве (объёме) дистиллированной воды. Полученный раствор установочного вещества титруют раствором кислоты или щелочи из бюретки. Это проделывается не менее трёх раз, для расчетов берётся среднее значение.
Концентрация рабочего раствора кислоты или щелочи рассчитывается по формуле:
Np
=
 ,
где my
- навеска
установочного вещества, г; Мэу-
масса эквивалента
установочного вещества, г; Vp-
объём рабочего
раствора кислоты щелочи, пошедший на
титрование, мл
,
где my
- навеска
установочного вещества, г; Мэу-
масса эквивалента
установочного вещества, г; Vp-
объём рабочего
раствора кислоты щелочи, пошедший на
титрование, мл
Tp = г/мл.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Рассчитать титр и нормальную концентрацию установочного раствора щавелевой кислоты H2С2O4•2H2O, если для приготовления 250 мл этого раствора было взвешенно 1,5530 г данного вещества. |
Решение. m=l,5530r; V=250 мл. Тy
=
N
=
Ny
=
|
По методу пипетирования
Пример 2. Рассчитать нормальную концентрацию в титр рабочего раствора NaOH, если на титрование 20 мл 0,1025н установочного раствора пошло2 2 мл раствора NaOH. |
Решение.
NNaOH
=
TNaOH
=
TNaOH
=
|
Пример 3. По способу отдельных навесок, в колбе было растворено 0,2028г Na2CO. На титрование этого раствора пошло 28 мл раствора соляной кислоты НСl. Определить нормальную концентрацию и титр раствора НСl. |
Решение.
|
ВАРИАНТЫ ЗАДАНИЙ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Вариант 1
Задача 1. При использовании метода пипетирования, было приготовлено 100мл установочного раствора растворением 0,3036г щавелевой кислоты H2C2O4·2H2O в воде. На титрование 20мл этого раствора пошло в среднем 21мл раствора КОН. Определить нормальную концентрацию и титр раствора КОН.
Вариант 2
Задача 1. При использовании способа отдельных навесок, в колбе было растворено 0,5080г Na2CO3. На титрование этого раствора пошло 52 мл раствора HNO3. Определить нормальную концентрацию и титр раствора HNO3.
Контрольные вопросы
Какие растворы называют стандартизованными (титрованными)?
Какие вещества называют стандартными (установочными), требования к ним?
Сущность способа пипетирования.
Сущность способа отдельных навесок.
Лабораторная работа №11. Определение константы кислотности слабой кислоты или константы основности слабого основания на основании зависимости рН от концентрации.
Работа выполняется на РМС «рН-метрия» или УРМС.
Цель: определить константу кислотности или основности.
Теория. В соответствии с теорией Бренстеда-Лоури кислота в водном растворе вступает в равновесие: HB + H2O ↔ H3O+ + B- (1)
Распределение концентраций частиц, находящихся в равновесной химической системе, описывается математической системой из трех уравнений. Первое уравнение (2) представляет собой выражение для константы кислотности или основности. Второе – уравнение материального баланса (3), которое связывает аналитическую концентрацию с равновесными. Третье – уравнение стехиометрии (4), которое связывает между собой равновесные концентрации на основании уравнения реакции (1).
(2)
(3)
(4)
Решая эту систему в общем случае, получаем
(5)
Для оснований аналогично:
(6)
Если электролит сильный, то есть продиссоциирован нацело, то концентрация [H3O+] или [OH-] вычисляется проще:
[H3O+] = C(HB) (7)
[OH-] = C(B) (8)
Если электролит слабый (точнее, концентрация электролита намного выше, чем его константа кислотности или основности), концентрацией продиссоциированной формы в уравнении материального баланса можно пренебречь. Тогда уравнение (3) упрощается до С(HB) = [HB] (9)
и концентрация [H3O+] и [OH-] вычисляется как
(10)
(11)
В соответствии с уравнениями (7), (8), (10) и (11), в растворах сильных электролитов зависимость концентрации ионов H3O+ (OH-) от концентрации электролита (кислоты или основания, соответственно) есть прямая линия, а в растворах слабых электролитов – подкоренная функция.
Если прологарифмировать уравнение (10) и поставить отрицательный знак перед обеими его частями, то получим: pH = pKa/2 + pC(HB)/2 (12)
где pKa = -lgKa, рС = -lgС. Следовательно, график зависимости рН от отрицательного логарифма концентрации кислоты представляет собой прямую с тангенсом угла наклона 1/2, отсекающую на оси ординат отрезок, равный pKa/2. Аналогично, из уравнений (11) и (ионного произведения воды ЛР№3) следует: pH = 14-pKb/2 - pC(B)/2 (13)
Следовательно, график зависимости рН от отрицательного логарифма концентрации основания представляет собой прямую с тангенсом угла наклона -1/2, отсекающую на оси ординат отрезок, равный 14-pKb/2.
Оборудование. Датчик рН, магнитная мешалка, компьютер с измерительным блоком, стакан на 100 мл, цилиндр мерный на 100 мл, бюретка, штатив химический.
Реактивы. HCl 0,1M; NaOH 0,1М; CH3COOH 0,1M; NH3 0,1M.
Подготовка к работе. Ополаскивают кончик датчика рН дистиллированной водой. Собирают установку (рис. 1). Подключают датчик к первому разъему измерительного блока. В меню программы L-Химия - практикум, выбирают сценарий «Титрование: Один параметр: рН: Ручной ввод шага». Переходят в окно измерений, нажимают экранную кнопку «Пуск».
Х од работы. В стакан наливают 100 мл дистиллированной воды, запускают процесс перемешивания.
Нажимают на экранную кнопку «Выбор», в окне ввода шага вводят «0,1».
Добавляют 0,1 мл HCl 0,1М.
Вновь нажимают на экранную кнопку «Выбор», вводя значение рН при данном объеме. Так до тех пор, пока не выйдет 1 мл HCl 0,1М.
После этого изменяют значение шага на 1,0 и добавляют по 1 мл электролита, каждый раз вводя значение рН в компьютер. Так до тех пор, пока не уйдет 10 мл раствора электролита. Останавливают измерение нажатием экранной кнопки «Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».
С NaOH, CH3COOH, NH3 поступают аналогично.
Обработка результатов. Для расчета константы диссоциации уксусной кислоты открывают файл с зависимостью рН от ее концентрации. В нем первый столбец – объем кислоты, второй – рН. Перед вторым столбцом вставляют новый столбец, в котором рассчитывают рС в каждой экспериментальной точке. Строят график зависимости рН от рС и приближают его прямой (разд. 2.2, с.14). Из отрезка, который прямая отсекает на оси абсцисс, вычисляют pKa. Аналогично поступают для расчета pKb аммиака.
О
Рис. Установка для рН-метрического титрования с помощью бюретки. 1 – штатив, 2 – муфты, 3 – лапки, 4 – бюретка, 5 – датчик рН, 6 – химический стакан,
7 – магнитная мешалка
тчет. В отчете привести три графика. На первом привести зависимости рН от концентрации кислот. На втором – рН от концентрации оснований. На третьем – [H3O+] от концентрации кислот и [OH-] от концентрации оснований. В выводе указать значения констант кислотности аммиака и уксусной кислоты.Контрольные вопросы.
Выражение для константы кислотности или основности.
Уравнение материального баланса, которое связывает аналитическую концентрацию с равновесными.
Уравнение стехиометрии, которое связывает между собой равновесные концентрации на основании уравнения реакции
Лабораторная работа №12. Определение концентрации кислоты методом рН-метрического титрования.
Работа выполняется на РМС «рН-метрия» или УРМС. Возможно также выполнение работы на РМС «Колориметрия».
Цель: определить концентрацию кислоты титриметрическим методом с детектированием конечной точки по скачку рН.
Теория. Если к раствору, содержащему кислоту по Аррениусу, добавлять сильное основание, то между ними будет происходить реакция нейтрализации: H+ + OH- = H2O.
В результате нейтрализации ионы H+ (H3O+) связываются и значение рН растет. Если и кислота и основание – сильные, то когда количество кислоты в пробе сравняется с количеством добавленного основания (в точке эквивалентности), значение рН станет равным 7. Когда основание окажется в избытке, значение рН превысит 7 и будет расти по мере дальнейшего добавления основания. При этом, поскольку зависимость рН от концентрации ионов H+ (и ОН-) логарифмическая, приближение к рН 7 и удаление от него будет очень резким. В районе точки эквивалентности (точки, где количество добавленной щелочи в точности равно количеству кислоты в пробе) происходит скачок рН, по которому и определяют наступление точки эквивалентности. Причем, если добавлять сильное основание к слабой кислоте, скачок рН также будет наблюдаться, однако рН в точке эквивалентности будет выше 7.
В точке эквивалентности C(H+)•V(H+) = C(OH-)•V(OH-) (1)
(С – молярная аналитическая концентрация, V — объем). В случае многоосновных кислот скачков будет несколько. Если константы кислотности кислоты по разным ступеням различаются хотя бы на 3 порядка и их рKа не превышают 11, число скачков равно основности кислоты. Если различие меньше, соответствующий скачок становится незаметен. Также почти незаметен скачок, соответствующий нейтрализации кислоты с рKа>11, если только не брать очень высоких концентраций кислоты или щелочи. Аналогично будет выглядеть кривая титрования смеси разных кислот. Если знать объем пробы кислоты, объем раствора щелочи, пошедший на их нейтрализацию, и концентрацию раствора щелочи, можно вычислить концентрацию кислоты. Если говорить точно, за точку эквивалентности принимают значение объема, при котором кривая титрования растет наиболее сильно.
На математическом языке это означает, что производная рН по объему V, которая обозначается как dpH/dV, максимальна. Теоретически, чтобы определить этот объем, нужно строить дифференциальную кривую рН-метрического титрования – зависимость dpH/dV от объема титранта. Однако на практике кривая титрования построена соединением конечного числа точек, поэтому взять производную абсолютно корректно невозможно. Производную берут приблизительно, как отношение разности значений рН вокруг данной точки к разности объемов вокруг нее (ΔpH/ΔV) и строят кривую зависимости этого параметра от объема добавленного реагента.
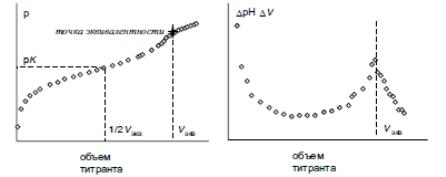
Рис. Кривая рН-метрического титрования слабой одноосновной кислоты щелочью. Справа – дифференциальная кривая. Vэкв – объем в точке эквивалентности
Оборудование. Датчик рН, компьютер с измерительным блоком, магнитная мешалка, мерная пипетка на 10 мл, стакан на 50 мл, бюретка, штатив химический.
Реактивы. Раствор кислоты с концентрацией 0,01–0,2 М (готовит преподаватель), раствор NaOH 0,1М.
Подготовка к работе. Собирают установку для рН-метрического титрования (рис.). В меню программы L-Химия – практикум выбирают сценарий «Титрование: Один параметр: рН: ручной ввод шага». Переходят в окно измерений.
Ход работы. Перед использованием электрод ополаскивают дистиллированной водой. В стакан на 50 мл отбирают пипеткой 10 мл пробы, добавляют дистиллированной воды до 40-50 мл, запускают процесс перемешивания. Запускают измерения, нажав на экранную кнопку «Пуск». Нажимают на экранную кнопку «Выбор», в окне ввода шага вводят «0,5» (можно работать и с другим шагом или даже менять его в ходе работы). Добавляют 0,5 мл NaOH 0,1М. Вновь нажимают на экранную кнопку «Выбор» и нажатием на клавишу «Enter» вводят значение рН при данном объеме. И так до тех пор, пока значение рН не превысит 11. Останавливают измерение нажатием экранной кнопки «Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».
Проведенное первое титрование является прикидочным. После него проводят точное титрование. При точном титровании кривую титрования не обязательно прописывать с самого начала. Достаточно точно прописать ее вокруг точки эквивалентности, примерно определенной в прикидочном титровании. Для этого сразу добавляют в пробу объем титранта на 1-2 мл меньший, чем объем в точке эквивалентности, после чего проводят титрование с шагом 0,1-0,2 мл. Когда будет пройдена точка эквивалентности, добавляют еще 1-2 мл титранта, после чего титрование прекращают.
Точное титрование проводят до трех сходящихся результатов, т.е. пока три результата подряд не будут отличаться друг от друга менее, чем на 0,1 мл. Результаты каждый раз сохраняют.
Если скачок на кривой титрования выражен слабо, можно построить дифференциальную кривую рН-метрического титрования – зависимость ΔрН/ΔV от объема титранта. Для этого для каждой точки вычисляют разность рН между текущей точкой и предыдущей, а также между следующей точкой и текущей. Полученные значения усредняют, получая таким образом ΔрН вокруг текущей точки. Аналогично поступают со значениями объема титранта, получая ΔV. Объем титранта, при котором ΔрН/ΔV максимально, принимают за точку эквивалентности.
Обработка результатов. По окончании измерения переходят в программу «Excel» и открывают в ней полученные файлы. Первый столбец в них – объем NaOH, второй - pH при этом. Строят график зависимости pH от добавленного объема щелочи. Объем, при котором происходит скачок рН, соответствует точке эквивалентности. Его определяют графически (построив на графике частую сетку по оси абсцисс). Из этого объема рассчитывают концентрацию кислоты по уравнению (1).
Отчет. В отчете привести кривые титрования, указать объемы в точке эквивалентности. В выводе привести концентрацию кислоты с доверительным интервалом.
Контрольные вопросы.
Что такое кривая рН-метрического титрования?
Как влияет объем добавленной дистиллированной воды на объем в точке эквивалентности?
Почему для определения концентрации кислоты не нужно прописывать кривую титрования целиком?
Как увеличение шага титрования отразится на точности и трудоемкости эксперимента?
Лабораторная работа №13. Подбор индикаторов для определения ионов металлов титрованием.
Работа выполняется на РМС «Ионометрия» или УРМС.
Цель: подобрать индикатор для определения меди или свинца методом комплексонометрического титрования.
Теория. Один из способов детектирования точки эквивалентности при комплексонометрическом титровании – по переходу окраски металлоиндикатора. Подбирается индикатор, обладающий следующими свойствами:
• он образует с металлом ярко окрашенный комплекс;
• окраска его комплекса с металлом заметно отличается от собственной окраски;
• он связывается с металлом достаточно сильно, но слабее, чем ЭДТА при данном рН.
Если к раствору соли металла добавить небольшое (гораздо меньшее, чем количество металла в пробе) количество индикатора, последний образует окрашенный комплекс с металлом. При титровании ЭДТА, последний сначала связывает свободный ион металла. Когда весь свободный ион металла связан, ЭДТА вытесняет индикатор из его комплекса, и индикатор изменяет окраску. Изменение окраски должно происходить достаточно резко, чтобы быть заметным глазу.
Для проверки пригодности индикатора следует получить кривую комплексонометрического титрования с контролем потенциала ИСЭ и с контролем оптической плотности. Если скачки на обоих кривых совпадают, значит, индикатор можно считать пригодным. Часто титрование проводят на фоне буферного раствора с определенным рН, чтобы оптимизировать различие в силе связывания индикатора и ЭДТА, а также различие в окраске индикатора и его комплекса с металлом.
Однако описанный выше метод нельзя применять для проверки пригодности индикатора в присутствии других лигандов, в том числе в сильнощелочных растворах.
Оборудование. Компьютер с измерительным блоком, приставка-переходник для подсоединения электродов, медь- или свинецселективный электрод (в зависимости от определяемой соли), электрод сравнения, датчик объема жидкого реагента, датчик оптической плотности в соответствии с таблицей 12, переходник-ветвитель, шприц на 10 мл, магнитная мешалка, штатив химический, штатив для электродов ШУ-98, кювета, пипетка мерная на 2 и 10 мл, колба мерная на 100 мл.
Реактивы. Раствор ЭДТА 0,05М; реактивы в соответствии с таблицей 1. Растворы солей металлов должны иметь концентрацию 0,02М.
Таблица 1. Индикаторы для проверки их пригодности в комплексонометрическом титровании и условия титрования
Металл |
Индикатор |
Буферный раствор |
Длина волны, нм |
Cu2+, Pb2+ |
Пиридилазорезорцин (ПАР) 0,1% водный р-р |
CH3COOH 1M + CH3COONa 1M |
525 |
Cu2+ |
ПАР 0,1% водный р-р |
Уротропин 1М |
525 |
Cu2+ |
Мурексид |
CH3COOH 1M + CH3COONa 1M |
525 |
Cu2+ |
Глицинтимоловый синий 0,1% водный р-р |
Уротропин 1М |
595 |
Cu2+, Pb2+ |
Ализарин-комплексон |
CH3COOH 1M + CH3COONa 1M |
525 |
Pb2+
|
Галлоцианин, 1% р-р в |
CH3COOH лед. CH3COOH 1М |
525 |
Pb2+ |
Дифенилкарбазон 0,2% сп. р-р |
CH3COOH 1M + CH3COONa 1M |
525 |
Pb2+, Pb2+ |
Ксиленоловый оранжевый 0,5% спиртовой р-р |
Уротропин 1М |
595 |
Подготовка к работе. Собирают установку для потенциометрического титрования с контролем оптической плотности (рис.). К разъему «ИЭ1» приставки-переходника подключают ионоселективный электрод, к разъему «ЭСр» – электрод сравнения. Приставку переходник подключают к первому разъему измерительного блока. Ко второму разъему подключают ветвитель. К синему разъему ветвителя (четный канал) подключают датчик оптической плотности, к желтому (нечетный канал) – датчик объема жидкого реагента. В меню программы L-Химия - практикум выбирают сценарий «Титрование: Два параметра: Потенциал электрода и оптическая плотность Автоматическое определение объема титранта». Выходят в окно запуска эксперимента.
Х од
работы.
Снаряжают
датчик объема жидкого реагента шприцом
на 10 мл с ЭДТА (убедиться, что толкатель
датчика упирается в поршень шприца, и
на кончике иглы выступила капля титранта).
од
работы.
Снаряжают
датчик объема жидкого реагента шприцом
на 10 мл с ЭДТА (убедиться, что толкатель
датчика упирается в поршень шприца, и
на кончике иглы выступила капля титранта).
В мерную колбу на 100 мл отбирают 10 мл раствора металла и 10 мл буферного раствора. Доводят дистиллированной водой до метки. Переливают содержимое колбы в кювету. Убеждаются, что в кювету погружены электроды. Нажимают экранную кнопку «Настройка оборудования» в настраивают датчик оптической плотности (см. с.39). Переходят в окно измерений.
Н
Рис. Установка для потенциометрического титрования с контролем оптической плотности. 1 – датчик
объема жидкого реагента, 2 – шприц, 3 – штатив ШУ-98, 4 – электрод сравнения, 5, 6 – измерительные электроды, 7 – датчик оптической плотности, 8 – кювета, 9 – магнитная мешалка
ажатием на экранную кнопку «Пуск» запускают процесс измерения и нажатием на экранную кнопку «Выбор» вводят значение потенциала ИСЭ и оптической плотности в исходном растворе. Вращая рукоятку датчика объема жидкого реагента, добавляют из шприца 0.2–0.5 мл титранта. Нажатием на экранную кнопку «Выбор» снова вводят в компьютер значение оптической плотности и потенциала ИСЭ. Ближе к 4 мл шаг уменьшают до 0.1 мл или даже меньше. И так до скачка потенциала. После того, как скачок потенциала пройдет, добавляют еще 1–2 мл титранта и прекращают титрование. Останавливают измерение нажатием экранной кнопки «Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».Обработка результатов. Открывают файл с результатами. В нем три столбца. В первом столбце находится объем титранта, во втором – значение потенциала ИСЭ, в третьем – значение оптической плотности. Строят графики зависимости потенциала и оптической плотности от объема титранта и смотрят, совпадают ли объемы, при которых произошел скачок потенциала и скачок или перелом оптической плотности.
Отчет. В отчете указать, какой металл и индикаторы использовались. Привести графики зависимости потенциала и оптической плотности от объема титранта. Сделать вывод о том, какие индикаторы подходят для комплексонометрического титрования металла.
Лабораторная работа №14. Определение концентрации металла методом комплексонометрического титрования по ИСЭ.
Работа выполняется на РМС «Ионометрия» или УРМС.
Цель: определить концентрацию Cu2+ или Pb2+ титрованием ЭДТА с ионометрическим детектированием точки эквивалентности.
Теория. Комплексная частица (комплекс) – частица, состоящая из других частиц, способных существовать, не образуя ковалентных связей.
Соединения, содержащие комплексные частицы, называются комплексными соединениями. Комплексные частицы, как правило, образуются за счет донорно-акцепторных связей. Например, ион Cu2+, имеющий свободные 4s и 4p орбитали (обозначены «»), образует донорно-акцепторную связь с молекулами аммиака, обладающими неподеленной электронной парой (обозначается «:»):
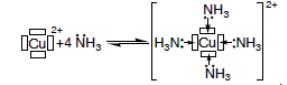
Образующаяся частица – ион тетраамминмеди [Cu(NH3)4]2+ – является комплексным катионом. Бывают комплексные нейтральные частицы: Cu2+ + 2Cl- = [CuCl2] и комплексные анионы: Cu2+ + 4Cl- = [CuCl4]2-.
Комплексные частицы состоят из ядра (акцептор электронов) и лигандов (доноры электронов). В ионе тераамминмеди ядро – это ион Cu2+, а лиганды – молекулы аммиака. Обычно химики имеют дело с моноядерными комплексами (одно ядро и несколько лигандов), хотя встречаются и полиядерные. Один лиганд может образовать несколько донорно-акцепторных связей с ядром. Число таких связей, которые может образовать один лиганд, называется его дентатностью. Например, этилендиамин H2N-CH2-CH2-NH2 – бидентатный лиганд.
Реакции соединения частиц, способных к самостоятельному существованию (в том числе комплексных), в новый комплекс, называется реакцией комплексообразования. Она обратима. Ее константа равновесия называется константой устойчивости комплекса. Общая константа устойчивости комплекса MLn (обозначается буквой β ) есть константа равновесия реакции (заряды опущены) M + nL ↔ MLn:
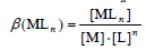
Кроме общих констант устойчивости, бывают еще ступенчатые:
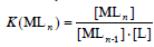
Чем больше константа устойчивости, тем прочнее комплекс.
Комплексные частицы могут вступать в реакцию лигандного обмена, то есть реакцию, в который одни лиганды в комплексе заменяются другими. Один центральный атом может также замещать другой. В грубом приближении можно сказать, что и те, и другие реакции идут от менее прочного комплекса к более прочному. Например, аммиак вытесняет хлорид-ионы из тетрахлоркупрата, поскольку образующийся ион тертраамминмеди устойчивее (прочнее), чем тетрахлоркупрат: [CuCl4]2- + 4NH3 ↔ [Cu(NH3)4]2+ + 4Cl-.
Более строго распределение комплексных частиц в растворе может быть рассчитано на основании констант устойчивости всех комплексов, которые образуются в растворе и концентрации свободных лигандов.
Примером вытеснения центрального иона может служить реакция тетрахлоркупрата с ионом Hg2+, с образованием нейтрального комплекса HgCl2, связи в котором имеют ярко выраженный ковалентный характер, из-за чего комплекс весьма прочен.
[CuCl4]2- + 2Hg2+ ↔ Cu2+ + 2HgCl2.
Реакции комплексообразования обычно осложняются кислотно-основными взаимодействиями. Например, аммиак способен реагировать не только с ионом меди, но и с ионами H+. Поэтому в кислой среде аммиачные комплексы разрушаются:
[Cu(NH3)4]2+ + 4H+ ↔ Cu2+ + 4NH4+.
Другие комплексы, лиганды которых представляют собой анионы слабых кислот, тоже разлагаются в кислой среде. Щелочная среда, наоборот, способствует образованию комплексов с анионами очень слабых кислот. Например, ион Cu2+ в сильнощелочной среде образует комплексы с диолами, которые даже не диссоциируют в воде:
Cu2+ + 2HO-(CH2)2-OH + 4OH- ↔ [Cu(O-(CH2)2-O)2]2- + 4H2O
В щелочной среде некоторые недостаточно прочные комплексы могут разрушаться за счет образования гидроксидов центральных ионов: [CuCl4]2- + 2OH- ↔ 2Cu(OH)2↓ + 4Cl-.
Область рH, при котором при котором комплексы существуют (в общем случае, она зависит от концентрации лигандов), может быть рассчитана на основе констант устойчивости комплексов, констант основности лигандов и произведения растворимости гидрокисдов.
Все эти особенности делают системы, в которых протекают процессы комплексообразования, весьма сложными, хотя и поддающимися расчету.
Один из мощнейших лигандов – этилендиаминтетраацетат-ион
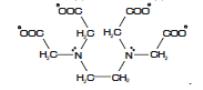
Будучи гексадентатным (по двум атомам азота и четырем карбоксильным группам), он плотно и прочно связывается с большинством катионов металлов, образуя с ними комплекс состава 1:1. Соответствующая этому аниону кислота называется этилендиаминтетрауксусной (ЭДТУ). Ее двунатриевая соль (то есть соль формулы Na2H2A, где А – этилендиаминтетраацетат-ион) используется для титрования ионов металлов и называется ЭДТА, он же Трилон Б, он же комплексон III.
ЭДТА реагирует с ионами металлов по уравнению: H2A2– + Mn+ = MA(4–n)– + 2H+ (1)
Поскольку ЭДТУ по третьей и четвертой ступени – слабая кислота (pKa = 6,16 и 10,26, соответственно), положение равновесия реакции (1) зависит от рН. Чем сильнее связывается этилендиаминтетраацетат с данным ионом и чем выше рН, тем меньше ионов металла находится в равновесной системе. Ионы, которые прочно связываются с ЭДТА (Fe3+, Al3+), реагируют с ЭДТА даже в кислой среде (рН<2). Чтобы связать Ca2+ или Mg2+, нужна щелочная среда (рН > 10). Для определения таких ионов в раствор следует добавлять щелочные буферные смеси.
Если при подходящем значении рН добавлять ЭДТА к раствору соли металла, то до тех пор, пока ЭДТА находится в недостатке, в растворе будет присутствовать непрореагировавший ион металла. Как только количество ЭДТА и ионов металла в растворе сравняются (в точке эквивалентности), концентрация свободного иона металла будет определяться константой устойчивости комплекса металла с ЭДТА, то есть резко упадет. Точку эквивалентности можно детектировать с помощью ионоселективного электрода, строя кривую зависимости его потенциала от объема добавленного лиганда. В точке эквивалентности на этой кривой будет наблюдаться скачок. Такой метод определения концентрации оказывается гораздо точнее, чем определение концентрации непосредственно по потенциалу ИСЭ, так как потенциал большинства ИСЭ воспроизводится плохо, и на него оказывают влияние присутствующие в растворе слабые лиганды, которые, тем не менее, существенно не влияют на скачок потенциала ИСЭ.
Аналогично можно титровать ионы металлов другими лигандами, образующими с ними прочные комплексы. Титрование ионов металлов различными лигандами называется комплексонометрическим титрованием.
Оборудование. Компьютер с измерительным блоком, приставка-переходник для подсоединения электродов, медь- или свинецселективный электрод (в зависимости от определяемой соли), электрод сравнения, датчик объема жидкого реагента, шприц на 10 мл, магнитная мешалка, штатив химический, штатив для электродов ШУ-98, стакан химический на 50 мл, пипетка мерная на 2 и 10 мл.
Реактивы. Раствор ЭДТА 0,05М. Проба CuSO4 или Pb(NO3)2 0,01-0,05М. Ацетатный буферный раствор 1+1М.
П одготовка
к работе.
Собирают
установку для потенциометрического
титрования (рис.). К разъему «ИЭ1»
приставки-переходника подключают
ионоселективный электрод, к разъему
«ЭСр» – электрод сравнения.
Приставку-переходник подключают к
первому разъему измерительного блока.
Ко второму разъему подключают датчик
объема жидкого реагента. В меню программы
L-Химия
– практикум
выбирают сценарий «Титрование: Один
параметр: Потенциал электрод: Автоматическое
определение объема титранта». Выходят
в окно измерений.
одготовка
к работе.
Собирают
установку для потенциометрического
титрования (рис.). К разъему «ИЭ1»
приставки-переходника подключают
ионоселективный электрод, к разъему
«ЭСр» – электрод сравнения.
Приставку-переходник подключают к
первому разъему измерительного блока.
Ко второму разъему подключают датчик
объема жидкого реагента. В меню программы
L-Химия
– практикум
выбирают сценарий «Титрование: Один
параметр: Потенциал электрод: Автоматическое
определение объема титранта». Выходят
в окно измерений.
Ход работы. Снаряжают датчик объема жидкого реагента шприцом на 10 мл с ЭДТА (убедиться, что толкатель датчика упирается в поршень шприца, и из кончика иглы выступил титрант). В химический стакан наливают 10 мл пробы, 1 мл буферного раствора и доводят дистиллированной водой до 25-30 мл. Убеждаются, что электроды погружены в раствор. Запускают процесс перемешивания.
Н
Рис. Установка для потенициометрического титрования.
1 – штатив, 2 – муфта, 3 – датчик объема жидкого реагента, 4 – шприц, 5 – штатив ШУ-98, 6 – электрод сравнения, 7 – измерительный электрод, 8 – стакан химический, 9 – магнитная мешалка
ажатием на экранную кнопку «Пуск» запускают процесс измерения и нажатием на экранную кнопку «Выбор» вводят значение потенциала ИСЭ в исходном растворе. Вращая рукоятку датчика объема жидкого реагента, добавляют из шприца 0,2 – 0,5 мл титранта. Нажатием на экранную кнопку «Выбор» снова вводят в компьютер значение потенциала ИСЭ. И так до скачка потенциала, после которого добавляют еще 1-2 мл. Останавливают измерение нажатием экранной кнопки «Стоп» и сохраняют результаты нажатием экранной кнопки «Архив».Проведенное первое титрование является прикидочным. На основании его результатов оптимизируют условия титрования и проводят точное титрование. Его не обязательно проводить с самого начала.
Целесообразно точно прописать кривую титрования вокруг точки эквивалентности и игнорировать ее участки вдали от этой точки. Поэтому можно сразу добавить в пробу объем титранта на 1-2 мл меньший, чем объем в точке эквивалентности, после чего проводить титрование с шагом 0,1-0,2 мл, добавив титранта на 1-2 мл больше, чем в точке эквивалентности. Если на титрование уходит менее 3 мл титранта, заменяют шприц на 10 мл шприцом на 3 мл.
Точное титрование проводят до трех сходящихся результатов, т.е. пока три результата подряд не будут отличаться друг от друга менее, чем на 0,2 мл.
Обработка результатов. По окончании измерения переходят в программу «Excel» и открывают в ней полученные файлы. Первый столбец в них – объем титранта, второй – потенциал ИСЭ при этом объеме. Строят график зависимости потенциала от добавленного объема титранта. Объем, при котором происходит скачок потенциала, соответствует точке эквивалентности. Его определяют графически (построив на графике частую сетку по оси абсцисс). Концентрацию иона металла С(M) рассчитывают по формуле:
С(М) = С(ЭДТА)•V(ЭДТА)/V(M), где С(ЭДТА) – концентрация ЭДТА, V(ЭДТА) – его объем в точке эквивалентности, V(M) – объем пробы.
Отчет. В отчете должна быть указана концентрация титранта и объем пробы, приведены кривые титрования и отмечены значения объема титранта в точках эквивалентности. В выводе привести среднюю концентрацию иона металла с доверительным интервалом.
Контрольные вопросы.
К чему следует стремиться при подборе условий комплексонометрического титрования – к увеличению скачка потенциала в точке эквивалентности или к его уменьшению? Ответ обоснуйте.
Почему комплексонометрическое титрование – более точный метод определения концентрации иона, чем прямое определение с помощью ИСЭ?
Почему ни медь, ни свинец нельзя титровать трилоном Б с детектированием точки эквивалентности по ИСЭ в сильнощелочной среде?
Лабораторная работа №15. Определение жесткости и кальция в воде методом комплексонометрического титрования
Работа выполняется на РМС «Ионометрия» или УРМС.
Цель: определить жесткость и концентрацию ионов Ca2+ в воде титрованием ЭДТА с ионометрическим детектированием точки эквивалентности.
Теория. Природная вода не является абсолютно чистой. В ней всегда присутствуют растворенные соли. В большинстве природных вод России преобладающими катионами являются катионы Ca2+ и Mg2+, а анионами – HCO3-. Катионы Ca2+ и Mg2+ называются катионами жесткости, а их суммарная концентрация – жесткостью воды.
Катионы Ca2+ и Mg2+ существенно влияют на применение воды в хозяйственных целях. Они образуют нерастворимые соединения с простейшими мылами (натриевыми солями жирных кислот), поэтому они затрудняют образование мыльной пены. С другой стороны, в мягкой воде мыло очень трудно смывается.
При нагревании воды, содержащей ионы жесткости и гидрокарбонат-ионы, между ними происходит реакция: Ca2+ + 2HCO3– = CaCO3↓ + H2O + CO2↑.
Выделяющиеся твердые карбонаты образуют накипь, которая создает многочисленные проблемы при использовании воды. Она забивает просветы труб и оседает на нагревательных элементах, выступая как ненужный теплоизолятор.
Поскольку катионы жесткости мешают применению природной воды, их стараются удалять или переводить в связанную форму. Этот процесс называется умягчением воды.
В щелочной среде (при рН>10) ЭДТА реагирует с ионами Ca2+ и Mg2+. Поэтому имеется возможность комплексонометрически титровать Ca2+ по кальцийселективному электроду. Однако кальцийселективный электрод также чувствителен и к Mg2+. Кроме того, ион Mg2+, связываясь с ЭДТА не намного слабее, чем Ca2+, частично вытесняет последний из комплекса с ЭДТА. Поэтому, пока в растворе присутствует Mg2+, концентрация Ca2+ поддерживается относительно высокой, а на кривой титрования наблюдается два скачка. Первый, не очень заметный, соответствует точке эквивалентности для Ca2+, второй, более ярко выраженный – для суммы Сa2+ и Mg2+, то есть общей жесткости. Таким образом, комплексонометрическим титрованием по кальцийселективному электроду можно определять жесткость природной воды.
Для титрования нужен рН>9. Обычно такой рН создают аммиачным буфером, однако аммиак вредно влияет на мембрану кальцийселективного электрода, поэтому в данной задаче целесообразно использовать глициновый буфер (рН=9,7).
Оборудование. Компьютер с измерительным блоком, приставка-переходник для подсоединения электродов, кальцийселективный электрод, электрод сравнения, датчик объема жидкого реагента, шприцы на 3 и 10 мл, магнитная мешалка, штатив химический, штатив для электродов ШУ-98, стакан химический на 100 мл, цилиндр или мерная пипетка на 100 мл, пипетка мерная на 10 мл.
Реактивы. Раствор ЭДТА 0,05М. Проба природной воды. Глициновый буферный раствор (2М глицин + 1М NaOH).
Подготовка к работе. Собирают установку для потенциометрического титрования (рис. 1). К разъему «ИЭ1» приставки-переходника подключают ионоселективный электрод, к разъему «ЭСр» – электрод сравнения. Приставку-переходник подключают к первому разъему измерительного блока. Ко второму разъему подключают датчик объема жидкого реагента. В меню программы L-Химия - практикум выбирают сценарий «Титрование: Титрование с контролем одного параметра: Потенциометрическое титрование: Автоматическое определение объема титранта». Выходят в окно измерений.
Ход работы. Снаряжают датчик объема жидкого реагента шприцом на 10 мл с ЭДТА (убедиться, что толкатель датчика упирается в поршень шприца, и на кончике иглы проступила капля титранта). В химический стакан наливают 100 мл пробы и 5 мл буферного раствора. Убеждаются, что электроды погружены в раствор. Запускают процесс перемешивания.
Нажатием на экранную кнопку «Пуск» запускают процесс измерения и нажатием на экранную кнопку «Выбор» вводят значение потенциала ИСЭ в исходном растворе. Вращая рукоятку датчика объема жидкого реагента, добавляют из шприца 0,2 – 0,5 мл титранта. Нажатием на экранную кнопку «Выбор» снова вводят в компьютер значение потенциала ИСЭ. И так до скачка потенциала.
Останавливают измерение нажатием экранной кнопки «Стоп» и сохраняют результаты нажатием экранной кнопки «Архив». Проведенное первое титрование является прикидочным. На основании его результатов оптимизируют условия титрования и проводят точное титрование. Его не обязательно проводить с самого начала. Целесообразно точно прописать кривую титрования вокруг точки эквивалентности и игнорировать ее участки вдали от этой точки. Поэтому можно сразу добавить в пробу объем титранта на 1–2 мл меньший, чем объем в точке эквивалентности, после чего проводить титрование с шагом 0,1–0,2 мл, добавив титранта на 1–2 мл больше, чем в точке эквивалентности. Если на титрование уходит менее 3 мл титранта, заменяют шприц на 10 мл шприцом на 3 мл.
Точное титрование проводят до трех сходящихся результатов, т.е. пока три результата подряд не будут отличаться друг от друга менее, чем на 0,2 мл.
Обработка результатов. По окончании измерения переходят в программу «Excel» и открывают в ней полученные файлы. Первый столбец в них – объем титранта, второй – потенциал ИСЭ при этом объеме. Строят график зависимости потенциала от добавленного объема титранта. Объем, при котором происходит скачок потенциала, соответствует точке эквивалентности. Его определяют графически (построив на графике частую сетку по оси абсцисс). Концентрацию иона металла С(M) рассчитывают по формуле:
С(М) = С(ЭДТА)•V(ЭДТА)/V(M), где С(ЭДТА) – концентрация ЭДТА, V(ЭДТА) – его объем в точке эквивалентности, V(M) – объем пробы.
Отчет. В отчете должна быть указана концентрация титранта и объем пробы. Должны быть приведены кривые титрования и отмечены значения объема титранта в точках эквивалентности. В выводе привести среднюю концентрацию иона Ca2+ и среднюю жесткость с доверительным интервалом.
Контрольные вопросы.
Какие катионы называют катионами жесткости?
Что такое жесткость воды
Какой процесс называют умягчением воды?

 =
=
 = 0,006212 г/мл
= 0,006212 г/мл ;
ЭC2H2O4
* 2H2O
=
;
ЭC2H2O4
* 2H2O
=
 =
=
 = 63,04г
= 63,04г =
0,09854н
=
0,09854н
 Г-экв
Г-экв = 0,003727 Г/мл
= 0,003727 Г/мл