
- •Тема 3. Энтропия. Второе начало термодинамики.
- •Некоторые формулировки первого второго начала термодинамики.
- •Формулировки, возникшие в результате анализа работы тепловых машин и отражающие неравноценность теплоты и работы, как форм передачи энергии:
- •2. Формулировки, основанные на определении энтропии и ее свойствах:
- •Расчет изменения энтропии для различных процессов
- •Фазовые переходы первого рода (испарение, плавление, кипение т.Д.) в изотермически обратимых условиях.
- •Нагревание или охлаждение при постоянном давлении (или постоянном объеме).
- •Изотермическое сжатие или расширение идеального газа.
- •Смешение идеальных газов при постоянных температуре и давлении.
- •Постулат Планка. Абсолютные значения энтропии.
- •Изменения энтропии при химических реакциях.
- •Физический смысл энтропии.
Изотермическое сжатие или расширение идеального газа.
![]() (30)
(30)
Смешение идеальных газов при постоянных температуре и давлении.
Если 1 молей одного газа, занимающего объем V1, смешиваются с 2 молями другого газа, занимающего объем V2, то общий объем газовой смеси будет равен (V1 + V2 ). Изменение энтропии в рассматриваемом процессе равно сумме изменений энтропии каждого газа при изменении его объема от первоначального значения до(V1 + V2 ) :
![]() =
=
![]() (31)
(31)
![]() - мольная доля i-го
газа в полученной газовой смеси. Изменение
энтропии при смешении газов всегда
положительно, так как все ln xi
< 0 , поэтому идеальные газы всегда
смешиваются необратимо. Если при тех
же условиях смешиваются два разных
объема одного и того же газа, то уравнение
(48) уже неприменимо. Никаких изменений
в системе при таком смешении не
происходит, и
- мольная доля i-го
газа в полученной газовой смеси. Изменение
энтропии при смешении газов всегда
положительно, так как все ln xi
< 0 , поэтому идеальные газы всегда
смешиваются необратимо. Если при тех
же условиях смешиваются два разных
объема одного и того же газа, то уравнение
(48) уже неприменимо. Никаких изменений
в системе при таком смешении не
происходит, и
![]() S
= 0. Тем не менее, формула (48) не содержит
никаких индивидуальных параметров
газов, поэтому, казалось бы, должна быть
применима и к смешению одинаковых газов.
Это противоречие называют парадоксом
Гиббса.
S
= 0. Тем не менее, формула (48) не содержит
никаких индивидуальных параметров
газов, поэтому, казалось бы, должна быть
применима и к смешению одинаковых газов.
Это противоречие называют парадоксом
Гиббса.
Постулат Планка. Абсолютные значения энтропии.
Для энтропии характерна шкала абсолютных значений, в основе которой лежит тепловая теорема Нернста и постулат Планка (третий закон термодинамики) . Тепловая теорема Нернста: вблизи абсолютного нуля температур все процессы протекают без изменения энтропии.
Постулат
Планка: энтропия
идеального кристаллического вещества
равна нулю при абсолютном нуле температур
![]() .
.
![]()
![]() (32)
(32)
![]() - абсолютная
энтропия некоторого вещества при
температуре Т (стандартное значение).
- абсолютная
энтропия некоторого вещества при
температуре Т (стандартное значение).
Для расчета абсолютной энтропии веществ в стандартном состоянии надо знать зависимости теплоемкости Cp от температуры для каждой из фаз, а также температуры и энтальпии фазовых переходов. Так, например, абсолютная энтропия газообразного вещества в стандартном состоянии при температуре T складывается из следующих составляющих:
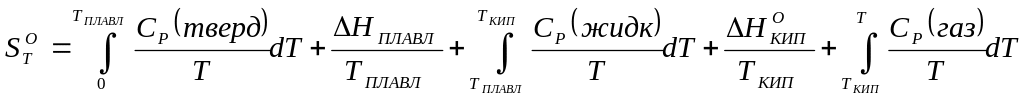 (33)
(33)
В термодинамических таблицах приводят значения абсолютных энтропий веществ в стандартном состоянии при температуре 298 К.
Изменения энтропии при химических реакциях.
Значения абсолютной энтропии веществ используют для расчета изменения энтропии в химических реакциях. Изменение энтропии при химической реакции равно разности абсолютных значений энтропий продуктов реакции (i) и исходных веществ (j) с учетом стехиоетрических коэффициентов.
![]() (34)
(34)
Пример 4. Вычислить изменение энтропии для реакции С2Н2 + 2 Н2 = С2Н6 в стандарт
ных условиях при температуре 298 К.
Решение: В справочнике находим значения абсолютных энтропий участников реакции при температуре 298 К:
С2Н2 Н2 С2Н6
![]() кал/моль К
48,00 31,21 54,85
кал/моль К
48,00 31,21 54,85
![]() =
(
С2Н6)
-
(С2Н2)
- 2
(
Н2)
=
(
С2Н6)
-
(С2Н2)
- 2
(
Н2)
= 4,85 – 48,00 - 231,21 = - 5,7 кал/моль К
