
- •Экспериментальная часть
- •6. Выведите математическое выражение для расчета массы растворенного вещества в любом объёме раствора при известной молярной концентрации раствора. Работа №3. Скорость химических реакций
- •Экспериментальная часть
- •Контролирующие задания
- •Работа 4. Окислительно-восстановительные реакции
- •1. Метод электронного баланса
- •2. Метод полуреакций
- •Экспериментальная часть
- •Контролирующие задания
- •Работа № 5 качественные реакции
- •Экспериментальная часть
- •Работа 6. Жесткость воды
- •Экспериментальная часть
Контролирующие задания
1. По какому признаку реакции подразделяются на простые и сложные, гомогенные и гетерогенные?
2. Какие реакции называются сложными? Какая стадия сложной реакции является лимитирующей?
3. Перечислите факторы, от которых зависит скорость реакции.
4. Как формулируется и как записывается в математическом виде правило Вант-Гоффа?
5. Какая энергия называется энергией активации? Как она влияет на скорость химической реакции? Зависит ли она от температуры?
6. Каков физический смысл предэкспоненциального множителя в уравнении Аррениуса? От чего он зависит и не зависит?
7. Кинетическое уравнение реакции имеет вид V = k·CA·C. Как изменится скорость при увеличении концентраций А и В в 2 раза? Как при этом изменится константа скорости?
Работа 4. Окислительно-восстановительные реакции
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степеней окисления элементов. Окислением называется процесс повышения, а восстановлением – понижения степени окисления. Атом, молекула или ион, в котором степень окисления элемента повышается, называется восстановителем, а в котором понижается – окислителем. Согласно электронной теории (Писаржевский Л.В., 1914), изменение степеней окисления в окислительно-восстановительных реакциях обусловлено отдачей электронов восстановителем и присоединением их окислителем.
Окислителями являются простые вещества – неметаллы (галогены, кислород, сера и др.), а также кислоты и соли, в которых центральный атом имеет высшую степень окисления (HNO3, HClO3, КNO3, КClO3, KMnO4, K2Cr2O7, и др.). Восстановителями являются металлы, некоторые неметаллы (водород, углерод, кремний) и соединения, в которых имеется атом в низшей степени окисления (H2S, NH3, НCl, КBr, КI, FeSO4, SnCl2 и др.).
Вещества, содержащие атомы в промежуточной степени окисления, могут быть как окислителями, так и восстановителями в зависимости от «партнера» и условий проведения реакции. О таких веществах говорят, что они обладают окислительно-восстановительной двойственностью; к ним относятся нитриты, сульфиты, MnO2 и др.
Различают четыре типа окислительно-восстановительных реакций.
Межмолекулярное окисление-восстановление. Это реакции, в которых окислитель и восстановитель являются разными веществами, например:
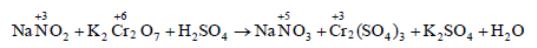
2. Внутримолекулярное окисление-восстановление. Это реакции, которые протекают с изменением степеней окисления атомов разных элементов, входящих в состав одного и того же вещества, например:
![]()
3. Диспропорционирование. Это реакции, в которых происходит увеличение и уменьшение степени окисления одного и того же элемента (окислителем и восстановителем является одно и то же вещество):
![]()
4. Контрдиспропорционирование. Это реакции, в которых участвуют два вещества с атомами одного и того же элемента в разных степенях окисления:
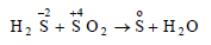
Определение стехиометрических коэффициентов перед веществами в реакциях окисления-восстановления проводят двумя методами: электронного баланса и полуреакций.
