
- •Глава12
- •1 2.1. Виробничий мікроклімат
- •12.2. Виробничий шум
- •1 2.3. Виробнича вібрація
- •12.5. Електромагнітні поля на виробництві
- •Глава 13
- •1 3.1. Дослідження запиленості повітря
- •13.2. Дослідження токсичних речовин у повітрі виробничих приміщень
- •13.3. Гігієнічна оцінка токсичності шкідливих хімічних речовин
- •Глава 14
- •1 4.1. Організація і проведення медичних оглядів
- •14.2. Облік. Реєстрація та розслідування професійних захворювань і нещасних випадків
- •Екстрене повідомлення
- •14.3. Аналіз захворюваності працюючих
- •14.4. Дослідження функціонального стану працюючих
- •Глава 15
- •15.1. Гігієнічні аспекти роботи лікарів лікувального профілю
- •15.2. Гігієнічна експертиза проектів лікувальних закладів
- •2 Ліжка; 5 - палати на 1 ліжко; 6 - процедурна;
- •15.3. Гігієнічний контроль за експлуатацією лікувально-профілактичних закладів
- •Глава16
- •1 6.1. Радіоактивні перетворення і види випромінювань
- •16.2. Методи реєстрації іонізуючих випромінювань
13.3. Гігієнічна оцінка токсичності шкідливих хімічних речовин
Оцінка токсичності вперше синтезованої хімічної речовини здійснюється в три стадії: попередня токсикологічна оцінка; повна токсикологічна оцінка; клініко-гігієнічне коригування встановленого в експерименті санітарного стандарту.
Попередня токсикологічна оцінка полягає у визначенні орієнтовних безпечних рівнів дії (ОБРД) речовин - тимчасових норм вмісту речовин у повітрі, встановлених розрахунковим шляхом за допомогою експрес-експериментальних методів прогнозування токсичності. Розрахунок ОБРД здійснюють на основі математичних рівнянь, виходячи з хімічної будови, фізико-хімічних властивостей речовин (молекулярної маси, густини, леткості, розчинності, температур плавлення та кипіння, коефіцієнтів заломлення та рефракції тощо), а також параметрів їх гострої токсичності. Математичні моделі для розрахунку ОБРД наведені у спеціальній літературі. ОБРД затверджуються головним державним санітарним лікарем на 2 роки до затвердження ГДК і застосовуються з метою здійснення контролю за станом повітряного середовища на стадії лабораторного синтезу і напівпромислового виробництва речовини при кількості працюючих, що контактують з нею, не більше 100.
Повна токсикологічна оцінка полягає у визначенні ГДК шляхом лабораторного експерименту на тваринах, який дає змогу моделювати вплив хімічної речовини на живий організм і передбачає проведення гострих, підгострих і хронічних експериментів, а також вивчення віддалених наслідків дії речовини. Під час проведення експериментів установлюють усі параметри токсичності та небезпеки, передбачені токсикометричною схемою (табл. 110). Тривалість експериментів залежить від об'єкта довкілля, в якому нормується речовина, і становить при визначенні ГДК у повітрі робочої зони 4-6 місяців.
У гострому досліді визначають ступінь токсичності речовини при одноразовому інгаляційному, перкутанному або перораль-ному введенні в організм за величиною смертельних концентрацій (доз). У діапазоні смертельних концентрацій виділяють дві межі: верхню — абсолютно смертельну і нижню — максимально переносиму. Ці параметри визначають, випробовуючи послідовно зростаючі концентрації (дози) речовини, кожна з яких вивчається на окремій групі тварин (усього 5-6 груп, одна з яких є контрольною).
У попередньому орієнтовному досліді визначають порядок смертельних доз, випробовуючи окремі дози, кратні 10 (наприклад, 5, 50, 500, 5000 мг/кг), на обмеженій (3-5) кількості тварин. Орієнтовні дози можуть бути також визначені за даними літератури або на основі розрахунків за фізико-хімічними властивостями речовини. Розширені досліди починають із дози, при введенні якої в орієнтовних дослідах тварина залишилася живою, тоді як від усіх більш високих доз тварини загинули. У визначеному діапазоні орієнтовних доз на окремих групах тварин (по 6 тварин у кожній групі) вивчають вплив 5-6 зростаючих доз, що відрізняються між собою, наприклад на 50%. Ефект дослідженої серії концентрацій надійніше оцінювати за середньосмертельною дозою (концентрацією), яка має імовірнісний характер і обчислюється з використанням статистичних методів, висвітлених у спеціальній літературі. Зона, обмежена абсолютно смертельною і максимально недіючою дозами (концен-
Таблиця 11О Схема токснкометричних досліджень
Вид досліду і
токспкометричні Визначення
параметри
Гострий дослід
CL]00; DLIOC Абсолютно смертельна концентрація (доза), що спричинює
загибель усіх тварин, взятих у дослід
CL50, DL50, Середньосмертельна концентрація (доза), шо призводить до
загибелі половини взятих у дослід тварин
CL,,, DL,, Максимально переносима концентрація (доза), що не спричинює
загибелі тварин у даній статистичній групі
Lim Поріг гострої дії — мінімальна концентрація (доза), здатна
спричинити токсичний ефект при одноразовому введенні
Lima[s|) Поріг вибіркової (специфічної) дії — мінімальна концентрація
(доза), здатна спричинити специфічний ефект при одноразовому введенні
Zac Зона гострої дії, яка визначається за співвідношенням СЬИ/ Limac
Zsp Зона специфічної дії, яка визначається за співвідношенням
Limac|iito r /lim^
КМЮ Коефіцієнт можливості інгаляційного отруєння, який визнача-
ється за співвідношенням насичувальної концентрації речовини при 20°С до середньосмертельної C2Omas/CL50
КМР Коефіцієнт міжвидових розбіжностей, який виражається відно-
шенням середньосмертельних концентрацій для найбільш витривалого виду тварин до найбільш чутливого CL.0max/CL50m]n П і д г о ст р и й дослід
Kcum Коефіцієнт кумуляції — співвідношення сумарної концентрації
(дози) речовини, яка спричинює певний ефект при дрібному введенні, до концентрації (дози), ефект якої такий самий як і при одноразовому введенні SCL^^/CL^
Хронічний дослід
Limchint r Поріг хронічної загальнотоксичної дії — мінімальна концентрація
(доза), яка зумовлює початкові несприятливі зміни в організмі при тривалій дії
Zch Зона хронічної дії, яка обчислюється за співвідношенням
Limch Поріг віддаленої біологічної дії — мінімальна концентрація
(доза), яка здатна спричинити специфічний (сенсибілізуючий) або віддалені (канцерогенний, мутагенний, ембріо-, гонадотоксичний) ефекти при тривалій дії речовини на рівнях, нижчих за Limcb
Z Зона біологічної дії, яка визначається за співвідношенням
CL50/Limch
Is Коефіцієнт запасу — величина, яка свідчить у скільки разів слід
зменшити Limch, шоб одержати ГДК, і залежить від видових розбіжностей до впливу речовини, кумулятивних властивостей, наявності специфічної віддаленої дії
т раціями), називається зоною гострої дії. Чим вона вужча, тим більша імовірність гострого смертельного отруєння.
Абсолютні значення параметрів токсичності і залежність "концентрація (доза) — ефект" відрізняються у тварин різних видів, статі, віку, з різними функціональними відмінностями та особливо
стями харчування. У зв'язку з цим середньосмертельну концентрацію визначають на мінімум чотирьох видах лабораторних тварин (мишах, білих щурах, мурчаках, кролях) з метою вивчення міжвидових розбіжностей до дії отрути, зі збільшенням яких можлива висока чутливість людини до впливу певної речовини. Водночас гострий дослід проводять на тваринах однієї статі, віку та маси. Допустимі коливання маси тіла тварин у групі не повинні перевищувати ±5-7%. Маса тіла мишей, яких використовують в експерименті, 20-30 г, щурів 100-300 г.
Для моделювання надходження речовин в організм інгаляційним шляхом, який є основним в умовах виробництва, використовують за-труювальні камери різної конструкції зі спеціальними дозаторами (мал. 80), скляні банки або ексикатори, що закриваються герметично. Для перевірки камери на герметичність до неї вносять невелику кількість аміаку, поява запаху якого у приміщенні, або посиніння лакмусового папірця, свідчить про недостатню герметичність.

Мал. 80. Камери для затруєння тварин.
Найпростішим способом інгаляційного затруєння тварин є статичний, під час якого циркуляція повітря у камері не відбувається (мал. 80). У камері створюється певна концентрація речовини К (мг/м3), що обчислюється за формулою К = ad-\000/L, де а — кількість внесеної речовини, мл; d — відносна густина; L — об'єм затру-ювальної камери, л. Для створення необхідної концентрації речовину наносять на фільтрувальний папір, складений у вигляді парасольки, який підвішують на нитці до кришки ексикатора. Можна налляти речовину в чашку Петрі, яку поміщають всередині камери.

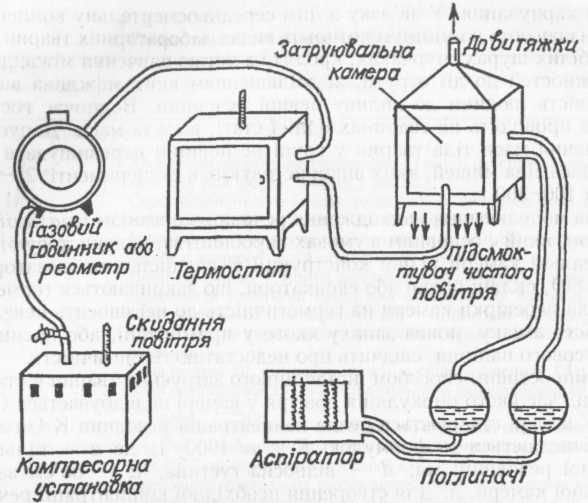
Мал. 81. Установка для динамічного інгаляційного затруєння лабораторних тварин леткими хімічними речовинами.
Концентрацію К у камері обчислюють, виходячи зі зменшення речовини за час досліду, за формулою К = (Р, — Р2) / V, де Р, і Р2 — маса фільтрувального паперу (чашки Петрі з речовиною) до і після досліду, мг; V — об'єм камери, л. Кількість тварин, що одночасно перебувають у камері, визначається з необхідного об'єму повітря на одну тварину: 1-2 л для миші, 5 л для щура, 5-7 л для мурчака, 25 л для кролика. Статичне інгаляційне затруєння допускається для проведення лише гострих експериментів з експозицією, що становить 2 год для мишей і 4 год для щурів та інших видів тварин.
При динамічному затруєнні у камеру вводять повітря, що містить досліджувану речовину, й упродовж досліду в камері забезпечують безперервний повітрообмін і сталу концентрацію речовини в зоні дихання тварин. Установка для динамічного затруєння складається зі спонукача руху повітря, пристрою для подачі досліджуваної речовини у камеру, повітропроводів, реометрів тощо (мал. 81). Об'єм подаваного у камеру повітря на 1 кг маси тіла тварин повинен становити не менше 5 л/хв, температура не вище 25°С, вологість — не вище 75%.
Моделювання надходження речовин в організм перкутаниим шляхом — другим за значущістю після інгаляційного у виробничих умовах — здійснюють шляхом аплікації речовини на шкіру хвоста мишей (експрес-оцінка) або виголену ділянку тіла щурів, мурчаків чи
кролів (кількісна оцінка). Тверду речовину попередньо розчиняють у воді або соняшниковій олії. Тварину фіксують у станку, хвіст занурюють у пробірку з досліджуваною речовиною на 2/3 його довжини (мал. 82). Щоб уникнути потрапляння речовини через органи дихання, пробірку герметизують корком з отвором для хвоста. Щілину між корком і хвостом закривають пластиліном або парафіном. Дослід проводять у витяжній шафі, розташовуючи голову тварини назовні. Експозиція для мишей становить 3 год, для щурів — 4 год.
Кількісну оцінку перкутанної токсичності здійснюють шляхом нанесення досліджуваної речовини на заздалегідь виголену ділянку шкіри тварини (розміром 2x2 см на животі щура, 4x5 см на спині, збоку від хребта кроля), зафіксованої у спеціальному станку. Рідкі речовини наносять у нерозведеному вигляді, тверді — в концентрованих водних або олійних розчинах чи мазях на основі ланоліну, вазеліну. Щоб запобігти розтіканню і випаровуванню речовини, на виголену ділянку приклеюють скляний циліндр (ковпачок) з пробкою нагорі, під який вносять потрібну кількість речовини. Контролем слугують тварини, на шкіру яких наносять відповідну кількість чистого розчинника.

Місцеву подразнювальну дію на слизову ока вивчають внесенням у кон'юнктивальний мішок одного ока кроля досліджуваної речовини (50 мг твердої речовини або 1~2 краплі рідини). Друге око залишають для контролю. Щоб внести речовину в око, відтягують нижню повіку, наносять препарат і за декілька секунд наближають нижню і верхню повіки. Потім на 1 хв притискають палець до внутрішнього кутика ока, стискаючи сльозо-носовий канал. Аплікацію здійснюють одноразово, ефект реєструють відразу після внесення і через 1, 24 і 72 год. Реєструють стан кон'юнктиви (вираженість ін'єкції судин, наявність набряку, характер виділень) та рогівки (візуально або за допомогою офтальмоскопа визначають ступінь помутніння рогівки, наявність гіперемії та набряку райдужки, вираженість реакції зіниці на світло). Місцеву подразнювальну дію на шкіру вивчають нанесенням на заздалегідь виголену шкіру кролів (на внутрішню поверхню вуха), мурчаків або щурів (див. вивчення перкутанної дії) речовини у чистому вигляді або концентрованому водному чи олійному розчині.
Кількість аплікацій визначається вираже- Мал82 Дослідження
ністю ефекту і коливається від 1 до ЗО перкутанної
разів. Реакцію шкіри оцінюють щоденно токсичності речовини
за появою гіперемії (за шкірною температурою, яка вимірюється елек-тротермометром), набряку (за товщиною шкірної складки, яку захоплюють пальцями на кінцях видимої межі набряку і вимірюють мікрометром), некрозу (за площею, охопленою некротичним процесом). Крім подразнювальної дії на шкіру та слизову ока, вивчають сенсибілізуючу дію речовини.
При пероральному шляху надходження хімічних речовин, також можливому в умовах виробництва, гостре затруєння тварин здійснюється шляхом введення точно відміряної дози речовини у шлунок за допомогою металевого або еластичного зонда та шприца. Металевий зонд являє собою товсту, сточену з кінця голку від шприца, яку трохи вигинають і обладнують невеликим потовщенням на кінці у вигляді оливи. Хімічна речовина вводиться у чистому вигляді або у вигляді водних розчинів, олійних (на рафінованій соняшниковій олії) чи крохмальних (на 1-2% розчині крохмалю) емульсій, а також суспензій. Введення речовини у шлунок тварин проводять натще, через 4 год після годування, в об'ємі 1-1,5% маси тіла (0,5-1 мл для мишей, 3~8 мл для щурів, 4-6 мл для мурчаків, 100-200 мл для кролів). Речовину вводять повільно, щоб запобігти потраплянню її у дихальні шляхи. Контрольній групі тварин вводять відповідну кількість розчинника (емульгатора).
У протокол досліду заносять дані про спосіб введення речовини, кількість загиблих тварин і тих, що вижили, строки їх загибелі, значення досліджуваних доз. За результатами досліду обчислюють значення середньосмертельної дози та інші показники гострої токсичності.
Під час гострого досліду також описують клініку гострого смертельного отруєння, яка дає уявлення про загальний характер дії досліджуваної речовини. Розрізняють чотири фази отруєння: 1) прихована фаза, яка триває від моменту введення речовини до появи перших ознак її токсичної дії; 2) продромальна фаза, що характеризується початковими симптомами; 3) фаза наростання отруєння; 4) фаза найвищого розвитку симптомів. Остання фаза може завершуватися загибеллю або поступовим поліпшенням стану піддослідної тварини. Для гострих отруєнь характерні зміни стану нервово-м'язової збудливості, рухової активності, ступеня агресивності, полохливості тварин — поява тремору, судом, порушення ходи (атаксія), вертикальне розташування хвоста (тест Штрау-ба), які свідчать про ступінь збудження спінальних мотонейронів, реакція на дотик і больова реакція, зміни положення тіла, кінцівок, загального тонусу скелетних м'язів, реакція відсмикування голови при подразненні рогівки (рогівковий рефлекс), зміни розмірів зіниці, екзофтальм, збільшення ступеня салівації, частоти дихання і серцевих скорочень. Ці зміни виявляють шляхом спостереження за реакцією тварин на зміни оточуючої ситуації (пересування на відкритому столі, майданчику з отворами та перегородками, реакції на звуковий, тактильний, больовий подразники) і заносять у протокол.
Наприкінці досліду загиблих тварин, а також тих, що вижили, піддають патологоанатомічним дослідженням, а також визначають зміни відносної маси внутрішніх органів. Перед забиттям тварин зважують, після їх розтину виділяють і знаходять абсолютну масу окремих органів з подальшим обчисленням вагового коефіцієнта — відношення маси органа до маси тіла тварини. Одержані дані порівнюють з даними контрольної групи тварин.
У підгострому досліді тривалістю близько 1/30 терміну життя тварини (12-21 день для мишей, 21-45 днів для щурів, 45-72 дні для кролів) вивчають особливості токсикодинаміки речовини та ЇЇ кумулятивні властивості. У підгострому досліді на декількох групах тварин вивчають вплив доз (концентрацій), які становлять 1/10, 1/25, 1/50 DL50 (СЦ0), при їх щоденному введенні в організм. Стан тварин оцінюють за допомогою морфологічних і гістохімічних досліджень, які дають змогу виявити найбільш чутливі до дії речовини органи та системи і на цій підставі відібрати адекватні методи для проведення хронічного експерименту. Обчислюють коефіцієнт кумуляції К, значення якого менше 1 свідчить про надкумуляцію, 1-3 — про значну, 3-5 — помірну, більше 5 — про незначну здатність досліджуваної речовини накопичуватися в організмі.
У хронічному досліді визначають пороги хронічної загаль-нотоксичної та специфічної дії речовини при щоденному (окрім вихідних) введенні її в організм декількох груп піддослідних тварин упродовж 4-6 місяців у наступних концентраціях (дозах): перша, яка відповідає чи дещо перевищує Limac, друга — на порядок нижча, третя — на рівні недіючої. Упродовж усього терміну хронічного досліду періодично, не рідше одного разу на місяць, проводять динамічне спостереження за станом піддослідних тварин, що дає змогу визначити патогенез інтоксикації.
Порогові концентрації (дози) у гострому, підгострому та хронічному дослідах визначають з використанням інтегральних (неспецифічних) та специфічних високочутливих адекватних методів дослідження стану експериментальних тварин, які дають змогу виявляти зміни на рівні організму, а також на органно-тканинному, клітинному і субклітинному рівнях.
До інтегральних відносять показники, які віддзеркалюють загаль-нотоксичні зміни в організмі тварин, що виникають незалежно від точки прикладення дії отрути: зміни маси тіла, терморегуляції, газообміну, функцій центральної нервової системи, м'язової працездатності тощо.
Одним із найпростіших інтегральних тестів є вивчення динаміки маси тіла піддослідних тварин. Тварин зважують завжди в один і той же час — вранці перед годуванням. До початку досліду проводять 2-3 зважування з інтервалом 3-5 днів для з'ясування нормальної динаміки маси тіла. У короткотривалих дослідах тварин зважують щоденно, порівнюючи одержані результати з масою тіла контрольних тварин.
Чутливим показником дії деяких отрут є вимірювання температури тіла тварин. Температуру, яка зазнає добових і сезонних коливань, слід вимірювати в один і той же час у контрольних і піддослідних тварин одночасно. Вимірюють температуру у щурів та мишей у прямій кишці на глибині 13-15 мм за допомогою електротер-мометра.
Для дослідження функціонального стану центральної нервової системи часто застосовують метод сумації підпорогових імпульсів. Сумаційно-пороговий показник визначають за допомогою спеціальної установки, що складається з імпульсного електростимулятора ICE —01 (подає струм з тривалістю імпульсу 0,2 с, напруга якого поступово зростає зі швидкістю 2 В/с і вертикальної панелі з органічного скла з двома горизонтальними металевими електродами, які обгортають марлею і змочують ізотонічним розчином хлориду натрію. Тварину розташовують так, щоб передні лапи знаходилися на додатному, а задні — на від'ємному електродах, і поступово збільшують напругу, що врешті викликає відсмикування однієї з кінцівок. Показником сумаційної здатності нервової системи є зареєстрована порогова напруга у вольтах, яка під впливом промислових отрут, як правило, знижується.
До інтегральних методів вивчення функціонального стану нервової системи належить дослідження поведінкових реакцій тварин, зокрема ніркового рефлексу гризунів, який дає змогу судити про їх дослідницьку, орієнтувальну активність.Тварину поміщають на центр горизонтальної площадки розмірами 60x60 см, поділеної на квадрати розміром 10x10 см з отворами діаметром 4 см всередині кожного квадрата. Упродовж 3 хв підраховують і реєструють кількість зазирань у отвори-нірки, число підіймань на задні лапки, кількість перетнутих квадратів, яка під впливом токсичної речовини зменшується. Дослід проводять завжди за одних і тих же умов: час доби, стандартна освітленість площадки, відсутність світлових і звукових подразників.
Для оцінки стану нервово-м'язового апарату і виявлення атаксії застосовують пробу із гладким дерев'яним стрижнем діаметром 2 см, що обертається зі швидкістю 10 об/хв. Мишей поміщають на стрижень, на якому контрольні тварини здатні утриматись понад ЗО с, піддослідні не можуть утриматися упродовж цього терміну.
М'язову працездатність тварин досліджують у пробі з підвисанням. Тварину поміщають на металевий стрижень (дріт), розташований горизонтально. Контрольні миші чіпляються за стрижень чотирма лапами упродовж 5 с. У досліді відмічають кількість мишей, які не здатні триматися стрижня хоча б однією із задніх лап.
До інформативних інтегральних тестів належать також тести з функціональним і екстремальним навантаженням: фізичним (тривале плавання, бігу третбані), хімічним і фармакологічним, термічним (охолодження, перегрівання), біологічним (голодування, кровопускання) тощо, які дають змогу оцінити пристосовні резерви організму і виявити приховані патологічні зміни. Простим методом
вивчення працездатності є проба з плаванням. Перед дослідом на хвіст тварин підвішують вантаж, який становить для мишей 5% маси тіла, для щурів — 10%. Потім тварин пускають плавати у посудину завглибшки 18-20 см для мишей і 30-35 см для щурів з температурою води 38-39°С. Реєструють час до першого занурювання у воду або до моменту остаточного опускання тварини на дно. Інтегральним біологічним функціональним навантаженням є зміна режиму харчування тварин. Тваринам не дають їсти дві доби, залишаючії їм тільки воду в достатній кількості. Показником прихованих змін у стані організму є абсолютне значення падіння маси тіла і час її відновлення. Прикладом фармакологічного навантаження є гексенало-ва і алкогольна проби. 2% розчин гексеналу вводять внутрішньооче-ревинно і реєструють час виникнення бічного положення та тривалість сну піддослідних і контрольних тварин. 40% розчин етилового спирту вводять внутрішньошлунково і порівнюють стан тварин до і через ЗО хв після введення за будь-яким тестом вивчення функціонального стану нервової системи, наприклад, за сумаційно-пороговим показником.
Специфічні (патогенетичні) показники віддзеркалюють особливості змін в організмі, характерні для впливу лише певної речовини або класу хімічних сполук. Прикладом можуть слугувати пригнічення активності холінестерази в біосубстратах організму під впливом фосфорорганічних сполук і карбаматів, зменшення вмісту сульфгідрильних груп при отруєнні солями важких металів, порушення порфіринового обміну під впливом свинцю. При вивченні кардіо-токсичних речовин доцільно використовувати показники тканинного дихання, гліколізу, вміст макроергів, активність ферментних систем, що забезпечують метаболізм ферментів міокарда (аспартатамі-нотрансферази, лактатдегідрогенази, креатинфосфокінази, сукцинде-гідрогенази, цитохромоксидази й т. ін.). Гепатотоксичність речовини оцінюють за показниками антитоксичної, екскреторної, білково-, ферментно- та пігментотворної функцій. Нефротоксичність речовин вивчають за величиною спонтанного діурезу, відносною густиною сечі, вмістом білка і хлоридів у сечі, креатину, залишкового азоту і сечовини у сечі та крові. Застосовують проби на виведення барвників (індигокарміну, фенолового червоного). Для збирання сечі від дрібних лабораторних тварин зручними є спеціальні обмінні камери з органічного скла.
Характер і механізм токсичного впливу промислових отрут вивчають із застосуванням біохімічних (активність ферментів у біосубстратах, стан білкового, жирового, вуглеводного, мінерального, вітамінного, електролітного, водного та інших обмінів), морфологічних і гістохімічних методів. Значною інформативністю характеризується метод мічених атомів (використання радіоактивних ізотопів).
Для вивчення віддалених наслідків впливу шкідливих речовин (сенсибілізуючого, ембріотропного, мутагенного, бластемогенного) застосовують спеціальні методи, які детально викладені у відповідній літературі.
Матеріали досліджень піддають статистичній обробці. Вірогідними прийнято вважати зміни, ймовірність яких перевищує 95% (р<0,05). За порогові вважають такі мінімальні концентрації (дози), які зумовлюють зміни в організмі, які вірогідно відрізняються та виходять за межі фізіологічних (понад 28) коливань показника даної серії контрольних тварин або містяться в межах фізіологічної норми, проте стійко зберігаються (понад місяць) після припинення хронічного досліду або невірогідно відрізняються від контролю, але при функціональних екстремальних навантаженнях відхиляються від норми на ±28.
На основі визначених у ході лабораторного експерименту токсико-метричних параметрів речовини з метою екстраполяції даних на людину обґрунтовують коефіцієнт запасу за спеціальними методиками, висвітленими у токсикологічній літературі, і розраховують ГДК. Далі згідно з даними табл. 111, за параметром, значення якого виявилось найменшим, визначають клас небезпеки досліджуваної речовини.
Таблиця 111
Класифікація шкідливих речовин за ступенем токсичності і небезпеки
(ГОСТ 12.1.007-76)
Норма за класами небезпеки
Показник 1 і 1
| І | II | III І IV
ГДК шкідливої речовини у повітрі <0,1 0,1-1,0 1,1-10 >10
робочої зони, мг/м3
Середня смертельна доза при введенні <15 15-150 151-5000 >5000
в шлунок, мг/кг
Середня смертельна доза при нанесенні <100 100-500 501-2500 >2500
на шкіру, мг/кг
Середня смертельна концентрація в <500 500-5000 5001-50000 >50000
повітрі, мг/м3
Коефіцієнт можливості інгаляційного >300 300-30 29-3 <3
отруєння
Зона гострої дії <6 6-18 18,1-54 >54
Зона хронічної дії >10 10-5 4,9-2,5 <2,5
У подальшому затверджена головним державним санітарним лікарем ГДК із зазначенням агрегатного стану, класу небезпеки і шкір-но-резорбтивної дії, яка позначається позначкою "+", вноситься у державний реєстр і застосовується з метою контролю за станом повітряного середовища на багатотоннажних виробництвах.
Клініко-гігієнічне коригування ГДК полягає у перевірці надійності визначеної гранично допустимої концентрації шляхом клініко-статистичних (натурних) досліджень упродовж перших трьох років функціонування підприємства. Зіставляють дані захворюваності, матеріали поглибленого медичного вивчення стану здоров'я працюючих з умовами праці, зокрема із вмістом речовин у повітрі. Виявлення підвищеної захворюваності та змін у стані здоров'я робітників, що контактують з цією речовиною, порівняно з контрольною групою свідчить про недостатню надійність ГДК і служить основою до її перегляду у бік зниження.
