
- •Оглавление
- •Глава 1 16
- •Глава 2 химическая связь 33
- •Глава 3 54
- •Глава 4 82
- •Глава 5 110
- •Глава 6 141
- •Глава 7 173
- •Глава 8 196
- •Глава 9 234
- •Глава 10 комплексные соединения и их свойства 272
- •Глава 11 297
- •Глава 12 316
- •Глава 13 377
- •Глава 14 400
- •Глава 15 основные понятия органической химии 419
- •Глава 16 445
- •Глава 17 474
- •Глава 18 499
- •Глава 19 518
- •Глава 20 562
- •Глава 21 аминокислоты, пептиды и белки 578
- •Глава 22 620
- •Глава 23 651
- •Глава 24 692
- •Глава 25 709
- •Глава 26 740
- •Глава 27 771
- •От автора
- •Глава 1 строение атома, периодический закон и периодическая система элементов д. И. Менделеева
- •1.1. Строение атома
- •1.1.1. Квантовые числа
- •1.1.2. Принципы заполнения атомных орбиталей электронами
- •1.2. Периодический закон и периодическая система элементов д. И. Менделеева
- •1.3. Основные характеристики атомов элементов
- •1.3.1. Радиус атома
- •1.3.2. Энергия ионизации
- •1.3.3. Энергия сродства к электрону
- •1.3.4. Относительная электроотрицательность
- •Глава 2 химическая связь
- •2.1. Ковалентная связь
- •2.1.1. И молекулярные орбитали
- •2.1.2. Механизмы возникновения ковалентной связи
- •2.1.3. Особенности ковалентной связи
- •2.2. Ионная связь
- •2.3. Металлическая связь
- •Глава 3 межмолекулярные взаимодействия и агрегатное состояние вещества
- •3.1. Межмолекулярные взаимодействия
- •3.2. Агрегатное состояние вещества
- •3.2.1. Твердое состояние
- •3.2.2. Жидкое состояние
- •3.2.3. Жидкокристаллическое состояние
- •3.2.4. Паро- и газообразное состояния
- •Глава 4 основы химической термодинамики и биоэнергетики
- •4.1. Основные понятия термодинамики
- •4.2. Первый закон термодинамики
- •4.3. Понятие о самопроизвольных процессах.
- •4.4. Второй закон термодинамики. Энергия гиббса
- •4.5. Принцип энергетического сопряжения биохимических реакций
- •Г лава 5 основы кинетики биохимических реакций и химического равновесия
- •5.1. Основные понятия и терминология раздела
- •5.2. Факторы, влияющие на скорость гомогенных реакций
- •5.2.1. Влияние природы реагирующих веществ
- •5.2.2. Влияние концентрации реагентов.
- •5.2.3. Влияние температуры. Энергия активации
- •5.2.4. Влияние катализатора
- •5.3. Особенности кинетики гетерогенных реакций
- •5.4. Особенности кинетики цепных реакций
- •5.5. Химическое равновесие
- •5.5.1. Смещение химического равновесия
- •5.6. Ферментативный катализ и его особенности
- •5.7. Автоколебательные биохимические процессы
- •Г лава 6 растворы и их коллигативные свойства
- •6.1. Вода как растворитель и ее роль в жизнедеятельности организма
- •6.2. Термодинамика процесса растворения
- •6.З. Способы выражения концентрации растворов
- •6.4. Коллигативные свойства растворов
- •6.4.1. Диффузия
- •6.4.2. Осмос. Осмотическое и онкотическое давление
- •6.4.3. Давление насыщенного пара над раствором
- •6.4.4. Температура кипения и замерзания раствора
- •Глава 7 растворы электролитов и ионные равновесия
- •7.1. Электролитическая диссоциация
- •7.2. Равновесие в растворах слабых электролитов
- •7.2.1. Влияние общего иона и противоиона на равновесие
- •7.2.2. Взаимосвязь константы диссоциации и степени диссоциации
- •7.3. Особенности растворов сильных электролитов. Ионная сила раствора
- •7.4. Электролитическая диссоциация и ионное произведение воды
- •7.5. Водородный и гидроксильный показатели (рН и рОн)
- •7.6. Физико-химические основы водно-электролитного баланса в организме
- •Г лава 8 теория кислот и оснований и протолитические равновесия
- •8.1. Протолитическая теория кислот и оснований
- •8.2. Кислотно-основные свойства а-аминокислот
- •8.3. Важнейшие кислотно-основные реакции
- •8.3.1. Гидролиз солей
- •8.3.2. Реакции нейтрализации
- •8.3.3. Общая, активная и потенциальная кислотность растворов
- •8.4. Протолитический баланс. Буферные растворы и их свойства
- •8.5. Буферные системы организма, их взаимодействие, явления ацидоза и алкалоза
- •9.1. Основные понятия и факторы, влияющие на протекание окислительно-восстановительных реакций
- •9.2. Направление протекания окислительно-восстановительных реакций
- •9.3. Особенности биохимических окислительно-восстановительных процессов в организмах
- •9.3.1. Степень окисления углерода в органических соединениях
- •9.3.2. Биохимические реакции внутри- и межмолекулярной окислительно-восстановительной дисмутации за счет атомов углерода
- •9.3.3. Окислительно-восстановительные превращения кофакторов и коферментов оксидоредуктаз
- •9.3.4. Электронотранспортные цепи
- •9.3.5. Дегидрогеназное окисление-восстановление
- •9.3.6. Окислительное фосфорилирование
- •9.3.7. Фотофосфорилирование
- •9.3.8. Оксигеназное окисление-восстановление
- •9.3.9. Свободнорадикальное окисление и антиоксидантная система организма
- •9.4. Использование окислителей и восстановителей в медико-санитарной практике
- •Глава 10 комплексные соединения и их свойства
- •10.1. Основные понятия и терминология
- •10.2. Химическая связь в комплексных соединениях и особенности их строения
- •10.3. Химические свойства комплексных соединений
- •10.4. Медико-биологическая роль комплексных соединений
- •10.5. Металлолигандный баланс и его нарушения
- •10.6. Комплексонометрия
- •Глава 11 гетерогенные процессы и равновесия в растворах
- •11.1. Основные понятия и теоретические основы
- •11.2. Гетерогенные равновесия в растворах, связанные с процессом кристаллизации
- •11.3. Гетерогенные равновесия в растворах, связанные с процессом расслоения
- •11.4. Гетерогенные равновесия в живых системах
- •Глава 12 химия элементов-органогенов
- •12.2. Строение, химические свойства и роль элементов-органогенов и их соединений в растительном и животном мире
- •12.2.1. Водород и его соединения
- •12.2.2. Углерод и его соединения
- •12.2.3. Азот и его соединения
- •12.2.4. Фосфор и его соединения
- •12.2.5. Кислород и его соединения
- •12.2.6. Сера и ее соединения
- •12.3. Строение и химические свойства галогенов и их соединений
- •Глава 13 химия ионов металлов жизни и их роль в растительном и животном мире
- •13.1. Химия ионов s-металлов в организме
- •13.1.1. Натрий и калий
- •13.1.2. Магний и кальций
- •13.2. Химия ионов d-металлов в организме
- •13.2.1. Марганец
- •13.2.2. Железо и кобальт
- •13.2.3. Медь
- •13.2.4. Цинк
- •13.2.5. Молибден
- •Глава 14 химия и анализ загрязнений окружающей среды
- •14.1. Химия загрязнений атмосферы
- •14.1.1. Токсический смог
- •14.1.2. Фотохимический смог
- •14.1.3. Кислотные дожди
- •14.1.4. Загрязнение атмосферы другими токсикантами
- •14.1.5. Разрушение озонового слоя
- •14.2. Методы анализа токсикантов и методы снижения их поступления в атмосферу
- •14.3. Загрязнение гидросферы. Понятие об общих показателях, характеризующих природные и сточные воды
- •Глава 15 основные понятия органической химии
- •15.1. Основы классификации и номенклатуры органических соединений
- •15.2. Пространственная структура биоорганических молекул и виды изомерии
- •15.3. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •15.4. Классификация органических реакций и их компонентов
- •Г лава 16 алифатические и ароматические углеводороды
- •16.1. Строение и реакционная способность алканов
- •16.2. Строение и реакционная способность ненасыщенных углеводородов: алкенов и диенов
- •16.3. Ароматические углеводороды (арены)
- •Глава 17 спирты, фенолы, простые эфиры, тиолы и сульфиды
- •17.2. Физико-химические свойства спиртов и фенолов
- •17.3. Химические свойства спиртов
- •17.4. Химические свойства фенолов
- •17.5. Простые эфиры
- •17.6. Тиолы и сульфиды
- •Г лава 18 альдегиды, кетоны и их производные
- •18.1. Строение, номенклатура и физико-химические свойства альдегидов и кетонов
- •18.2. Химические свойства альдегидов и кетонов
- •18.2.1. Кислотно-основные свойства
- •18.2.2. Электрофильно-нуклеофильные свойства
- •18.2.3. Окислительно-восстановительные свойства
- •18.2.4. Комплексообразующие свойства
- •18.3. Альдегиды и кетоны в окружающей среде
- •Г лава 19 карбоновые кислоты и их функциональные производные
- •19.2. Химические свойства предельных кислот и их производных
- •19.2.1. Кислотно-основные свойства
- •19.2.2. Карбоновые кислоты как ацилирующие реагенты
- •19.2.3. Производные карбоновых кислот, их свойства и взаимные превращения
- •19.2.4. Окислительно-восстановительные свойства карбоновых кислот и их производных
- •19.3. Особенности свойств замещенных карбоновых кислот и их производных
- •19.3.1. Дикарбоновые кислоты
- •19.3.2. Гидроксикарбоновые кислоты
- •19.3.3. Оксокарбоновые кислоты
- •19.3.4. Ненасыщенные карбоновые кислоты
- •19.4. Основные реакции метаболизма карбоновых кислот
- •19.4.1. Биосинтез жирных кислот
- •1 9.4.2. Биологическое окисление жирных кислот
- •19.4.3. Реакции цикла кребса
- •19.5. Кислоты ароматического ряда и их производные как лекарственные средства
- •Г лава 20 Липиды
- •20.1. Жиры и воски
- •20.2. Омыляемые сложные липиды
- •20.3. Неомыляемые липиды - низкомолекулярные биорегуляторы
- •Глава 21 аминокислоты, пептиды и белки
- •21.1. Строение, классификация и физико-химические свойства а-аминокислот
- •21.2. Химические свойства а-аминокислот
- •21.2.1. Кислотно-основные свойства и прототропная таутомерия
- •21.2.2. К0мплекс00бразующие свойства
- •21.2.3. Электрофильно-нуклеофильные свойства
- •21.2.4. Окислительно-восстановительные свойства
- •21.3. Структура и свойства пептидов
- •21.4. Структура и свойства белков
- •Глава 22 углеводы и полисахариды
- •22.1. Строение, изомерия и свойства моносахаридов
- •22.1.1. Химические свойства моносахаридов и их производных
- •22.1.2. Катаболизм глюкозы - гликолиз
- •22.3. Полисахариды, их структура и свойства
- •22.3.1. Гомополисахариды
- •22.3.2. Гетерополисахариды, протеогликаны, гликопротеины
- •Г лава 23 биологически важные азотсодержащие соединения
- •23.1. Электронные состояния атома азота в его соединениях и свойства этих соединений
- •23.2. Роль аммиака для живых организмов и пути его обезвреживания. Цикл мочевины и ее свойства
- •23.3. Азотсодержащие ароматические гетероциклические соединения
- •23.4. Нуклеозиды, нуклеотиды и нуклеиновые кислоты, их структура и свойства
- •Г лава 24 электрохимия. Электрическая проводимость растворов электролитов
- •24.1. Электрическая подвижность ионов в растворе
- •24.2. Удельная электрическая проводимость растворов электролитов
- •24.3. Молярная электрическая проводимость растворов электролитов
- •24.4. Закон независимого движения ионов в разбавленных растворах (закон кольрауша)
- •24.5. Кондуктометрические методы анализа
- •24.5.1. Кондуктометрическое титрование
- •24.6. Электрическая проводимость биологических объектов в норме и патологии
- •Г лава 25 межфазные электрические потенциалы, гальванические цепи, потенциометрия
- •25.1. Возникновение двойного электрического слоя и виды электрических потенциалов
- •25.2. Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение нернста
- •25.3. Восстановительный потенциал
- •25.4. Диффузионный потенциал
- •25.5. Мембранный потенциал
- •25.6. Потенциометрия
- •25.6.1. Хлорсеребряный электрод сравнения
- •25.6.2. Ионо- и молекулярноселективные электроды определения
- •25.6.3. Потенциометрическое титрование
- •Глава 26 физико-химические основы поверхностных явлений
- •26.1. Свободная поверхностная энергия
- •26.2. Сорбция и ее виды
- •26.3. Абсорбция
- •26.4. Адсорбция
- •26.4.1. Адсорбция на неподвижной поверхности раздела фаз
- •26.4.2. Молекулярная адсорбция из растворов на твердых адсорбентах
- •26.4.3. Адсорбция ионов из растворов
- •26.4.4. Ионообменная адсорбция
- •26.5. Адсорбция на подвижной поверхности раздела фаз
- •26.6. Поверхностно-активные вещества
- •26.7. Хроматография
- •Глава 27 физикохимия дисперсных систем
- •27.2. Лиофобные коллоидные растворы
- •27.2.1. Строение мицелл в лиофобных коллоидных растворах
- •27.2.2. Свойства лиофобных коллоидных растворов
- •27.2.3. Влияние высокомолекулярных соединений на устойчивость лиофобных коллоидов. Флокуляция
- •27.3. Лиофильные коллоидные растворы
- •27.3.1. Строение мицелл пав и вмс в водных коллоидных растворах в зависимости от их концентрации
- •27. 3. 2. Получение и свойства лиофильных коллоидных растворов
- •27.3.3. Моющее действие растворов пав
- •27.3.4. Особенности растворов биополимеров
- •27.4. Структурообразование в растворах вмс. Возникновение связнодисперсных систем и их свойства
- •27.5. Грубодисперсные системы
- •27.5.1. Суспензии
- •27.5.2. Эмульсии
- •27.5.3. Аэрозоли
- •27.6. Электрокинетические явления в дисперсных системах
- •27.7. Ткани организма - дисперсные системы
- •27.7.1. Строение и свойства межклеточных мембран
- •27.7.2. Кровь - сложная дисперсная система
- •Приложение 1 применение осмолярной и осмоляльной концентраций в практической медицине
15.4. Классификация органических реакций и их компонентов
Реакции с участием органических соединений подчиняются тем же законам, что и реакции в неорганической химии, хотя и имеют некоторые специфические особенности. В неорганической химии в реакциях обычно участвуют ионы, поэтому они протекают очень быстро, а иногда - мгновенно. В реакциях органической химии обычно участвуют молекулы, при этом разрываются одни ковалентные связи и образуются новые. Эти реакции протекают значительно медленнее, чем ионные, и для их успешного осуществления часто необходимы жесткие условия: повышенная температура, повышенное давление и катализаторы. В отличие от неорганических, органические реакции редко приводят к высокому выходу продукта (более 80 %), так как обычно протекает не одна, а несколько реакций. Поэтому в органической химии используются не химические уравнения, а схемы реакций, в которых обычно не приводятся стехиометрические соотношения между участниками, но указываются условия проведения реакции. Например, реакция этилена с водой, протекающая при повышенной температуре, повышенном давлении и в присутствии кислотного катализатора, записывается так:
![]()
В ходе большинства биохимических реакций изменению подвергается не вся молекула органического соединения, как это обычно бывает с неорганическими веществами, а только ее часть, которая называется реакционным центром. Реакционные центры в зависимости от природы и структуры имеют разную степень сродства к атакующим частицам, и их можно подразделять в зависимости от типа органической реакции.
Реакции в органической химии принято классифицировать по механизму их протекания и по конечному результату химического превращения. По механизму протекания реакции делятся на гетеролитические (электрофильно-нуклеофильные) и гемолитические (свободнорадикалъные). Поскольку названия «электрофильно-нуклеофильные» или «свободнорадикалъные» указывают на характер реагирующих частиц, то они используются в учебнике для харатеристики механизма реакции.
Электрофильно-нуклеофильные
реакции сопровождаются гетеролизом
полярной ковалентной связи между
фрагментами
![]() причем так, что ее общая электронная
пара сильно смесмещается к одному
фрагменту молекулы
причем так, что ее общая электронная
пара сильно смесмещается к одному
фрагменту молекулы![]() ,
превращая его в нуклеофил,
а
у другого фрагмента возникает дефицит
электронов
,
превращая его в нуклеофил,
а
у другого фрагмента возникает дефицит
электронов![]() ,
превращая его в электрофил:
,
превращая его в электрофил:
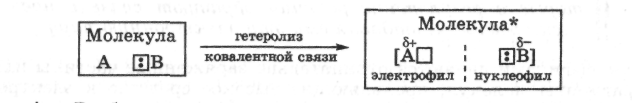
где А и В обозначают атомы или группы атомов, связанные полярной ковалентной связью. При полном гетеролизе связь разрывается с образованием катиона А+ — сильного электрофила — и аниона В- - сильного нуклеофила. Процесс гетеролиза ковалентной связи можно рассматривать как расщепление этой связи по донорно-акцепторному механизму.
Гетеролиз ковалентной связи происходит и в молекуле субстрата, и в молекуле реагента. Результатом электрофильной реакции является взаимодействие между фрагментами реагента и субстрата, проявляющими противоположные свойства.
Электрофилами называются частицы или фрагменты молекул, содержащие свободную, доступную орбиталь и имеющие недостаток электронной плотности, которые в результате реакции образуют связь с новым нуклео-филом, акцептируя у него оба электрона на свою вакантную орбиталь.
Э лектрофилами
являются положительно заряженные
частицы или фрагменты молекул, проявляющие
высокое сродство к электронной паре
нуклеофила:
лектрофилами
являются положительно заряженные
частицы или фрагменты молекул, проявляющие
высокое сродство к электронной паре
нуклеофила:
В электрофильно-нуклеофильных реакциях электрофил выступает акцептором электронной пары нуклеофила. К электрофилам также относятся все кислоты (доноры протона) при кислотно-основном взаимодействии, все окислители (акцепторы электронов) при окислительно-восстановительном взаимодействии и все комплексоообразователи (акцепторы электронов) в реакциях комплексообразования.
Нуклеофилами называются частицы или фрагменты молекул, содержащие подвижную электронную пару, которые в результате реакции образуют связь с новым электрофилом, отдавая ему эту электронную пару.
Н уклеофилами
являются отрицательно заряженные
частицы или фрагменты молекул, проявляющие
высокое сродство к электрофилу:
уклеофилами
являются отрицательно заряженные
частицы или фрагменты молекул, проявляющие
высокое сродство к электрофилу:
В электрофильно-нуклеофильных реакциях
нуклеофил выступает донором электронной
пары. К нуклеофилам также относятся
все основания при кислотно-основном
взаимодействии, все восстановители
при окислительно-восстановительном
взаимодействии и все лиганды в реакциях
комплексообразования.
электрофильно-нуклеофильных реакциях
нуклеофил выступает донором электронной
пары. К нуклеофилам также относятся
все основания при кислотно-основном
взаимодействии, все восстановители
при окислительно-восстановительном
взаимодействии и все лиганды в реакциях
комплексообразования.
Таким образом, используемые в органической химии понятия электрофил и нуклеофил имеют более широкий смысл, чем понятия кислота и основание, окислитель и восстановитель, ком-плексообразователь и лиганд, используемые в неорганической химии. Однако суть электрофильно-нуклеофильных реакций, подобно кислотно-основным, окислительно-восстановительным и реакциям комплексообразования, также заключается в донорно-акцепторном взаимодействии компонентов с противоположными свойствами.
Электрофильно-нуклеофильные свойства органических соединений проявляются прежде всего в их способности вступать в реакции: кислотно-основные, окислительно-восстановительные и комплексообразования. Органические соединения вступают также и в другие электрофильно-нуклеофильные реакции, которые нельзя отнести к вышеуказанным. В основном именно для этих реакций в данном учебнике будет использоваться термин «электро-фильно-нуклеофильная реакция».
Электрофилы и нуклеофилы характеризуются различной поляризуемостью и качественно подразделяются (разд. 2.1.3) на жесткие (низкая поляризуемость) и мягкие (высокая поляризуемость).
Жесткие электрофилы имеют сравнительно большой положительный заряд, а их свободная орбиталь, на которую перейдет электронная пара нуклеофила, имеет низкий уровень энергии. Жесткими электрофилами являются:
![]()
Жесткие нуклеофилы хорошо удерживают свою электронную пару, поскольку ее орбиталь расположена близко к ядрам атомов и имеет низкий уровень энергии. Донорными атомами в жестких нуклеофилах могут быть кислород, азот, хлор, фтор. Жесткими нуклеофилами являются:
![]()
Жесткие нуклеофилы трудно окисляются.
Мягкие электрофилы содержат акцепторные атомы большого размера с невысокой электроотрицательностью и с малым положительным зарядом. Их свободная орбиталь, принимающая электронную пару нуклеофила, имеет высокий уровень энергии. Мягкими электрофилами являются:
![]()
Мягкие нуклеофилы плохо удерживают свою электронную пару, поскольку ее орбиталь удалена от ядер атомов и имеет высокий уровень энергии. Донорными атомами в мягких нуклеофилах выступают атомы серы, иода и углерода.
Мягкими нуклеофилами являются:
![]()
Мягкие нуклеофилы довольно легко окисляются. Существуют электрофилы и нуклеофилы, которые занимают промежуточное положение.
![]()
В соответствии с принципом Пирсона более стабильная связь образуется при взаимодействии жесткого электрофила с жестким нуклеофилом или мягкого электрофила с мягким нуклеофилом. На основе этого принципа можно качественно оценить реакционную способность при взаимодействии нуклеофилов и электрофилов различного типа.
В органической химии электрофильно-нуклеофильные реакции принято называть по характеру частицы, которой реагент атакует субстрат. Этот выбор можно объяснить тем, что реагент обычно является более простой молекулой, в которой проще определить состав электрофильного и нуклеофильного фрагмента и их активность, а следовательно, и характер атакующей частицы.
Нуклеофильной называется реакция, при которой реагент атакует субстрат своим нуклеофилом; она обозначается индексом N (nucleophile).
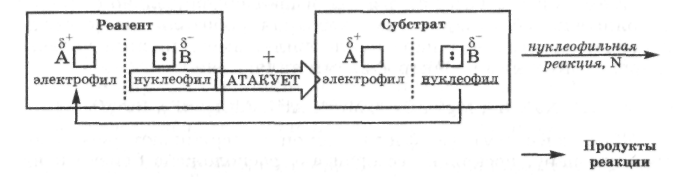
В нуклеофильных реакциях реагент принято называть нуклеофилом.
В органической химии нуклеофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный положительный заряд.
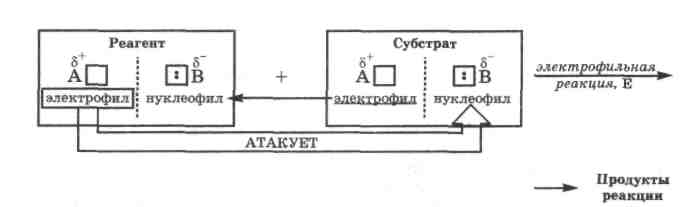 Электрофильной
называется
реакция, при которой реагент атакует
субстрат своим электрофилом; она
обозначается индексом Е
(electrophile).
Электрофильной
называется
реакция, при которой реагент атакует
субстрат своим электрофилом; она
обозначается индексом Е
(electrophile).
В электрофильных реакциях реагент принято называть электрофилом. В органической химии электрофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный отрицательный заряд.
В действительности механизм и результат любой электрофильно-нуклеофильной реакции определяется не только свойствами реагента, но и свойствами субстрата, образующихся продуктов реакции, растворителя и условиями ее проведения. Поэтому разделение электрофильно-нуклеофильных реакций на нуклеофильные и электрофильные только по свойствам реагента носит условный характер. Кроме того, как видно из приведенных схем, в этих реакциях всегда взаимодействуют между собой электрофилы и нуклеофилы, содержащиеся в субстрате и реагенте. Во многих реакциях лишь условно один компонент может считаться субстратом, а другой - реагентом.
Свободнорадикальные реакции. Гомолитический распад характерен для неполярной или малополярной связи. Он сопровождается образованием свободных радикалов - частиц с неспаренным электроном (разд. 5.2.1).
![]()
Гомолиз
ковалентной связи можно рассматривать
как расщепление этой связи по обменному
механизму. Для осуществления гомолиза
связи необходима энергия (теплота,
свет), достаточная для того, чтобы
разорвать эту связь. Наличие неспаренного
электрона является причиной малой
стабильности свободных радикалов
(время жизни в большинстве случаев
составляет доли секунды) и высокой
реакционной способности в свободнорадикальных
реакциях. Присутствие
в системе свободного радикала
![]() может
приводить к образованию новых радикалов
вследствие его взаимодействия с
имеющимися молекулами:
может
приводить к образованию новых радикалов
вследствие его взаимодействия с
имеющимися молекулами:
![]()
Свободнорадикальные реакции сопровождаются взаимодействием свободных радикалов с молекулами или между собой с образованием новых свободных радикалов (зарождение или развитие цепи) или только молекул (обрыв цепи).
Для свободнорадикальных реакций характерен цепной механизм, который включает три стадии: зарождение, развитие и обрыв цепи (разд. 5.4). Эти реакции прекращаются при исчезновении в системе свободных радикалов. Свободнорадикальные реакции обозначаются индексом R (radical).
Радикальные частицы в зависимости от их сродства к электрону могут и принимать электроны (т. е. быть окислителями), и отдавать электроны (т. е. быть восстановителями). При этом сродство радикала к электрону определяется не только его свойствами, но и свойствами его партнера по реакции. Особенности процессов свободнорадикального окисления-восстановления, протекающих в организме, были рассмотрены в разд. 9.3.9.
В реакциях комплексообразования радикалами могут быть и комплексообразователь, и лиганды. В случае комплексов с переносом заряда радикалообразование может происходить внутри комплекса за счет внутримолекулярного окисления-восстановления между комплексообразователем и лигандом (разд. 17.4).
Образование радикалов легче всего происходит при гомолизе неполярных простых связей между атомами одного и того же элемента:
![]()
При гомолизе малополярной связи С—Н образуются алкильные радикалы, в которых неспаренный электрон находится у атома углерода. Относительная устойчивость этих радикалов зависит от типа замещения атома углерода, несущего неспаренный электрон, и растет в ряду: *СН3 < *-CI2R < *СHR2 < *CR3. Это объясняется положительным индуктивным эффектом алкильных групп, который, повышая электронную плотность на атоме углерода, способствует стабилизации радикала.
Стабильность свободных радикалов существенно возрастает, когда имеется возможность делокализации неспаренного электрона за счет π-электронов соседних кратных связей. Это особенно наглядно наблюдается в аллильном и бензильном радикалах:
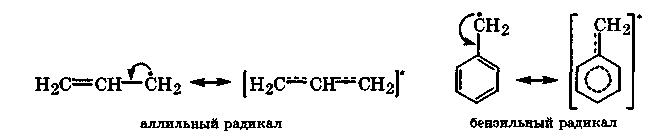
В ходе ознакомления с возможными механизмами реакций в молекулах субстрата и реагента следует различать реакционные центры по их характеру: нуклеофильные, электрофильные и радикальные.
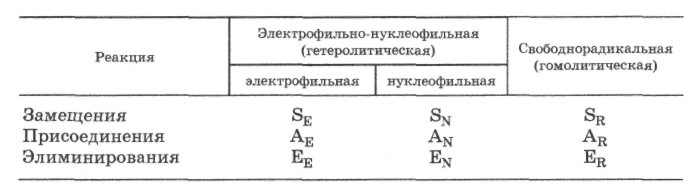
По конечному результату химического превращения простейшие органические реакции классифицируются на реакции: замещения, присоединения, элиминирования (отщепления) и перегруппировки.
Реакции замещения. Под замещением понимают замену атома или группы на другой атом или группу. В реакции замещения всегда образуются два различных продукта. Этот тип реакций обозначается символом S (substitution).
К реакциям замещения относятся: галогенирование и нитрование алканов (разд. 16.1), этерификация и алкилирование карбоновых кислот (разд. 19.2.3), а также многочисленные реакции взаимодействия простых полярных молекул (Н20, NH3, НГал) с эфирами, спиртами и галогенпроизводными (разд. 17.3, 17.5, 19.2.3).
Реакции присоединения. Под присоединением понимают введение атомов или групп в молекулу непредельного соединения, сопровождаемое разрывом π-связей. При этом двойные связи превращаются в ординарные, а тройные связи - в двойные или ординарные (разд. 16.2). Этот тип реакций обозначается символом A (addition).
Реакции элиминирования (отщепления). Под элиминированием понимают отщепление атомов или групп от органической молекулы с образованием кратной связи. Поэтому реакции элиминирования обратны реакциям присоединения. Этот тип реакции обозначается символом Е (elimination).
Каждая из органических реакций замещения (S), присоединения (А) или элиминирования (Е) может быть электрофильной (Е), нуклеофильной (N) или радикальной (R). Таким образом, в органической химии выделяют девять типовых реакций, обозначаемых символами S, А или Е с индексами R, N или Е:
П![]() риведенные
типы органических реакций следует
считать модельными, так как они не всегда
реализуются в чистом виде. Так, например,
замещение и элиминирование могут
протекать одновременно:
риведенные
типы органических реакций следует
считать модельными, так как они не всегда
реализуются в чистом виде. Так, например,
замещение и элиминирование могут
протекать одновременно:
Перегруппировки. В процессе перегруппировки происходит перемещение (миграция) одних атомов или групп ют одного фрагмента молекулы к другому без изменения ее брутто-формулы. Перегруппировки органических соединений происходят обычно в присутствии катализатора и сопровождаются окислительно-восстановительной дисмутацией атомов углерода:
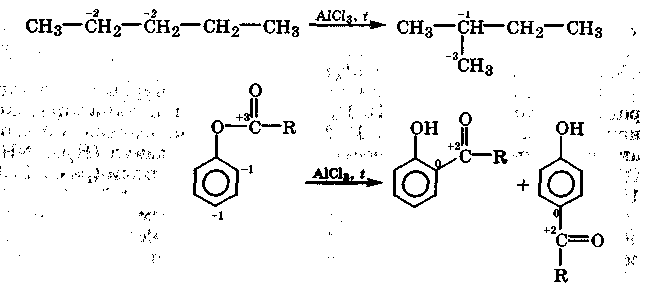
При дальнейшем знакомстве с конкретными классами органических соединений нами будут рассматриваться следующие их химические свойства: кислотно-основные, комплексообразующие, окислительно-восстановительные, электрофильно-нуклеофильные, а также способность к свободнорадикальному взаимодействию. Особое внимание будет уделено особенностям протекания рассматриваемых реакций в биологических системах
