- •Оглавление
- •Глава 1 16
- •Глава 2 химическая связь 33
- •Глава 3 54
- •Глава 4 82
- •Глава 5 110
- •Глава 6 141
- •Глава 7 173
- •Глава 8 196
- •Глава 9 234
- •Глава 10 комплексные соединения и их свойства 272
- •Глава 11 297
- •Глава 12 316
- •Глава 13 377
- •Глава 14 400
- •Глава 15 основные понятия органической химии 419
- •Глава 16 445
- •Глава 17 474
- •Глава 18 499
- •Глава 19 518
- •Глава 20 562
- •Глава 21 аминокислоты, пептиды и белки 578
- •Глава 22 620
- •Глава 23 651
- •Глава 24 692
- •Глава 25 709
- •Глава 26 740
- •Глава 27 771
- •От автора
- •Глава 1 строение атома, периодический закон и периодическая система элементов д. И. Менделеева
- •1.1. Строение атома
- •1.1.1. Квантовые числа
- •1.1.2. Принципы заполнения атомных орбиталей электронами
- •1.2. Периодический закон и периодическая система элементов д. И. Менделеева
- •1.3. Основные характеристики атомов элементов
- •1.3.1. Радиус атома
- •1.3.2. Энергия ионизации
- •1.3.3. Энергия сродства к электрону
- •1.3.4. Относительная электроотрицательность
- •Глава 2 химическая связь
- •2.1. Ковалентная связь
- •2.1.1. И молекулярные орбитали
- •2.1.2. Механизмы возникновения ковалентной связи
- •2.1.3. Особенности ковалентной связи
- •2.2. Ионная связь
- •2.3. Металлическая связь
- •Глава 3 межмолекулярные взаимодействия и агрегатное состояние вещества
- •3.1. Межмолекулярные взаимодействия
- •3.2. Агрегатное состояние вещества
- •3.2.1. Твердое состояние
- •3.2.2. Жидкое состояние
- •3.2.3. Жидкокристаллическое состояние
- •3.2.4. Паро- и газообразное состояния
- •Глава 4 основы химической термодинамики и биоэнергетики
- •4.1. Основные понятия термодинамики
- •4.2. Первый закон термодинамики
- •4.3. Понятие о самопроизвольных процессах.
- •4.4. Второй закон термодинамики. Энергия гиббса
- •4.5. Принцип энергетического сопряжения биохимических реакций
- •Г лава 5 основы кинетики биохимических реакций и химического равновесия
- •5.1. Основные понятия и терминология раздела
- •5.2. Факторы, влияющие на скорость гомогенных реакций
- •5.2.1. Влияние природы реагирующих веществ
- •5.2.2. Влияние концентрации реагентов.
- •5.2.3. Влияние температуры. Энергия активации
- •5.2.4. Влияние катализатора
- •5.3. Особенности кинетики гетерогенных реакций
- •5.4. Особенности кинетики цепных реакций
- •5.5. Химическое равновесие
- •5.5.1. Смещение химического равновесия
- •5.6. Ферментативный катализ и его особенности
- •5.7. Автоколебательные биохимические процессы
- •Г лава 6 растворы и их коллигативные свойства
- •6.1. Вода как растворитель и ее роль в жизнедеятельности организма
- •6.2. Термодинамика процесса растворения
- •6.З. Способы выражения концентрации растворов
- •6.4. Коллигативные свойства растворов
- •6.4.1. Диффузия
- •6.4.2. Осмос. Осмотическое и онкотическое давление
- •6.4.3. Давление насыщенного пара над раствором
- •6.4.4. Температура кипения и замерзания раствора
- •Глава 7 растворы электролитов и ионные равновесия
- •7.1. Электролитическая диссоциация
- •7.2. Равновесие в растворах слабых электролитов
- •7.2.1. Влияние общего иона и противоиона на равновесие
- •7.2.2. Взаимосвязь константы диссоциации и степени диссоциации
- •7.3. Особенности растворов сильных электролитов. Ионная сила раствора
- •7.4. Электролитическая диссоциация и ионное произведение воды
- •7.5. Водородный и гидроксильный показатели (рН и рОн)
- •7.6. Физико-химические основы водно-электролитного баланса в организме
- •Г лава 8 теория кислот и оснований и протолитические равновесия
- •8.1. Протолитическая теория кислот и оснований
- •8.2. Кислотно-основные свойства а-аминокислот
- •8.3. Важнейшие кислотно-основные реакции
- •8.3.1. Гидролиз солей
- •8.3.2. Реакции нейтрализации
- •8.3.3. Общая, активная и потенциальная кислотность растворов
- •8.4. Протолитический баланс. Буферные растворы и их свойства
- •8.5. Буферные системы организма, их взаимодействие, явления ацидоза и алкалоза
- •9.1. Основные понятия и факторы, влияющие на протекание окислительно-восстановительных реакций
- •9.2. Направление протекания окислительно-восстановительных реакций
- •9.3. Особенности биохимических окислительно-восстановительных процессов в организмах
- •9.3.1. Степень окисления углерода в органических соединениях
- •9.3.2. Биохимические реакции внутри- и межмолекулярной окислительно-восстановительной дисмутации за счет атомов углерода
- •9.3.3. Окислительно-восстановительные превращения кофакторов и коферментов оксидоредуктаз
- •9.3.4. Электронотранспортные цепи
- •9.3.5. Дегидрогеназное окисление-восстановление
- •9.3.6. Окислительное фосфорилирование
- •9.3.7. Фотофосфорилирование
- •9.3.8. Оксигеназное окисление-восстановление
- •9.3.9. Свободнорадикальное окисление и антиоксидантная система организма
- •9.4. Использование окислителей и восстановителей в медико-санитарной практике
- •Глава 10 комплексные соединения и их свойства
- •10.1. Основные понятия и терминология
- •10.2. Химическая связь в комплексных соединениях и особенности их строения
- •10.3. Химические свойства комплексных соединений
- •10.4. Медико-биологическая роль комплексных соединений
- •10.5. Металлолигандный баланс и его нарушения
- •10.6. Комплексонометрия
- •Глава 11 гетерогенные процессы и равновесия в растворах
- •11.1. Основные понятия и теоретические основы
- •11.2. Гетерогенные равновесия в растворах, связанные с процессом кристаллизации
- •11.3. Гетерогенные равновесия в растворах, связанные с процессом расслоения
- •11.4. Гетерогенные равновесия в живых системах
- •Глава 12 химия элементов-органогенов
- •12.2. Строение, химические свойства и роль элементов-органогенов и их соединений в растительном и животном мире
- •12.2.1. Водород и его соединения
- •12.2.2. Углерод и его соединения
- •12.2.3. Азот и его соединения
- •12.2.4. Фосфор и его соединения
- •12.2.5. Кислород и его соединения
- •12.2.6. Сера и ее соединения
- •12.3. Строение и химические свойства галогенов и их соединений
- •Глава 13 химия ионов металлов жизни и их роль в растительном и животном мире
- •13.1. Химия ионов s-металлов в организме
- •13.1.1. Натрий и калий
- •13.1.2. Магний и кальций
- •13.2. Химия ионов d-металлов в организме
- •13.2.1. Марганец
- •13.2.2. Железо и кобальт
- •13.2.3. Медь
- •13.2.4. Цинк
- •13.2.5. Молибден
- •Глава 14 химия и анализ загрязнений окружающей среды
- •14.1. Химия загрязнений атмосферы
- •14.1.1. Токсический смог
- •14.1.2. Фотохимический смог
- •14.1.3. Кислотные дожди
- •14.1.4. Загрязнение атмосферы другими токсикантами
- •14.1.5. Разрушение озонового слоя
- •14.2. Методы анализа токсикантов и методы снижения их поступления в атмосферу
- •14.3. Загрязнение гидросферы. Понятие об общих показателях, характеризующих природные и сточные воды
- •Глава 15 основные понятия органической химии
- •15.1. Основы классификации и номенклатуры органических соединений
- •15.2. Пространственная структура биоорганических молекул и виды изомерии
- •15.3. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •15.4. Классификация органических реакций и их компонентов
- •Г лава 16 алифатические и ароматические углеводороды
- •16.1. Строение и реакционная способность алканов
- •16.2. Строение и реакционная способность ненасыщенных углеводородов: алкенов и диенов
- •16.3. Ароматические углеводороды (арены)
- •Глава 17 спирты, фенолы, простые эфиры, тиолы и сульфиды
- •17.2. Физико-химические свойства спиртов и фенолов
- •17.3. Химические свойства спиртов
- •17.4. Химические свойства фенолов
- •17.5. Простые эфиры
- •17.6. Тиолы и сульфиды
- •Г лава 18 альдегиды, кетоны и их производные
- •18.1. Строение, номенклатура и физико-химические свойства альдегидов и кетонов
- •18.2. Химические свойства альдегидов и кетонов
- •18.2.1. Кислотно-основные свойства
- •18.2.2. Электрофильно-нуклеофильные свойства
- •18.2.3. Окислительно-восстановительные свойства
- •18.2.4. Комплексообразующие свойства
- •18.3. Альдегиды и кетоны в окружающей среде
- •Г лава 19 карбоновые кислоты и их функциональные производные
- •19.2. Химические свойства предельных кислот и их производных
- •19.2.1. Кислотно-основные свойства
- •19.2.2. Карбоновые кислоты как ацилирующие реагенты
- •19.2.3. Производные карбоновых кислот, их свойства и взаимные превращения
- •19.2.4. Окислительно-восстановительные свойства карбоновых кислот и их производных
- •19.3. Особенности свойств замещенных карбоновых кислот и их производных
- •19.3.1. Дикарбоновые кислоты
- •19.3.2. Гидроксикарбоновые кислоты
- •19.3.3. Оксокарбоновые кислоты
- •19.3.4. Ненасыщенные карбоновые кислоты
- •19.4. Основные реакции метаболизма карбоновых кислот
- •19.4.1. Биосинтез жирных кислот
- •1 9.4.2. Биологическое окисление жирных кислот
- •19.4.3. Реакции цикла кребса
- •19.5. Кислоты ароматического ряда и их производные как лекарственные средства
- •Г лава 20 Липиды
- •20.1. Жиры и воски
- •20.2. Омыляемые сложные липиды
- •20.3. Неомыляемые липиды - низкомолекулярные биорегуляторы
- •Глава 21 аминокислоты, пептиды и белки
- •21.1. Строение, классификация и физико-химические свойства а-аминокислот
- •21.2. Химические свойства а-аминокислот
- •21.2.1. Кислотно-основные свойства и прототропная таутомерия
- •21.2.2. К0мплекс00бразующие свойства
- •21.2.3. Электрофильно-нуклеофильные свойства
- •21.2.4. Окислительно-восстановительные свойства
- •21.3. Структура и свойства пептидов
- •21.4. Структура и свойства белков
- •Глава 22 углеводы и полисахариды
- •22.1. Строение, изомерия и свойства моносахаридов
- •22.1.1. Химические свойства моносахаридов и их производных
- •22.1.2. Катаболизм глюкозы - гликолиз
- •22.3. Полисахариды, их структура и свойства
- •22.3.1. Гомополисахариды
- •22.3.2. Гетерополисахариды, протеогликаны, гликопротеины
- •Г лава 23 биологически важные азотсодержащие соединения
- •23.1. Электронные состояния атома азота в его соединениях и свойства этих соединений
- •23.2. Роль аммиака для живых организмов и пути его обезвреживания. Цикл мочевины и ее свойства
- •23.3. Азотсодержащие ароматические гетероциклические соединения
- •23.4. Нуклеозиды, нуклеотиды и нуклеиновые кислоты, их структура и свойства
- •Г лава 24 электрохимия. Электрическая проводимость растворов электролитов
- •24.1. Электрическая подвижность ионов в растворе
- •24.2. Удельная электрическая проводимость растворов электролитов
- •24.3. Молярная электрическая проводимость растворов электролитов
- •24.4. Закон независимого движения ионов в разбавленных растворах (закон кольрауша)
- •24.5. Кондуктометрические методы анализа
- •24.5.1. Кондуктометрическое титрование
- •24.6. Электрическая проводимость биологических объектов в норме и патологии
- •Г лава 25 межфазные электрические потенциалы, гальванические цепи, потенциометрия
- •25.1. Возникновение двойного электрического слоя и виды электрических потенциалов
- •25.2. Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение нернста
- •25.3. Восстановительный потенциал
- •25.4. Диффузионный потенциал
- •25.5. Мембранный потенциал
- •25.6. Потенциометрия
- •25.6.1. Хлорсеребряный электрод сравнения
- •25.6.2. Ионо- и молекулярноселективные электроды определения
- •25.6.3. Потенциометрическое титрование
- •Глава 26 физико-химические основы поверхностных явлений
- •26.1. Свободная поверхностная энергия
- •26.2. Сорбция и ее виды
- •26.3. Абсорбция
- •26.4. Адсорбция
- •26.4.1. Адсорбция на неподвижной поверхности раздела фаз
- •26.4.2. Молекулярная адсорбция из растворов на твердых адсорбентах
- •26.4.3. Адсорбция ионов из растворов
- •26.4.4. Ионообменная адсорбция
- •26.5. Адсорбция на подвижной поверхности раздела фаз
- •26.6. Поверхностно-активные вещества
- •26.7. Хроматография
- •Глава 27 физикохимия дисперсных систем
- •27.2. Лиофобные коллоидные растворы
- •27.2.1. Строение мицелл в лиофобных коллоидных растворах
- •27.2.2. Свойства лиофобных коллоидных растворов
- •27.2.3. Влияние высокомолекулярных соединений на устойчивость лиофобных коллоидов. Флокуляция
- •27.3. Лиофильные коллоидные растворы
- •27.3.1. Строение мицелл пав и вмс в водных коллоидных растворах в зависимости от их концентрации
- •27. 3. 2. Получение и свойства лиофильных коллоидных растворов
- •27.3.3. Моющее действие растворов пав
- •27.3.4. Особенности растворов биополимеров
- •27.4. Структурообразование в растворах вмс. Возникновение связнодисперсных систем и их свойства
- •27.5. Грубодисперсные системы
- •27.5.1. Суспензии
- •27.5.2. Эмульсии
- •27.5.3. Аэрозоли
- •27.6. Электрокинетические явления в дисперсных системах
- •27.7. Ткани организма - дисперсные системы
- •27.7.1. Строение и свойства межклеточных мембран
- •27.7.2. Кровь - сложная дисперсная система
- •Приложение 1 применение осмолярной и осмоляльной концентраций в практической медицине
15.2. Пространственная структура биоорганических молекул и виды изомерии
Многообразие органических соединений обусловлено в значительной мере явлением изомерии.
Изомерами называются соединения с одинаковым качественным и количественным составом, но отличающиеся последовательностью связывания атомов или расположением их в пространстве. Даже минимальные структурные различия между изомерами биомолекул приводят к заметным различиям в их физических и химических свойствах и очень сильно влияют на их биологическую активность. Возможны следующие типы изомерии: структурная и пространственная (стереоизомерия).
Структурная изомерия. Этот тип изомерии обусловлен различным взаимным расположением атомов в молекулах.
* Название сложных заместителей обычно заключается в скобки. Цифры в скобках относятся к нумерации боковой цепи, причем нумерация начинается с того атома углерода, который непосредственно связан с главной цепью.
При этом различают изомерию углеродного скелета и изомерию положения.
И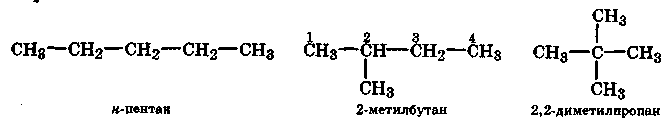 зомерия
углеродного скелета
обусловлена способностью атомов
углерода образовывать как прямые
(нормальные) углеродные
цепи, так и разветвленные
цепи
с различной степенью разветвления.
Например, у пентана имеются три изомера:
зомерия
углеродного скелета
обусловлена способностью атомов
углерода образовывать как прямые
(нормальные) углеродные
цепи, так и разветвленные
цепи
с различной степенью разветвления.
Например, у пентана имеются три изомера:
Изомерия положения обусловлена различным положением заместителей, функциональных групп или кратных связей в молекулах органических соединений одинакового состава. Например:
Для рассмотренных видов структурной изомерии взаимное превращение изомеров друг в друга при обычных условиях отсутствует. Особым случаем структурной изомерии является таутомерия.
Т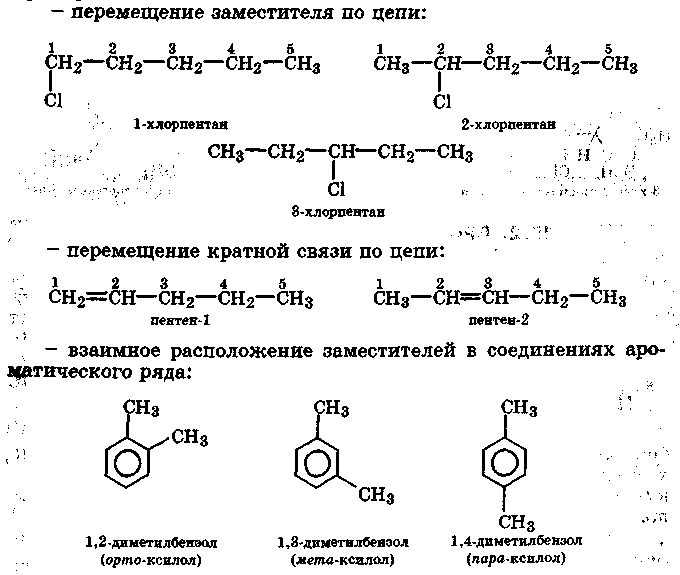 аутомерия
-
явление равновесной динамической
изомерии, при которой происходит
быстрое обратимое самопроизвольное
превращение структурных изомеров,
сопровождаемое миграцией подвижной
группы между двумя или несколькими
центрами в молекуле.
аутомерия
-
явление равновесной динамической
изомерии, при которой происходит
быстрое обратимое самопроизвольное
превращение структурных изомеров,
сопровождаемое миграцией подвижной
группы между двумя или несколькими
центрами в молекуле.
Таутомерия свойственна соединениям, в молекулах которых имеются разные реакционноспособные группировки. Например, в молекулах природных аминокислот имеются две группы с противоположными свойствами: аминогруппа - основные свойства - и карбоксильная группа — кислотные свойства (разд. 8.2). Между этими группами осуществляется перенос протона, и поэтому такой вид изомерии называется прототропной таутомерией. Для обозначения таутомерного равновесия в учебнике использованы пунктирные стрелки.
![]()
Для всех природных аминокислот в кристаллическом состоянии и в водных растворах наиболее устойчив таутомер, имеющий структуру биполярного иона. Его содержание превышает 99,9%. Поэтому в учебнике все природные а-аминокислоты всегда изображены в виде таутоМера с биполярно-ионной структурой.
Прототропная таутомерия бывает разных видов: кетоенольная (разд. 18.2.3), лактим-лактамная (разд. 23.2) и др. Кроме прототропной таутомерии в природных соединениях наблюдается кольчато-цепная таутомерия, которая особенно характерна для углеводов (разд. 22.1).
Пространственная изомерия (стереоизомерия). Пространственная изомерия в молекуле обусловлена различным пространственным расположением атомов при одинаковом порядке их связывания.
Стереоизомеры - изомеры, имеющие одинаковую последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве.
Стереоизомеры могут различаться конформацией и конфигурацией.
онформациями молекулы называются различные ее пространственные формы, возникающие в результате вращения атомов или групп вокруг ординарных связей.
Стереоизомеры, различие между которыми обусловлено поворотом отдельных участков молекулы вокруг ординарных связей, называются конформерами. Наиболее стабильными и энергетически выгодными конформерами являются те, в которых между несвязанными атомами или их группами межатомное отталкивание наименьшее; их называют заторможенными конформерами. Конформеры, где атомы или их группы расположены близко друг к другу, являются нестабильными и называются заслоненными. Фактически различные конформеры находятся в динамическом равновесии, и возможность перехода одного конформера в другой определяется энергетическим барьером вращения, который составляет 10-50 кДж/моль. Поскольку энергетический барьер вращения невелик, то переход из одной конформаций в другую осуществляется легко, и поэтому выделить конформеры в качестве устойчивых изомеров нельзя. Внутреннее вращение вокруг простых связей ограничивается или даже затормаживается в случае высокого энергетического барьера вращения.
Для изображения результатов вращения по связи С—С удобно пользоваться проекционными формулами Ньюмена (1955). Эти проекции получают, рассматривая молекулу вдоль С—С связи, вокруг которой происходит вращение. Ближайший к наблюдателю атом углерода обозначается точкой пересечения его связей
![]() ,
а удаленный от наблюдателя атом углерода
и его связи -окружностью с линиями
,
а удаленный от наблюдателя атом углерода
и его связи -окружностью с линиями![]() .
На рис. 15.1 при помощи проекций Ньюмена
и стереохимических формул изображено
вращение метильных групп вокруг
связи С—С в молекуле этана.
.
На рис. 15.1 при помощи проекций Ньюмена
и стереохимических формул изображено
вращение метильных групп вокруг
связи С—С в молекуле этана.
В длинных углеродных цепях вращение возможно вокруг нескольких С—С связей. Поэтому вся цепь может принимать разнообразные геометрические формы, среди которых зигзагообразная конформация наиболее устойчива. Именно эта кон-формация характерна для гидрофобных фрагментов природных жирных кислот и их производных.
В циклических соединениях вращение вокруг ординарных связей ограничено, что приводит к возникновению определенных
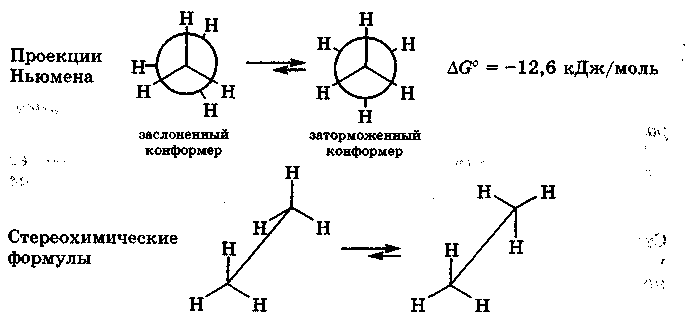
Рис. 15.1. Проекции Ньюмена и стереохимические формулы заслоненного и заторможенного конформеров молекулы этана
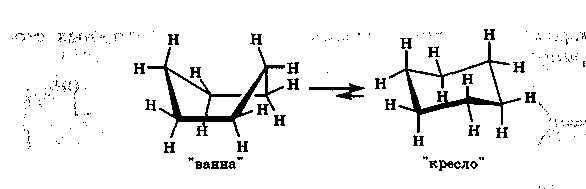
Рис. 15.2. Циклогексан в конформациях ванны и кресла
конформаций. В природных соединениях особенно часто встречается фрагмент, содержащий циклогексановый цикл. Атомы углерода в этом цикле находятся в состоянии sр3-гибридизации, и, следовательно, их химические связи не лежат в одной плоскости. У циклогексана возникают два конформера типа кресла и ванны (рис. 15.2). В конформаций «кресло», в отличие от конформации «ванна», не имеется заслоненных положений атомов водорода, поэтому она термодинамически более устойчива. При комнатной температуре молекулы циклогексана существуют практически только в конформаций кресла.
Производные циклогексана, содержащие два и более объемных заместителя, имеют такую конформацию, в которой эти заместители располагаются наиболее удаленно друг от друга, например по разные стороны от плоскости цикла.
Биологическое действие многих лекарственных веществ и биорегуляторов (гормоны, витамины, антибиотики и др.) тесно связано с пространственным строением их молекул. Для Наиболее полного связывания этих веществ рецепторами клетки они должны иметь определенную конформацию. Изменение конформаций, как правило, снижает степень связывания и ослабляет биологическое действие. О конформаций белков, полисахаридов и нуклеиновых кислот речь пойдет в разд. 21.4, 22.3 и 23.3.
Стереоизомеры могут отличаться не только конформацией, но и конфигурацией.
Конфигурациями молекул называются разные пространственные расположения атомов или групп, которые не могут быть переведены друг в друга простым вращением вокруг связей.
В отличие от конформационных изомеров, которые легко превращаются друг в друга, конфигурационные изомеры устойчивы. Различают два вида конфигурационной изомерии: геометрическую, или цис-транс-изомерию, и оптическую изомерию.
Геометрическая изомерия. Стереоизомеры, отличающиеся друг от друга расположением заместителей по отношению к плоскости двойной связи или цикла, называются геометрическими изомерами. Изомер, содержащий одинаковые заместители по одну сторону от плоскости связи (цикла), называется цис-изомером, а если они расположены с противоположных сторон — транс-изомером:

цис-транс-Изомеры отличаются друг от друга не только физическими и химическими свойствами, но и биологической активностью, на что уже было указано в разд. 10.2.
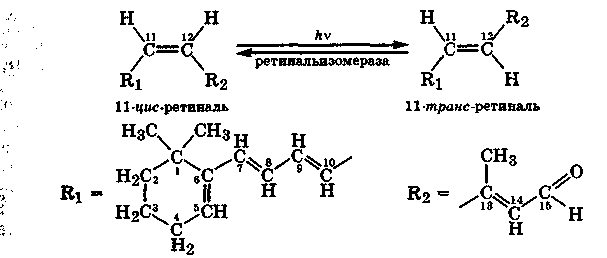
Геометрическая изомерия часто встречается среди природных соединений, в частности сопряженных полиенов. Так, ретиналь-активная форма витамина А представлена в организме в виде транс-изомера, который под действием фермента ретинальизомеразы превращается в цис-ретиналь. При поглощении света протекает фотоизомеризация цис-ретиналя обратно в транс-изомер. Эта реакция лежит в основе возбуждения палочек сетчатки глаза.
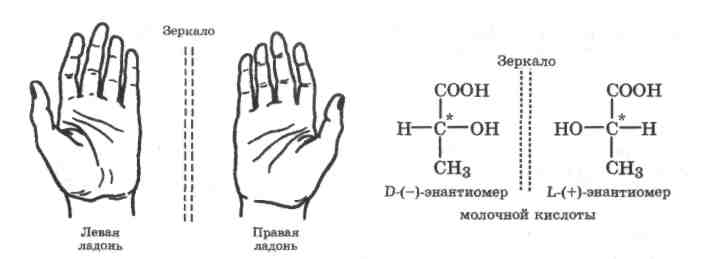
Оптическая изомерия. Она характерна для несимметричных соединений, у которых в молекуле имеется атом углерода в состоянии sр3-гибридизации, связанный с четырьмя различными атомами или группами. Такой атом углерода называется асимметрическим и обозначается С*. Оптические изомеры отличаются друг от друга как несимметричный предмет от своего изображения в зеркале, и их нельзя перевести друг в друга путем внутреннего вращения (рис. 15.3). Другими словами, изомеры L и D относятся друг к другу как левая рука к правой и они несовместимы. Это свойство называется хиральность, а асимметрический атом - хиральным центром. В большинстве случаев наличие хирального атома в молекуле уже служит указанием на ее хиральность.
У оптических изомеров физические и химические свойства идентичны, но по отношению к шюскополяризованному свету они ведут себя по-разному. Один из изомеров называется левовращающим, так как он поворачивает плоскость поляризации света на определенный угол влево (т. е. против часовой стрелки) и обозначается (—), а другой изомер - вправо на такой же угол и называется правовращающим (+). Оптические изомеры называют также оптическими антиподами или энантиомерами. Эквимолярная смесь энантиомеров называется рацематом. Рацематы оптически неактивны. Таким образом, энантиомеры одного и того же вещества не могут непосредственно перейти друг в друга, и поэтому оптическая изомерия не может иметь равновесный характер.
Хиральность характерна для всех природных аминокислот, кроме глицина, поскольку их молекулы содержат асимметричный атом углерода, вокруг которого располагаются четыре различных
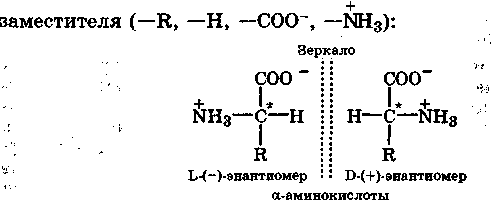
Оптические изомеры а-аминокислот в соответствии с их истинной конфигурацией обозначаются буквами L и D, а по новой системе - S и R соответственно. Природные а-аминокислоты в подавляющем большинстве относятся к L(S))-энантиомерам левовращающим (-). Использование для построения белков в организме человека только L-энантиомеров имеет важнейшее значение для формирования пространственной структуры белков. С этим непосредственно связана стереоспецифичность действия ферментов. Молекулы ферментов хиральны и вступают во взаимодействие только с теми субстратами, которые также имеют определенную конфигурацию. Поэтому биологической активностью обычно обладает лишь один стереоизомер, а другие значительно менее активны или вообще неактивны.
Рис.
15.3. Хиральные объекты