
- •Оглавление
- •Глава 1 16
- •Глава 2 химическая связь 33
- •Глава 3 54
- •Глава 4 82
- •Глава 5 110
- •Глава 6 141
- •Глава 7 173
- •Глава 8 196
- •Глава 9 234
- •Глава 10 комплексные соединения и их свойства 272
- •Глава 11 297
- •Глава 12 316
- •Глава 13 377
- •Глава 14 400
- •Глава 15 основные понятия органической химии 419
- •Глава 16 445
- •Глава 17 474
- •Глава 18 499
- •Глава 19 518
- •Глава 20 562
- •Глава 21 аминокислоты, пептиды и белки 578
- •Глава 22 620
- •Глава 23 651
- •Глава 24 692
- •Глава 25 709
- •Глава 26 740
- •Глава 27 771
- •От автора
- •Глава 1 строение атома, периодический закон и периодическая система элементов д. И. Менделеева
- •1.1. Строение атома
- •1.1.1. Квантовые числа
- •1.1.2. Принципы заполнения атомных орбиталей электронами
- •1.2. Периодический закон и периодическая система элементов д. И. Менделеева
- •1.3. Основные характеристики атомов элементов
- •1.3.1. Радиус атома
- •1.3.2. Энергия ионизации
- •1.3.3. Энергия сродства к электрону
- •1.3.4. Относительная электроотрицательность
- •Глава 2 химическая связь
- •2.1. Ковалентная связь
- •2.1.1. И молекулярные орбитали
- •2.1.2. Механизмы возникновения ковалентной связи
- •2.1.3. Особенности ковалентной связи
- •2.2. Ионная связь
- •2.3. Металлическая связь
- •Глава 3 межмолекулярные взаимодействия и агрегатное состояние вещества
- •3.1. Межмолекулярные взаимодействия
- •3.2. Агрегатное состояние вещества
- •3.2.1. Твердое состояние
- •3.2.2. Жидкое состояние
- •3.2.3. Жидкокристаллическое состояние
- •3.2.4. Паро- и газообразное состояния
- •Глава 4 основы химической термодинамики и биоэнергетики
- •4.1. Основные понятия термодинамики
- •4.2. Первый закон термодинамики
- •4.3. Понятие о самопроизвольных процессах.
- •4.4. Второй закон термодинамики. Энергия гиббса
- •4.5. Принцип энергетического сопряжения биохимических реакций
- •Г лава 5 основы кинетики биохимических реакций и химического равновесия
- •5.1. Основные понятия и терминология раздела
- •5.2. Факторы, влияющие на скорость гомогенных реакций
- •5.2.1. Влияние природы реагирующих веществ
- •5.2.2. Влияние концентрации реагентов.
- •5.2.3. Влияние температуры. Энергия активации
- •5.2.4. Влияние катализатора
- •5.3. Особенности кинетики гетерогенных реакций
- •5.4. Особенности кинетики цепных реакций
- •5.5. Химическое равновесие
- •5.5.1. Смещение химического равновесия
- •5.6. Ферментативный катализ и его особенности
- •5.7. Автоколебательные биохимические процессы
- •Г лава 6 растворы и их коллигативные свойства
- •6.1. Вода как растворитель и ее роль в жизнедеятельности организма
- •6.2. Термодинамика процесса растворения
- •6.З. Способы выражения концентрации растворов
- •6.4. Коллигативные свойства растворов
- •6.4.1. Диффузия
- •6.4.2. Осмос. Осмотическое и онкотическое давление
- •6.4.3. Давление насыщенного пара над раствором
- •6.4.4. Температура кипения и замерзания раствора
- •Глава 7 растворы электролитов и ионные равновесия
- •7.1. Электролитическая диссоциация
- •7.2. Равновесие в растворах слабых электролитов
- •7.2.1. Влияние общего иона и противоиона на равновесие
- •7.2.2. Взаимосвязь константы диссоциации и степени диссоциации
- •7.3. Особенности растворов сильных электролитов. Ионная сила раствора
- •7.4. Электролитическая диссоциация и ионное произведение воды
- •7.5. Водородный и гидроксильный показатели (рН и рОн)
- •7.6. Физико-химические основы водно-электролитного баланса в организме
- •Г лава 8 теория кислот и оснований и протолитические равновесия
- •8.1. Протолитическая теория кислот и оснований
- •8.2. Кислотно-основные свойства а-аминокислот
- •8.3. Важнейшие кислотно-основные реакции
- •8.3.1. Гидролиз солей
- •8.3.2. Реакции нейтрализации
- •8.3.3. Общая, активная и потенциальная кислотность растворов
- •8.4. Протолитический баланс. Буферные растворы и их свойства
- •8.5. Буферные системы организма, их взаимодействие, явления ацидоза и алкалоза
- •9.1. Основные понятия и факторы, влияющие на протекание окислительно-восстановительных реакций
- •9.2. Направление протекания окислительно-восстановительных реакций
- •9.3. Особенности биохимических окислительно-восстановительных процессов в организмах
- •9.3.1. Степень окисления углерода в органических соединениях
- •9.3.2. Биохимические реакции внутри- и межмолекулярной окислительно-восстановительной дисмутации за счет атомов углерода
- •9.3.3. Окислительно-восстановительные превращения кофакторов и коферментов оксидоредуктаз
- •9.3.4. Электронотранспортные цепи
- •9.3.5. Дегидрогеназное окисление-восстановление
- •9.3.6. Окислительное фосфорилирование
- •9.3.7. Фотофосфорилирование
- •9.3.8. Оксигеназное окисление-восстановление
- •9.3.9. Свободнорадикальное окисление и антиоксидантная система организма
- •9.4. Использование окислителей и восстановителей в медико-санитарной практике
- •Глава 10 комплексные соединения и их свойства
- •10.1. Основные понятия и терминология
- •10.2. Химическая связь в комплексных соединениях и особенности их строения
- •10.3. Химические свойства комплексных соединений
- •10.4. Медико-биологическая роль комплексных соединений
- •10.5. Металлолигандный баланс и его нарушения
- •10.6. Комплексонометрия
- •Глава 11 гетерогенные процессы и равновесия в растворах
- •11.1. Основные понятия и теоретические основы
- •11.2. Гетерогенные равновесия в растворах, связанные с процессом кристаллизации
- •11.3. Гетерогенные равновесия в растворах, связанные с процессом расслоения
- •11.4. Гетерогенные равновесия в живых системах
- •Глава 12 химия элементов-органогенов
- •12.2. Строение, химические свойства и роль элементов-органогенов и их соединений в растительном и животном мире
- •12.2.1. Водород и его соединения
- •12.2.2. Углерод и его соединения
- •12.2.3. Азот и его соединения
- •12.2.4. Фосфор и его соединения
- •12.2.5. Кислород и его соединения
- •12.2.6. Сера и ее соединения
- •12.3. Строение и химические свойства галогенов и их соединений
- •Глава 13 химия ионов металлов жизни и их роль в растительном и животном мире
- •13.1. Химия ионов s-металлов в организме
- •13.1.1. Натрий и калий
- •13.1.2. Магний и кальций
- •13.2. Химия ионов d-металлов в организме
- •13.2.1. Марганец
- •13.2.2. Железо и кобальт
- •13.2.3. Медь
- •13.2.4. Цинк
- •13.2.5. Молибден
- •Глава 14 химия и анализ загрязнений окружающей среды
- •14.1. Химия загрязнений атмосферы
- •14.1.1. Токсический смог
- •14.1.2. Фотохимический смог
- •14.1.3. Кислотные дожди
- •14.1.4. Загрязнение атмосферы другими токсикантами
- •14.1.5. Разрушение озонового слоя
- •14.2. Методы анализа токсикантов и методы снижения их поступления в атмосферу
- •14.3. Загрязнение гидросферы. Понятие об общих показателях, характеризующих природные и сточные воды
- •Глава 15 основные понятия органической химии
- •15.1. Основы классификации и номенклатуры органических соединений
- •15.2. Пространственная структура биоорганических молекул и виды изомерии
- •15.3. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •15.4. Классификация органических реакций и их компонентов
- •Г лава 16 алифатические и ароматические углеводороды
- •16.1. Строение и реакционная способность алканов
- •16.2. Строение и реакционная способность ненасыщенных углеводородов: алкенов и диенов
- •16.3. Ароматические углеводороды (арены)
- •Глава 17 спирты, фенолы, простые эфиры, тиолы и сульфиды
- •17.2. Физико-химические свойства спиртов и фенолов
- •17.3. Химические свойства спиртов
- •17.4. Химические свойства фенолов
- •17.5. Простые эфиры
- •17.6. Тиолы и сульфиды
- •Г лава 18 альдегиды, кетоны и их производные
- •18.1. Строение, номенклатура и физико-химические свойства альдегидов и кетонов
- •18.2. Химические свойства альдегидов и кетонов
- •18.2.1. Кислотно-основные свойства
- •18.2.2. Электрофильно-нуклеофильные свойства
- •18.2.3. Окислительно-восстановительные свойства
- •18.2.4. Комплексообразующие свойства
- •18.3. Альдегиды и кетоны в окружающей среде
- •Г лава 19 карбоновые кислоты и их функциональные производные
- •19.2. Химические свойства предельных кислот и их производных
- •19.2.1. Кислотно-основные свойства
- •19.2.2. Карбоновые кислоты как ацилирующие реагенты
- •19.2.3. Производные карбоновых кислот, их свойства и взаимные превращения
- •19.2.4. Окислительно-восстановительные свойства карбоновых кислот и их производных
- •19.3. Особенности свойств замещенных карбоновых кислот и их производных
- •19.3.1. Дикарбоновые кислоты
- •19.3.2. Гидроксикарбоновые кислоты
- •19.3.3. Оксокарбоновые кислоты
- •19.3.4. Ненасыщенные карбоновые кислоты
- •19.4. Основные реакции метаболизма карбоновых кислот
- •19.4.1. Биосинтез жирных кислот
- •1 9.4.2. Биологическое окисление жирных кислот
- •19.4.3. Реакции цикла кребса
- •19.5. Кислоты ароматического ряда и их производные как лекарственные средства
- •Г лава 20 Липиды
- •20.1. Жиры и воски
- •20.2. Омыляемые сложные липиды
- •20.3. Неомыляемые липиды - низкомолекулярные биорегуляторы
- •Глава 21 аминокислоты, пептиды и белки
- •21.1. Строение, классификация и физико-химические свойства а-аминокислот
- •21.2. Химические свойства а-аминокислот
- •21.2.1. Кислотно-основные свойства и прототропная таутомерия
- •21.2.2. К0мплекс00бразующие свойства
- •21.2.3. Электрофильно-нуклеофильные свойства
- •21.2.4. Окислительно-восстановительные свойства
- •21.3. Структура и свойства пептидов
- •21.4. Структура и свойства белков
- •Глава 22 углеводы и полисахариды
- •22.1. Строение, изомерия и свойства моносахаридов
- •22.1.1. Химические свойства моносахаридов и их производных
- •22.1.2. Катаболизм глюкозы - гликолиз
- •22.3. Полисахариды, их структура и свойства
- •22.3.1. Гомополисахариды
- •22.3.2. Гетерополисахариды, протеогликаны, гликопротеины
- •Г лава 23 биологически важные азотсодержащие соединения
- •23.1. Электронные состояния атома азота в его соединениях и свойства этих соединений
- •23.2. Роль аммиака для живых организмов и пути его обезвреживания. Цикл мочевины и ее свойства
- •23.3. Азотсодержащие ароматические гетероциклические соединения
- •23.4. Нуклеозиды, нуклеотиды и нуклеиновые кислоты, их структура и свойства
- •Г лава 24 электрохимия. Электрическая проводимость растворов электролитов
- •24.1. Электрическая подвижность ионов в растворе
- •24.2. Удельная электрическая проводимость растворов электролитов
- •24.3. Молярная электрическая проводимость растворов электролитов
- •24.4. Закон независимого движения ионов в разбавленных растворах (закон кольрауша)
- •24.5. Кондуктометрические методы анализа
- •24.5.1. Кондуктометрическое титрование
- •24.6. Электрическая проводимость биологических объектов в норме и патологии
- •Г лава 25 межфазные электрические потенциалы, гальванические цепи, потенциометрия
- •25.1. Возникновение двойного электрического слоя и виды электрических потенциалов
- •25.2. Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение нернста
- •25.3. Восстановительный потенциал
- •25.4. Диффузионный потенциал
- •25.5. Мембранный потенциал
- •25.6. Потенциометрия
- •25.6.1. Хлорсеребряный электрод сравнения
- •25.6.2. Ионо- и молекулярноселективные электроды определения
- •25.6.3. Потенциометрическое титрование
- •Глава 26 физико-химические основы поверхностных явлений
- •26.1. Свободная поверхностная энергия
- •26.2. Сорбция и ее виды
- •26.3. Абсорбция
- •26.4. Адсорбция
- •26.4.1. Адсорбция на неподвижной поверхности раздела фаз
- •26.4.2. Молекулярная адсорбция из растворов на твердых адсорбентах
- •26.4.3. Адсорбция ионов из растворов
- •26.4.4. Ионообменная адсорбция
- •26.5. Адсорбция на подвижной поверхности раздела фаз
- •26.6. Поверхностно-активные вещества
- •26.7. Хроматография
- •Глава 27 физикохимия дисперсных систем
- •27.2. Лиофобные коллоидные растворы
- •27.2.1. Строение мицелл в лиофобных коллоидных растворах
- •27.2.2. Свойства лиофобных коллоидных растворов
- •27.2.3. Влияние высокомолекулярных соединений на устойчивость лиофобных коллоидов. Флокуляция
- •27.3. Лиофильные коллоидные растворы
- •27.3.1. Строение мицелл пав и вмс в водных коллоидных растворах в зависимости от их концентрации
- •27. 3. 2. Получение и свойства лиофильных коллоидных растворов
- •27.3.3. Моющее действие растворов пав
- •27.3.4. Особенности растворов биополимеров
- •27.4. Структурообразование в растворах вмс. Возникновение связнодисперсных систем и их свойства
- •27.5. Грубодисперсные системы
- •27.5.1. Суспензии
- •27.5.2. Эмульсии
- •27.5.3. Аэрозоли
- •27.6. Электрокинетические явления в дисперсных системах
- •27.7. Ткани организма - дисперсные системы
- •27.7.1. Строение и свойства межклеточных мембран
- •27.7.2. Кровь - сложная дисперсная система
- •Приложение 1 применение осмолярной и осмоляльной концентраций в практической медицине
14.3. Загрязнение гидросферы. Понятие об общих показателях, характеризующих природные и сточные воды
Гидросфера занимает 3/4 поверхности земного шара. Большую часть, 97,2 % от общего количества воды, составляет вода океанов. С каждым годом увеличивается как общее, так и безвозвратное потребление воды. Частично вода возвращается в гидросферу, но уже в виде сточных вод.
Бытовые и сточные воды, возвращаемые гидросфере, представляют собой гомогенные или гетерогенные системы. Гетерогенные системы подразделяются на взвеси, суспензии, эмульсии и коллоидные системы. Гомогенные системы могут быть представлены молекулярными растворами или ионными растворами электролитов. Бытовые и сточные воды перед сбросом в гидросферу должны подвергаться строгому контролю. Рассмотрим общие показатели для природных и сточных вод, предусмотренные ГОСТом, и методы их определения.
1. Мутность и содержание суспендированных веществ. Показатель определяется фильтрацией вод.
Общее содержание растворенных веществ. Показатель определяется после выпаривания воды (сухой остаток).
Жесткость воды. Признак, характеризующий содержание солей кальция и магния в природной воде. Различают общую, постоянную и устранимую (временную) жесткость.
Общая жесткость характеризует общее содержание солей кальция и магния.
Постоянная жесткость определяется содержанием солей кальция и магния, устойчивых к нагреванию.
Устранимая жесткость (временная) характеризует содержание гидрокарбонатов кальция и магния, разлагающихся при нагревании:
![]()
Общая жесткость воды определяется методом трилонометрии (разд. 10.6). Постоянная жесткость устанавливается тем же методом трилонометрии, но только после кипячения анализируемой пробы воды. Устранимая жесткость (содержание гидрокарбонатов кальция и магния) определяется как разность между общей и постоянной жесткостью.
4. Кислотность (щелочность) сточных вод. В сточных водах могут содержаться кислоты и основания, как сильные, так и слабые. Показателем, определяющим содержание кислот (щелочей), служит общая и активная кислотность (щелочность) (разд. 8.3.3). Активная кислотность (щелочность) характеризует содержание сильных кислот (щелочей), а общая кислотность (щелочность) - суммарное содержание и сильных, и слабых кислот (щелочей). Определение общей и активной кислотности осуществляется титрованием раствором щелочи в присутствии двух индикаторов: метилоранжа (область перехода окраски 3,1 < рН < 4,4), позволяющего определить активную кислотность, и фенолфталеина (область перехода окраски 8,2 < рН < 10,0) для определения общей кислотности анализируемой сточной воды (гл. 8). Для определения этих показателей в мутных или сильно окрашенных пробах используют методы кондуктометрического (разд. 24.6) или потенциометрического титрования (разд. 25.6.3).
5. Концентрация растворенного в воде кислорода. Наличие кислорода в водоемах обеспечивает жизнедеятельность в них живых организмов. Растворенный кислород достаточно быстро взаимодействует с растворенными веществами-восстановителями, которые легко окисляются, и очень медленно - с трудноокисляемыми. Последние могут постепенно окисляться микроорганизмами, присутствующими в воде и потребляющими при этом кислород. В результате концентрация растворенного кислорода в водоеме снижается и ухудшаются условия для жизнедеятельности рыб и других живых организмов. Поэтому концентрация растворенного кислорода и изменение ее во времени являются чрезвычайно важными показателями для характеристики качества сточных и природных вод.
Определение концентрации растворенного в воде кислорода основано на обменной реакции получения гидроксида двухвалентного марганца, который при взаимодействии с кислородом количественно окисляется:
![]()
Содержание продукта окисления - соединения Mn(IV) - количественно определяют методом иодометрии.
6. Биохимическое потребление кислорода (БПК). Определяемый показатель характеризует изменение концентрации растворенного кислорода во времени и содержание в воде биологически разлагаемых веществ (чаще всего легко окисляемых органических веществ) или аэробных микроорганизмов. В момент взятия пробы определяется концентрация растворенного в воде кислорода описанным выше методом. Затем проба воды хранится в темноте в течение 5 суток (ВПК5), 10 суток (БПК10) или 20 суток (БПКзо). По истечении определенного срока хранения опять определяется концентрация растворенного в воде кислорода. По разности концентраций до хранения и после устанавливается содержание в анализируемой пробе соединений, легко окисляемых растворенным кислородом, или живых организмов, потребляющих растворенный кислород.
БПК характеризует степень загрязнения водоемов восстановителями или потребителями кислорода:
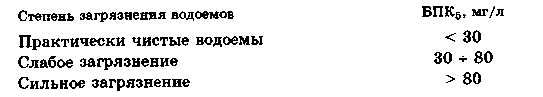
Сильное увеличение БПК природных водоемов чаще всего связано с разрастанием в них синезеленых, зеленых и красных водорослей, которые несъедобны для большинства рыб. Разрастание этих водорослей затрудняет рост других живых систем и способствует размножению микроорганизмов, разлагающих мертвые растительные и животные ткани. Все это приводит к уменьшению концентрации растворенного кислорода, т. е. к старению водоемов. Этот процесс называется эвтрофикацией. Эвтрофикацию водоемов усугубляют азотные и фосфатные удобрения, которые смываются с полей в эти водоемы, а также синтетические моющие вещества, содержащие 30-40 % полифосфатов.
7![]() . Перманганатная
проба (окисляемость воды).
Этот
показатель характеризует содержание
органических веществ, способных
окисляться перманганатом калия в кислой
среде, т. е.достаточно сильных
восстановителей:
. Перманганатная
проба (окисляемость воды).
Этот
показатель характеризует содержание
органических веществ, способных
окисляться перманганатом калия в кислой
среде, т. е.достаточно сильных
восстановителей:
О![]() пределение
осуществляется при кипячении подкисленной
пробы воды с избытком КМп04.
Остаток КМп04
оттитровывается оксалатом натрия в
кислой среде:
пределение
осуществляется при кипячении подкисленной
пробы воды с избытком КМп04.
Остаток КМп04
оттитровывается оксалатом натрия в
кислой среде:
 8.
Химическое
потребление кислорода (ХПК).
Характеризует
содержание всех органических веществ,
растворенных в воде, в том числе и
трудноокисляемых соединений. Определение
основано на окислении органических
веществ очень сильным окислителем при
нагревании. С этой целью к пробе воды
добавляют дихромат калия и концентрированную
серную кислоту:
8.
Химическое
потребление кислорода (ХПК).
Характеризует
содержание всех органических веществ,
растворенных в воде, в том числе и
трудноокисляемых соединений. Определение
основано на окислении органических
веществ очень сильным окислителем при
нагревании. С этой целью к пробе воды
добавляют дихромат калия и концентрированную
серную кислоту:
![]()
После кипячения раствора остаток К2Сг207 оттитровывается методом иодометрии:
![]()
Кроме перечисленных общих показателей, природные и сточные воды могут анализироваться на содержание тех или иных электролитов или различных металлов, включая прежде всего металлы-токсиканты, а также содержание разнообразных пестицидов и диоксинов.
Пестициды - это препараты для борьбы с вредоносными и нежелательными микроорганизмами, растениями и животными. Наиболее токсичны пестициды, которые представляют собой ртуть- или полигалоген-содержащие органические соединения. К последним относятся ДДТ (ди-хлордифенилтрихлорметилметан) и полихлорированные бифенилы. Эти соединения химически устойчивы и не разлагаются микроорганизмами. Поэтому они накапливаются в биосфере и в живых организмах, препятствуя их размножению или вызывая уродства. В настоящее время производство и использование ДДТ запрещено.
О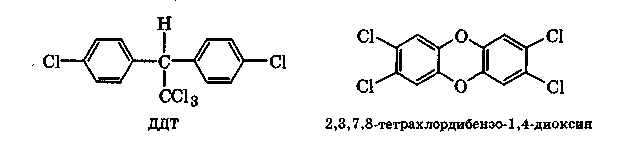 собенно
опасными являются диоксины
в
силу их чрезвычайно высокой токсичности
и биологической активности. Диоксины
- это группа полихлорированных соединений,
например полихлорированные
дибен-зо-1,4-диоксины (ПХДД), дибензофураны
(ПХДФ), бифенилы (ПХБФ) и многие другие.
Диоксины образуются в качестве побочных
веществ во многих технологических
процессах - от целлюлозно-бумажного
производства до биологической очистки
сточных вод, хлорирования питьевой
воды и сжигания отходов. Эти вещества
по своей токсичности превосходят
соединения тяжелых металлов,
хлорорганические пестициды, а по
канцерогенности - ароматический
углеводород бензпирен. Диоксины способны
накапливаться в организме, вызывая
многие тяжелые заболевания: перерождение
кожи и слизистых оболочек, разрушение
печени, злокачественные новообразования,
нарушения в развитии плода у женщин.
Они могут быть причиной иммунодефицита.
Наиболее опасен
2,3,7,8-тетрахлордибензо-1,4-диоксин: его
летальная доза составляет 0,07 мг/кг.
собенно
опасными являются диоксины
в
силу их чрезвычайно высокой токсичности
и биологической активности. Диоксины
- это группа полихлорированных соединений,
например полихлорированные
дибен-зо-1,4-диоксины (ПХДД), дибензофураны
(ПХДФ), бифенилы (ПХБФ) и многие другие.
Диоксины образуются в качестве побочных
веществ во многих технологических
процессах - от целлюлозно-бумажного
производства до биологической очистки
сточных вод, хлорирования питьевой
воды и сжигания отходов. Эти вещества
по своей токсичности превосходят
соединения тяжелых металлов,
хлорорганические пестициды, а по
канцерогенности - ароматический
углеводород бензпирен. Диоксины способны
накапливаться в организме, вызывая
многие тяжелые заболевания: перерождение
кожи и слизистых оболочек, разрушение
печени, злокачественные новообразования,
нарушения в развитии плода у женщин.
Они могут быть причиной иммунодефицита.
Наиболее опасен
2,3,7,8-тетрахлордибензо-1,4-диоксин: его
летальная доза составляет 0,07 мг/кг.
Выявление наличия пестицидов и особенно диоксинов в исследуемых системах требует использования очень чувствительных современных физико-химических методов: жидкостной хроматографии, масс-спектрометрии или хроматомасс-спектрометрии.
Важная роль в развитии биологии, биохимии, биофизики, физиологии, фармакологии и медицины принадлежит еще одному разделу химии - биоорганической химии, изучающей строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием их биологических функций. Биоорганическая химия вместе с другими разделами химии формирует химическое мировоззрение, которое необходимо для рассмотрения и понимания на молекулярном уровне проблем биологии и медицины. Фундаментальной проблемой биоорганической химии является выяснение взаимосвязи структуры соединения с механизмом его биологического функционирования, т. е. установление взаимосвязи структура - функция.
Б иоорганическая
химия базируется на органической
химии, которая возникла как раздел
химии, изучающий вещества живой природы.
Очень важную роль в становлении
органической
химии сыграла теория строения органических
соединений, основоположником которой
является великий русский ученый Александр
Михайлович Бутлеров (1828-1886). С
основными положениями этой теории вы
познакомились
в школе. В настоящем учебнике
рассматриваются основные понятия
органической
химии, необходимые для усвоения
основ биоорганической химии.
иоорганическая
химия базируется на органической
химии, которая возникла как раздел
химии, изучающий вещества живой природы.
Очень важную роль в становлении
органической
химии сыграла теория строения органических
соединений, основоположником которой
является великий русский ученый Александр
Михайлович Бутлеров (1828-1886). С
основными положениями этой теории вы
познакомились
в школе. В настоящем учебнике
рассматриваются основные понятия
органической
химии, необходимые для усвоения
основ биоорганической химии.
