
- •Оглавление
- •Глава 1 16
- •Глава 2 химическая связь 33
- •Глава 3 54
- •Глава 4 82
- •Глава 5 110
- •Глава 6 141
- •Глава 7 173
- •Глава 8 196
- •Глава 9 234
- •Глава 10 комплексные соединения и их свойства 272
- •Глава 11 297
- •Глава 12 316
- •Глава 13 377
- •Глава 14 400
- •Глава 15 основные понятия органической химии 419
- •Глава 16 445
- •Глава 17 474
- •Глава 18 499
- •Глава 19 518
- •Глава 20 562
- •Глава 21 аминокислоты, пептиды и белки 578
- •Глава 22 620
- •Глава 23 651
- •Глава 24 692
- •Глава 25 709
- •Глава 26 740
- •Глава 27 771
- •От автора
- •Глава 1 строение атома, периодический закон и периодическая система элементов д. И. Менделеева
- •1.1. Строение атома
- •1.1.1. Квантовые числа
- •1.1.2. Принципы заполнения атомных орбиталей электронами
- •1.2. Периодический закон и периодическая система элементов д. И. Менделеева
- •1.3. Основные характеристики атомов элементов
- •1.3.1. Радиус атома
- •1.3.2. Энергия ионизации
- •1.3.3. Энергия сродства к электрону
- •1.3.4. Относительная электроотрицательность
- •Глава 2 химическая связь
- •2.1. Ковалентная связь
- •2.1.1. И молекулярные орбитали
- •2.1.2. Механизмы возникновения ковалентной связи
- •2.1.3. Особенности ковалентной связи
- •2.2. Ионная связь
- •2.3. Металлическая связь
- •Глава 3 межмолекулярные взаимодействия и агрегатное состояние вещества
- •3.1. Межмолекулярные взаимодействия
- •3.2. Агрегатное состояние вещества
- •3.2.1. Твердое состояние
- •3.2.2. Жидкое состояние
- •3.2.3. Жидкокристаллическое состояние
- •3.2.4. Паро- и газообразное состояния
- •Глава 4 основы химической термодинамики и биоэнергетики
- •4.1. Основные понятия термодинамики
- •4.2. Первый закон термодинамики
- •4.3. Понятие о самопроизвольных процессах.
- •4.4. Второй закон термодинамики. Энергия гиббса
- •4.5. Принцип энергетического сопряжения биохимических реакций
- •Г лава 5 основы кинетики биохимических реакций и химического равновесия
- •5.1. Основные понятия и терминология раздела
- •5.2. Факторы, влияющие на скорость гомогенных реакций
- •5.2.1. Влияние природы реагирующих веществ
- •5.2.2. Влияние концентрации реагентов.
- •5.2.3. Влияние температуры. Энергия активации
- •5.2.4. Влияние катализатора
- •5.3. Особенности кинетики гетерогенных реакций
- •5.4. Особенности кинетики цепных реакций
- •5.5. Химическое равновесие
- •5.5.1. Смещение химического равновесия
- •5.6. Ферментативный катализ и его особенности
- •5.7. Автоколебательные биохимические процессы
- •Г лава 6 растворы и их коллигативные свойства
- •6.1. Вода как растворитель и ее роль в жизнедеятельности организма
- •6.2. Термодинамика процесса растворения
- •6.З. Способы выражения концентрации растворов
- •6.4. Коллигативные свойства растворов
- •6.4.1. Диффузия
- •6.4.2. Осмос. Осмотическое и онкотическое давление
- •6.4.3. Давление насыщенного пара над раствором
- •6.4.4. Температура кипения и замерзания раствора
- •Глава 7 растворы электролитов и ионные равновесия
- •7.1. Электролитическая диссоциация
- •7.2. Равновесие в растворах слабых электролитов
- •7.2.1. Влияние общего иона и противоиона на равновесие
- •7.2.2. Взаимосвязь константы диссоциации и степени диссоциации
- •7.3. Особенности растворов сильных электролитов. Ионная сила раствора
- •7.4. Электролитическая диссоциация и ионное произведение воды
- •7.5. Водородный и гидроксильный показатели (рН и рОн)
- •7.6. Физико-химические основы водно-электролитного баланса в организме
- •Г лава 8 теория кислот и оснований и протолитические равновесия
- •8.1. Протолитическая теория кислот и оснований
- •8.2. Кислотно-основные свойства а-аминокислот
- •8.3. Важнейшие кислотно-основные реакции
- •8.3.1. Гидролиз солей
- •8.3.2. Реакции нейтрализации
- •8.3.3. Общая, активная и потенциальная кислотность растворов
- •8.4. Протолитический баланс. Буферные растворы и их свойства
- •8.5. Буферные системы организма, их взаимодействие, явления ацидоза и алкалоза
- •9.1. Основные понятия и факторы, влияющие на протекание окислительно-восстановительных реакций
- •9.2. Направление протекания окислительно-восстановительных реакций
- •9.3. Особенности биохимических окислительно-восстановительных процессов в организмах
- •9.3.1. Степень окисления углерода в органических соединениях
- •9.3.2. Биохимические реакции внутри- и межмолекулярной окислительно-восстановительной дисмутации за счет атомов углерода
- •9.3.3. Окислительно-восстановительные превращения кофакторов и коферментов оксидоредуктаз
- •9.3.4. Электронотранспортные цепи
- •9.3.5. Дегидрогеназное окисление-восстановление
- •9.3.6. Окислительное фосфорилирование
- •9.3.7. Фотофосфорилирование
- •9.3.8. Оксигеназное окисление-восстановление
- •9.3.9. Свободнорадикальное окисление и антиоксидантная система организма
- •9.4. Использование окислителей и восстановителей в медико-санитарной практике
- •Глава 10 комплексные соединения и их свойства
- •10.1. Основные понятия и терминология
- •10.2. Химическая связь в комплексных соединениях и особенности их строения
- •10.3. Химические свойства комплексных соединений
- •10.4. Медико-биологическая роль комплексных соединений
- •10.5. Металлолигандный баланс и его нарушения
- •10.6. Комплексонометрия
- •Глава 11 гетерогенные процессы и равновесия в растворах
- •11.1. Основные понятия и теоретические основы
- •11.2. Гетерогенные равновесия в растворах, связанные с процессом кристаллизации
- •11.3. Гетерогенные равновесия в растворах, связанные с процессом расслоения
- •11.4. Гетерогенные равновесия в живых системах
- •Глава 12 химия элементов-органогенов
- •12.2. Строение, химические свойства и роль элементов-органогенов и их соединений в растительном и животном мире
- •12.2.1. Водород и его соединения
- •12.2.2. Углерод и его соединения
- •12.2.3. Азот и его соединения
- •12.2.4. Фосфор и его соединения
- •12.2.5. Кислород и его соединения
- •12.2.6. Сера и ее соединения
- •12.3. Строение и химические свойства галогенов и их соединений
- •Глава 13 химия ионов металлов жизни и их роль в растительном и животном мире
- •13.1. Химия ионов s-металлов в организме
- •13.1.1. Натрий и калий
- •13.1.2. Магний и кальций
- •13.2. Химия ионов d-металлов в организме
- •13.2.1. Марганец
- •13.2.2. Железо и кобальт
- •13.2.3. Медь
- •13.2.4. Цинк
- •13.2.5. Молибден
- •Глава 14 химия и анализ загрязнений окружающей среды
- •14.1. Химия загрязнений атмосферы
- •14.1.1. Токсический смог
- •14.1.2. Фотохимический смог
- •14.1.3. Кислотные дожди
- •14.1.4. Загрязнение атмосферы другими токсикантами
- •14.1.5. Разрушение озонового слоя
- •14.2. Методы анализа токсикантов и методы снижения их поступления в атмосферу
- •14.3. Загрязнение гидросферы. Понятие об общих показателях, характеризующих природные и сточные воды
- •Глава 15 основные понятия органической химии
- •15.1. Основы классификации и номенклатуры органических соединений
- •15.2. Пространственная структура биоорганических молекул и виды изомерии
- •15.3. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •15.4. Классификация органических реакций и их компонентов
- •Г лава 16 алифатические и ароматические углеводороды
- •16.1. Строение и реакционная способность алканов
- •16.2. Строение и реакционная способность ненасыщенных углеводородов: алкенов и диенов
- •16.3. Ароматические углеводороды (арены)
- •Глава 17 спирты, фенолы, простые эфиры, тиолы и сульфиды
- •17.2. Физико-химические свойства спиртов и фенолов
- •17.3. Химические свойства спиртов
- •17.4. Химические свойства фенолов
- •17.5. Простые эфиры
- •17.6. Тиолы и сульфиды
- •Г лава 18 альдегиды, кетоны и их производные
- •18.1. Строение, номенклатура и физико-химические свойства альдегидов и кетонов
- •18.2. Химические свойства альдегидов и кетонов
- •18.2.1. Кислотно-основные свойства
- •18.2.2. Электрофильно-нуклеофильные свойства
- •18.2.3. Окислительно-восстановительные свойства
- •18.2.4. Комплексообразующие свойства
- •18.3. Альдегиды и кетоны в окружающей среде
- •Г лава 19 карбоновые кислоты и их функциональные производные
- •19.2. Химические свойства предельных кислот и их производных
- •19.2.1. Кислотно-основные свойства
- •19.2.2. Карбоновые кислоты как ацилирующие реагенты
- •19.2.3. Производные карбоновых кислот, их свойства и взаимные превращения
- •19.2.4. Окислительно-восстановительные свойства карбоновых кислот и их производных
- •19.3. Особенности свойств замещенных карбоновых кислот и их производных
- •19.3.1. Дикарбоновые кислоты
- •19.3.2. Гидроксикарбоновые кислоты
- •19.3.3. Оксокарбоновые кислоты
- •19.3.4. Ненасыщенные карбоновые кислоты
- •19.4. Основные реакции метаболизма карбоновых кислот
- •19.4.1. Биосинтез жирных кислот
- •1 9.4.2. Биологическое окисление жирных кислот
- •19.4.3. Реакции цикла кребса
- •19.5. Кислоты ароматического ряда и их производные как лекарственные средства
- •Г лава 20 Липиды
- •20.1. Жиры и воски
- •20.2. Омыляемые сложные липиды
- •20.3. Неомыляемые липиды - низкомолекулярные биорегуляторы
- •Глава 21 аминокислоты, пептиды и белки
- •21.1. Строение, классификация и физико-химические свойства а-аминокислот
- •21.2. Химические свойства а-аминокислот
- •21.2.1. Кислотно-основные свойства и прототропная таутомерия
- •21.2.2. К0мплекс00бразующие свойства
- •21.2.3. Электрофильно-нуклеофильные свойства
- •21.2.4. Окислительно-восстановительные свойства
- •21.3. Структура и свойства пептидов
- •21.4. Структура и свойства белков
- •Глава 22 углеводы и полисахариды
- •22.1. Строение, изомерия и свойства моносахаридов
- •22.1.1. Химические свойства моносахаридов и их производных
- •22.1.2. Катаболизм глюкозы - гликолиз
- •22.3. Полисахариды, их структура и свойства
- •22.3.1. Гомополисахариды
- •22.3.2. Гетерополисахариды, протеогликаны, гликопротеины
- •Г лава 23 биологически важные азотсодержащие соединения
- •23.1. Электронные состояния атома азота в его соединениях и свойства этих соединений
- •23.2. Роль аммиака для живых организмов и пути его обезвреживания. Цикл мочевины и ее свойства
- •23.3. Азотсодержащие ароматические гетероциклические соединения
- •23.4. Нуклеозиды, нуклеотиды и нуклеиновые кислоты, их структура и свойства
- •Г лава 24 электрохимия. Электрическая проводимость растворов электролитов
- •24.1. Электрическая подвижность ионов в растворе
- •24.2. Удельная электрическая проводимость растворов электролитов
- •24.3. Молярная электрическая проводимость растворов электролитов
- •24.4. Закон независимого движения ионов в разбавленных растворах (закон кольрауша)
- •24.5. Кондуктометрические методы анализа
- •24.5.1. Кондуктометрическое титрование
- •24.6. Электрическая проводимость биологических объектов в норме и патологии
- •Г лава 25 межфазные электрические потенциалы, гальванические цепи, потенциометрия
- •25.1. Возникновение двойного электрического слоя и виды электрических потенциалов
- •25.2. Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение нернста
- •25.3. Восстановительный потенциал
- •25.4. Диффузионный потенциал
- •25.5. Мембранный потенциал
- •25.6. Потенциометрия
- •25.6.1. Хлорсеребряный электрод сравнения
- •25.6.2. Ионо- и молекулярноселективные электроды определения
- •25.6.3. Потенциометрическое титрование
- •Глава 26 физико-химические основы поверхностных явлений
- •26.1. Свободная поверхностная энергия
- •26.2. Сорбция и ее виды
- •26.3. Абсорбция
- •26.4. Адсорбция
- •26.4.1. Адсорбция на неподвижной поверхности раздела фаз
- •26.4.2. Молекулярная адсорбция из растворов на твердых адсорбентах
- •26.4.3. Адсорбция ионов из растворов
- •26.4.4. Ионообменная адсорбция
- •26.5. Адсорбция на подвижной поверхности раздела фаз
- •26.6. Поверхностно-активные вещества
- •26.7. Хроматография
- •Глава 27 физикохимия дисперсных систем
- •27.2. Лиофобные коллоидные растворы
- •27.2.1. Строение мицелл в лиофобных коллоидных растворах
- •27.2.2. Свойства лиофобных коллоидных растворов
- •27.2.3. Влияние высокомолекулярных соединений на устойчивость лиофобных коллоидов. Флокуляция
- •27.3. Лиофильные коллоидные растворы
- •27.3.1. Строение мицелл пав и вмс в водных коллоидных растворах в зависимости от их концентрации
- •27. 3. 2. Получение и свойства лиофильных коллоидных растворов
- •27.3.3. Моющее действие растворов пав
- •27.3.4. Особенности растворов биополимеров
- •27.4. Структурообразование в растворах вмс. Возникновение связнодисперсных систем и их свойства
- •27.5. Грубодисперсные системы
- •27.5.1. Суспензии
- •27.5.2. Эмульсии
- •27.5.3. Аэрозоли
- •27.6. Электрокинетические явления в дисперсных системах
- •27.7. Ткани организма - дисперсные системы
- •27.7.1. Строение и свойства межклеточных мембран
- •27.7.2. Кровь - сложная дисперсная система
- •Приложение 1 применение осмолярной и осмоляльной концентраций в практической медицине
13.2.4. Цинк
В организме взрослого человека содержится 1,4-2,3 г цинка, из них 20 % - в костях, 65 % - в мышцах, 9 % - в крови, остальное - в печени и предстательной железе. Рекомендуемая ежедневная доза потребления составляет около 20 мг.
Цинк является d-металлом ПБ группы 4 периода периодической системы, его электронная формула ls22s22p63s23p63d104s2. Так как цинк имеет заполненный Зd-подуровень, то в образовании химических связей участвуют только два внешних 4s-электрона, и поэтому во всех соединениях цинк всегда проявляет степень окисления +2. Следовательно, в условиях организма для цинксодержащих биосубстратов окислительно-восстановительные превращения не имеют места, но для них характерны амфотерные и комплексообразующие свойства.
В кислых водных растворах катион Zn2+ образует акваком-плексы [Zn(H20)4]2+, в которых молекулы воды удерживаются довольно прочно (т = 5*10-7 с). Оксид и гидроксид цинка амфотерны и поэтому легко растворяются и в кислотах, и в щелочах:
![]()
С учетом большой склонности катионов цинка к комплек-сообразованию его амфотерность лучше выразить следующим равновесием:
![]()
Кислотные и основные свойства у гидроксида цинка выражены примерно одинаково с легким преобладанием основных свойств (рК1a = 7,8). Следовательно, в водных средах, близких к нейтральным (5,8 < рН < 9,8), в растворе будет иметь место указанное равновесие между комплексными ионами цинка, что следует учитывать при описании механизма действия цинксодержащих ферментов:
Ц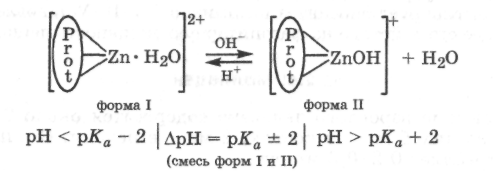 инк
входит в состав более 40 металлоферментов.
Так, установлено, что он входит в
состав активного центра карбоан-гидразы,
карбоксипептидазы, РНК- и ДНК-полимераз,
супероксиддисмутазы и других.
инк
входит в состав более 40 металлоферментов.
Так, установлено, что он входит в
состав активного центра карбоан-гидразы,
карбоксипептидазы, РНК- и ДНК-полимераз,
супероксиддисмутазы и других.
П![]() рисутствие
цинка в эритроцитах объясняется тем,
что он содержится в карбоангидразе.
Карбоангидраза катализирует процессы
гидратации СO2
и дегидратации угольной кислоты, тем
самым влияет на процесс дыхания, на его
скорость и на газообмен в организме:
рисутствие
цинка в эритроцитах объясняется тем,
что он содержится в карбоангидразе.
Карбоангидраза катализирует процессы
гидратации СO2
и дегидратации угольной кислоты, тем
самым влияет на процесс дыхания, на его
скорость и на газообмен в организме:
В карбоангидразе цинк с белком, содержащим 260 аминокислотных остатков, образует три донорно-акцепторные связи, а четвертая связь удерживает или молекулу воды, или гидроксильную группу. Соотношение этих форм зависит от рН среды. Механизм гидратации СО2 в активном центре карбоангидразы для этих случаев можно представить следующими схемами:
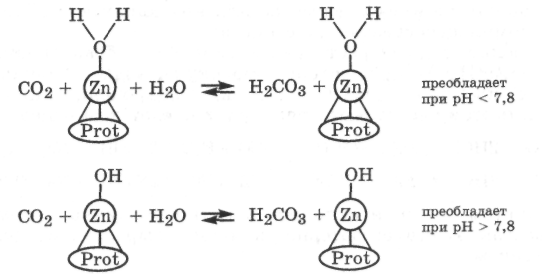
Подобный механизм действия, включающий две формы фермента, имеет место и в случае фермента карбоксипептидазы, катализирующего гидролиз пептидных связей.
Известное влияние оказывает цинк на углеводный обмен. Полагают, что благоприятное для организма больного диабетом влияние (удлинение гипогликемического эффекта), вызванное взаимодействием цинка с инсулином, заключается не только в стабилизирующем воздействии цинка на молекулу инсулина, но и в угнетении цинком процесса разрушения инсулина в тканях под действием фермента инсулиназы.
Цинк активирует биосинтез витаминов С и В. Установлено стимулирующее его действие на фагоцитарную активность лейкоцитов.
13.2.5. Молибден
В организме взрослого человека содержится около 9 мг молибдена, из них 5 мг - в костях, 2 мг - в печени. С пищей человек потребляет 0,2-0,3 мг/сут.
Молибден является d-металлом 5 периода VIB группы периодической системы. Электронная конфигурация молибдена ls22s22p63s23p63d104s24p64d55s1, т. е. он имеет наполовину заполненный 4d-подуровень (4d5), что энергетически выгодно. Молибден проявляет в соединениях переменные степени окисления от +2 до +6, наиболее устойчивыми из которых являются + 5 и особенно +6. В отличие от соединений шестивалентного хрома, являющихся сильными окислителями, соединения молибдена со степенью окисления +6 мало склонны к восстановлению из-за экранирования ядра атома молибдена большим числом электронов.
В биокомплексах молибден прежде всего образует связь с карбоксильной, гидроксильной и тиольной группами биолигандов. При этом сам молибден может находиться в комплексе в оксоформе, т. е. содержать одну или две связи Мо=0. Кроме того, атомы молибдена склонны образовывать между собой кислород или серосодержащие мостики Мо—О—Мо, Мо—S—Мо, а также образовывать в комплексах ковалентную связь с другими металлами. Эта особенность молибдена реализуется в ферментах, например в нитрогеназе, содержащей в активном центре ионы железа и молибдена одновременно. Вместе с атомами серы они образуют в активном центре "клетку", устроенную аналогично "клетке" железосеропротеинов (разд. 13.2.2).
Общебиологическая роль молибдена обусловлена тем, что он находится в самом центре основных путей включения азота в растительные, а следовательно, и в животные организмы. Молибден входит в состав нитрогеназы, катализирующей реакцию фиксации молекулярного азота, и нитратредуктазы растений и микроорганизмов, катализирующей восстановление нитрата до нитрита.
В организме животных и человека молибден входит в состав ферментов: ксантиноксидазы (катализирующей окисление ксантина до мочевой кислоты), сульфитоксидазы (катализирует окисление сульфита до сульфата) и альдегидоксидазы (катализирует окисление альдегидов). В ходе этих ферментативных реакций молибден со степенью окисления +6 восстанавливается до степени окисления +5 или даже +4. При избыточном поступлении молибдена в организм происходит активация синтеза ксантиноксидазы, увеличивается образование мочевой кислоты и, как результат, возникает заболевание "молибденовая подагра".
Заканчивая обзор химических свойств биогенных элементов и их соединений, хочется еще раз напомнить, что главная их функция состоит в построении тканей (модули IV и V) и в обеспечении водно-электролитного (разд. 6.4 и 7.6), кислотно-основного (гл. 8), окислительно-восстановительного (гл. 9) и металло-лигандного (гл. 10) балансов, необходимых для жизнедеятельности любых живых существ.

