
- •Оглавление
- •Глава 1 16
- •Глава 2 химическая связь 33
- •Глава 3 54
- •Глава 4 82
- •Глава 5 110
- •Глава 6 141
- •Глава 7 173
- •Глава 8 196
- •Глава 9 234
- •Глава 10 комплексные соединения и их свойства 272
- •Глава 11 297
- •Глава 12 316
- •Глава 13 377
- •Глава 14 400
- •Глава 15 основные понятия органической химии 419
- •Глава 16 445
- •Глава 17 474
- •Глава 18 499
- •Глава 19 518
- •Глава 20 562
- •Глава 21 аминокислоты, пептиды и белки 578
- •Глава 22 620
- •Глава 23 651
- •Глава 24 692
- •Глава 25 709
- •Глава 26 740
- •Глава 27 771
- •От автора
- •Глава 1 строение атома, периодический закон и периодическая система элементов д. И. Менделеева
- •1.1. Строение атома
- •1.1.1. Квантовые числа
- •1.1.2. Принципы заполнения атомных орбиталей электронами
- •1.2. Периодический закон и периодическая система элементов д. И. Менделеева
- •1.3. Основные характеристики атомов элементов
- •1.3.1. Радиус атома
- •1.3.2. Энергия ионизации
- •1.3.3. Энергия сродства к электрону
- •1.3.4. Относительная электроотрицательность
- •Глава 2 химическая связь
- •2.1. Ковалентная связь
- •2.1.1. И молекулярные орбитали
- •2.1.2. Механизмы возникновения ковалентной связи
- •2.1.3. Особенности ковалентной связи
- •2.2. Ионная связь
- •2.3. Металлическая связь
- •Глава 3 межмолекулярные взаимодействия и агрегатное состояние вещества
- •3.1. Межмолекулярные взаимодействия
- •3.2. Агрегатное состояние вещества
- •3.2.1. Твердое состояние
- •3.2.2. Жидкое состояние
- •3.2.3. Жидкокристаллическое состояние
- •3.2.4. Паро- и газообразное состояния
- •Глава 4 основы химической термодинамики и биоэнергетики
- •4.1. Основные понятия термодинамики
- •4.2. Первый закон термодинамики
- •4.3. Понятие о самопроизвольных процессах.
- •4.4. Второй закон термодинамики. Энергия гиббса
- •4.5. Принцип энергетического сопряжения биохимических реакций
- •Г лава 5 основы кинетики биохимических реакций и химического равновесия
- •5.1. Основные понятия и терминология раздела
- •5.2. Факторы, влияющие на скорость гомогенных реакций
- •5.2.1. Влияние природы реагирующих веществ
- •5.2.2. Влияние концентрации реагентов.
- •5.2.3. Влияние температуры. Энергия активации
- •5.2.4. Влияние катализатора
- •5.3. Особенности кинетики гетерогенных реакций
- •5.4. Особенности кинетики цепных реакций
- •5.5. Химическое равновесие
- •5.5.1. Смещение химического равновесия
- •5.6. Ферментативный катализ и его особенности
- •5.7. Автоколебательные биохимические процессы
- •Г лава 6 растворы и их коллигативные свойства
- •6.1. Вода как растворитель и ее роль в жизнедеятельности организма
- •6.2. Термодинамика процесса растворения
- •6.З. Способы выражения концентрации растворов
- •6.4. Коллигативные свойства растворов
- •6.4.1. Диффузия
- •6.4.2. Осмос. Осмотическое и онкотическое давление
- •6.4.3. Давление насыщенного пара над раствором
- •6.4.4. Температура кипения и замерзания раствора
- •Глава 7 растворы электролитов и ионные равновесия
- •7.1. Электролитическая диссоциация
- •7.2. Равновесие в растворах слабых электролитов
- •7.2.1. Влияние общего иона и противоиона на равновесие
- •7.2.2. Взаимосвязь константы диссоциации и степени диссоциации
- •7.3. Особенности растворов сильных электролитов. Ионная сила раствора
- •7.4. Электролитическая диссоциация и ионное произведение воды
- •7.5. Водородный и гидроксильный показатели (рН и рОн)
- •7.6. Физико-химические основы водно-электролитного баланса в организме
- •Г лава 8 теория кислот и оснований и протолитические равновесия
- •8.1. Протолитическая теория кислот и оснований
- •8.2. Кислотно-основные свойства а-аминокислот
- •8.3. Важнейшие кислотно-основные реакции
- •8.3.1. Гидролиз солей
- •8.3.2. Реакции нейтрализации
- •8.3.3. Общая, активная и потенциальная кислотность растворов
- •8.4. Протолитический баланс. Буферные растворы и их свойства
- •8.5. Буферные системы организма, их взаимодействие, явления ацидоза и алкалоза
- •9.1. Основные понятия и факторы, влияющие на протекание окислительно-восстановительных реакций
- •9.2. Направление протекания окислительно-восстановительных реакций
- •9.3. Особенности биохимических окислительно-восстановительных процессов в организмах
- •9.3.1. Степень окисления углерода в органических соединениях
- •9.3.2. Биохимические реакции внутри- и межмолекулярной окислительно-восстановительной дисмутации за счет атомов углерода
- •9.3.3. Окислительно-восстановительные превращения кофакторов и коферментов оксидоредуктаз
- •9.3.4. Электронотранспортные цепи
- •9.3.5. Дегидрогеназное окисление-восстановление
- •9.3.6. Окислительное фосфорилирование
- •9.3.7. Фотофосфорилирование
- •9.3.8. Оксигеназное окисление-восстановление
- •9.3.9. Свободнорадикальное окисление и антиоксидантная система организма
- •9.4. Использование окислителей и восстановителей в медико-санитарной практике
- •Глава 10 комплексные соединения и их свойства
- •10.1. Основные понятия и терминология
- •10.2. Химическая связь в комплексных соединениях и особенности их строения
- •10.3. Химические свойства комплексных соединений
- •10.4. Медико-биологическая роль комплексных соединений
- •10.5. Металлолигандный баланс и его нарушения
- •10.6. Комплексонометрия
- •Глава 11 гетерогенные процессы и равновесия в растворах
- •11.1. Основные понятия и теоретические основы
- •11.2. Гетерогенные равновесия в растворах, связанные с процессом кристаллизации
- •11.3. Гетерогенные равновесия в растворах, связанные с процессом расслоения
- •11.4. Гетерогенные равновесия в живых системах
- •Глава 12 химия элементов-органогенов
- •12.2. Строение, химические свойства и роль элементов-органогенов и их соединений в растительном и животном мире
- •12.2.1. Водород и его соединения
- •12.2.2. Углерод и его соединения
- •12.2.3. Азот и его соединения
- •12.2.4. Фосфор и его соединения
- •12.2.5. Кислород и его соединения
- •12.2.6. Сера и ее соединения
- •12.3. Строение и химические свойства галогенов и их соединений
- •Глава 13 химия ионов металлов жизни и их роль в растительном и животном мире
- •13.1. Химия ионов s-металлов в организме
- •13.1.1. Натрий и калий
- •13.1.2. Магний и кальций
- •13.2. Химия ионов d-металлов в организме
- •13.2.1. Марганец
- •13.2.2. Железо и кобальт
- •13.2.3. Медь
- •13.2.4. Цинк
- •13.2.5. Молибден
- •Глава 14 химия и анализ загрязнений окружающей среды
- •14.1. Химия загрязнений атмосферы
- •14.1.1. Токсический смог
- •14.1.2. Фотохимический смог
- •14.1.3. Кислотные дожди
- •14.1.4. Загрязнение атмосферы другими токсикантами
- •14.1.5. Разрушение озонового слоя
- •14.2. Методы анализа токсикантов и методы снижения их поступления в атмосферу
- •14.3. Загрязнение гидросферы. Понятие об общих показателях, характеризующих природные и сточные воды
- •Глава 15 основные понятия органической химии
- •15.1. Основы классификации и номенклатуры органических соединений
- •15.2. Пространственная структура биоорганических молекул и виды изомерии
- •15.3. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •15.4. Классификация органических реакций и их компонентов
- •Г лава 16 алифатические и ароматические углеводороды
- •16.1. Строение и реакционная способность алканов
- •16.2. Строение и реакционная способность ненасыщенных углеводородов: алкенов и диенов
- •16.3. Ароматические углеводороды (арены)
- •Глава 17 спирты, фенолы, простые эфиры, тиолы и сульфиды
- •17.2. Физико-химические свойства спиртов и фенолов
- •17.3. Химические свойства спиртов
- •17.4. Химические свойства фенолов
- •17.5. Простые эфиры
- •17.6. Тиолы и сульфиды
- •Г лава 18 альдегиды, кетоны и их производные
- •18.1. Строение, номенклатура и физико-химические свойства альдегидов и кетонов
- •18.2. Химические свойства альдегидов и кетонов
- •18.2.1. Кислотно-основные свойства
- •18.2.2. Электрофильно-нуклеофильные свойства
- •18.2.3. Окислительно-восстановительные свойства
- •18.2.4. Комплексообразующие свойства
- •18.3. Альдегиды и кетоны в окружающей среде
- •Г лава 19 карбоновые кислоты и их функциональные производные
- •19.2. Химические свойства предельных кислот и их производных
- •19.2.1. Кислотно-основные свойства
- •19.2.2. Карбоновые кислоты как ацилирующие реагенты
- •19.2.3. Производные карбоновых кислот, их свойства и взаимные превращения
- •19.2.4. Окислительно-восстановительные свойства карбоновых кислот и их производных
- •19.3. Особенности свойств замещенных карбоновых кислот и их производных
- •19.3.1. Дикарбоновые кислоты
- •19.3.2. Гидроксикарбоновые кислоты
- •19.3.3. Оксокарбоновые кислоты
- •19.3.4. Ненасыщенные карбоновые кислоты
- •19.4. Основные реакции метаболизма карбоновых кислот
- •19.4.1. Биосинтез жирных кислот
- •1 9.4.2. Биологическое окисление жирных кислот
- •19.4.3. Реакции цикла кребса
- •19.5. Кислоты ароматического ряда и их производные как лекарственные средства
- •Г лава 20 Липиды
- •20.1. Жиры и воски
- •20.2. Омыляемые сложные липиды
- •20.3. Неомыляемые липиды - низкомолекулярные биорегуляторы
- •Глава 21 аминокислоты, пептиды и белки
- •21.1. Строение, классификация и физико-химические свойства а-аминокислот
- •21.2. Химические свойства а-аминокислот
- •21.2.1. Кислотно-основные свойства и прототропная таутомерия
- •21.2.2. К0мплекс00бразующие свойства
- •21.2.3. Электрофильно-нуклеофильные свойства
- •21.2.4. Окислительно-восстановительные свойства
- •21.3. Структура и свойства пептидов
- •21.4. Структура и свойства белков
- •Глава 22 углеводы и полисахариды
- •22.1. Строение, изомерия и свойства моносахаридов
- •22.1.1. Химические свойства моносахаридов и их производных
- •22.1.2. Катаболизм глюкозы - гликолиз
- •22.3. Полисахариды, их структура и свойства
- •22.3.1. Гомополисахариды
- •22.3.2. Гетерополисахариды, протеогликаны, гликопротеины
- •Г лава 23 биологически важные азотсодержащие соединения
- •23.1. Электронные состояния атома азота в его соединениях и свойства этих соединений
- •23.2. Роль аммиака для живых организмов и пути его обезвреживания. Цикл мочевины и ее свойства
- •23.3. Азотсодержащие ароматические гетероциклические соединения
- •23.4. Нуклеозиды, нуклеотиды и нуклеиновые кислоты, их структура и свойства
- •Г лава 24 электрохимия. Электрическая проводимость растворов электролитов
- •24.1. Электрическая подвижность ионов в растворе
- •24.2. Удельная электрическая проводимость растворов электролитов
- •24.3. Молярная электрическая проводимость растворов электролитов
- •24.4. Закон независимого движения ионов в разбавленных растворах (закон кольрауша)
- •24.5. Кондуктометрические методы анализа
- •24.5.1. Кондуктометрическое титрование
- •24.6. Электрическая проводимость биологических объектов в норме и патологии
- •Г лава 25 межфазные электрические потенциалы, гальванические цепи, потенциометрия
- •25.1. Возникновение двойного электрического слоя и виды электрических потенциалов
- •25.2. Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение нернста
- •25.3. Восстановительный потенциал
- •25.4. Диффузионный потенциал
- •25.5. Мембранный потенциал
- •25.6. Потенциометрия
- •25.6.1. Хлорсеребряный электрод сравнения
- •25.6.2. Ионо- и молекулярноселективные электроды определения
- •25.6.3. Потенциометрическое титрование
- •Глава 26 физико-химические основы поверхностных явлений
- •26.1. Свободная поверхностная энергия
- •26.2. Сорбция и ее виды
- •26.3. Абсорбция
- •26.4. Адсорбция
- •26.4.1. Адсорбция на неподвижной поверхности раздела фаз
- •26.4.2. Молекулярная адсорбция из растворов на твердых адсорбентах
- •26.4.3. Адсорбция ионов из растворов
- •26.4.4. Ионообменная адсорбция
- •26.5. Адсорбция на подвижной поверхности раздела фаз
- •26.6. Поверхностно-активные вещества
- •26.7. Хроматография
- •Глава 27 физикохимия дисперсных систем
- •27.2. Лиофобные коллоидные растворы
- •27.2.1. Строение мицелл в лиофобных коллоидных растворах
- •27.2.2. Свойства лиофобных коллоидных растворов
- •27.2.3. Влияние высокомолекулярных соединений на устойчивость лиофобных коллоидов. Флокуляция
- •27.3. Лиофильные коллоидные растворы
- •27.3.1. Строение мицелл пав и вмс в водных коллоидных растворах в зависимости от их концентрации
- •27. 3. 2. Получение и свойства лиофильных коллоидных растворов
- •27.3.3. Моющее действие растворов пав
- •27.3.4. Особенности растворов биополимеров
- •27.4. Структурообразование в растворах вмс. Возникновение связнодисперсных систем и их свойства
- •27.5. Грубодисперсные системы
- •27.5.1. Суспензии
- •27.5.2. Эмульсии
- •27.5.3. Аэрозоли
- •27.6. Электрокинетические явления в дисперсных системах
- •27.7. Ткани организма - дисперсные системы
- •27.7.1. Строение и свойства межклеточных мембран
- •27.7.2. Кровь - сложная дисперсная система
- •Приложение 1 применение осмолярной и осмоляльной концентраций в практической медицине
2.1.3. Особенности ковалентной связи
Кроме характеристик, общих для любой химической связи (энергия и длина связи), ковалентная связь имеет дополнительные особенности: кратность, насыщаемость, направленность, сопряжение, полярность и поляризуемость.
Кратность. Между соединяемыми атомами могут возникать одна, две или три ковалентные связи.
Кратность ковалентной связи характеризуется числом общих электронных пар между соединяемыми атомами.
При наличии одной общей электронной пары между соединяемыми атомами говорят о простой (ординарной) ковалентной связи. Например, в молекулах Н2, HF, F2, Н2О, NH3, СН4, С2Н6 или ионах ОН-, NH4, [Zn(OH)4]-2, [Сu(NHз)4]2+ все связи между атомами ординарные и являются а-связями.
При наличии у соединяемых атомов двух или трех общих электронных пар между ними возникает соответственно двойная или тройная связь. При этом одна связь — обязательно -связь, остальные - -связи. Примерами могут служить молекулы или ионы, где между атомами есть кратные (двойные или тройные) связи:
![]()
С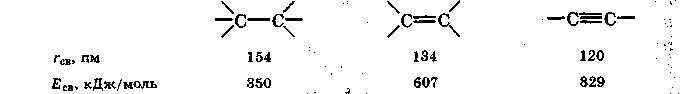 увеличением кратности связи всегда
уменьшается ее длина и повышается
суммарная прочность:
увеличением кратности связи всегда
уменьшается ее длина и повышается
суммарная прочность:
Однако
увеличение энергии связи, как видно из
приведенных значений, не пропорционально
увеличению кратности связи, что указывает
на различия в энергиях
и
-связи, причем Еа
> ЕП.
Это
объясняется тем, что эффективность
перекрывания взаимодействующих атомных
орбиталей в случае возникновения ![]() -молекулярной орбитали выше, чем при
образовании
-молекулярной орбитали.
-молекулярной орбитали выше, чем при
образовании
-молекулярной орбитали.
Насыщаемость. Каждый атом в соединении способен образовывать определенное число ковалентных связей. Благодаря насыщаемости ковалентных связей молекулы имеют определенный состав: Н2, Н2О, РС15, СН4.
Число возможных ковалентных связей, образуемых данным атомом, зависит при обменном механизме от числа неспаренных электронов на внешних энергетических уровнях у атомов в основном и возбужденном состояниях, а при донорно-акцепторном - еще и от числа свободных атомных орбиталей на внешних уровнях.
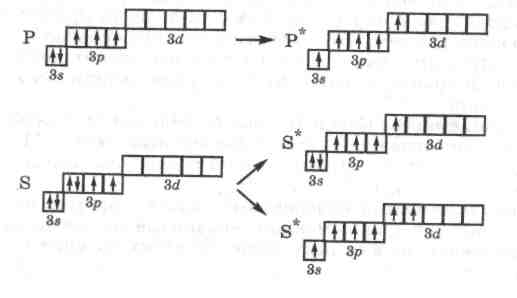
Число неспаренных электронов у атома данного элемента в основном состоянии определяется электронной структурой внешних уровней. Например, в основном состоянии внешний уровень атома углерода имеет структуру
![]()
Следовательно, в этом состоянии углерод имеет два неспаренных электрона и может образовывать две ковалентные связи по обменному механизму. Однако углерод в соединениях чаще всего образует четыре связи. Это объясняется тем, что на внешнем уровне в атоме углерода имеется свободная 2р-орбиталь, которая при возбуждении атома может быть частично занята за счет перехода одного электрона с 2s-орбитали с возникновением четырех неспаренных электронов:
![]()
Разъединение спаренных электронов и перенос их на новую орбиталь требует затрат энергии, однако этот расход энергии компенсируется с избытком выделением энергии за счет образования атомом углерода четырех ковалентных связей вместо двух. Аналогично можно объяснить образование бериллием всегда двух связей, а бором - трех. Начиная с третьего периода, у атомов р-элементов при возбуждении электроны внешних s- и р-подуровней могут переходить на свободный d-подуровень этого слоя, что приводит к увеличению числа возможных связей. Именно этим объясняется способность атомов фосфора образовывать в соединениях пять связей, атомов серы - четыре или шесть, а атомов хлора - три, пять и даже семь связей:
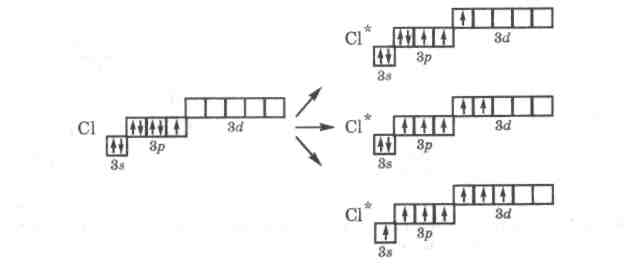
При донорно-акцепторном механизме возникновения ковалентной связи катионы d-металлов обычно могут предоставлять 2, 4 или 6 свободных атомных орбиталей разного типа (s, р, d), что значительно расширяет их возможность образовывать ковалентные связи в комплексных соединениях: [Ag(NH3)2]+ ;[CuCl4]2-; [Fe(CN)6]-3.
Направленность. Атомные орбитали, участвующие в образовании молекулярных орбиталей, имеют различную форму и разную ориентацию в пространстве. Это обусловливает пространственную направленность ковалентных связей, образуемых атомом, поскольку соединяемые атомы стремятся к максимальному перекрыванию атомных орбиталей. Направленность ковалентных связей определяет пространственную структуру (геометрию) молекул, состоящих более чем из двух атомов.
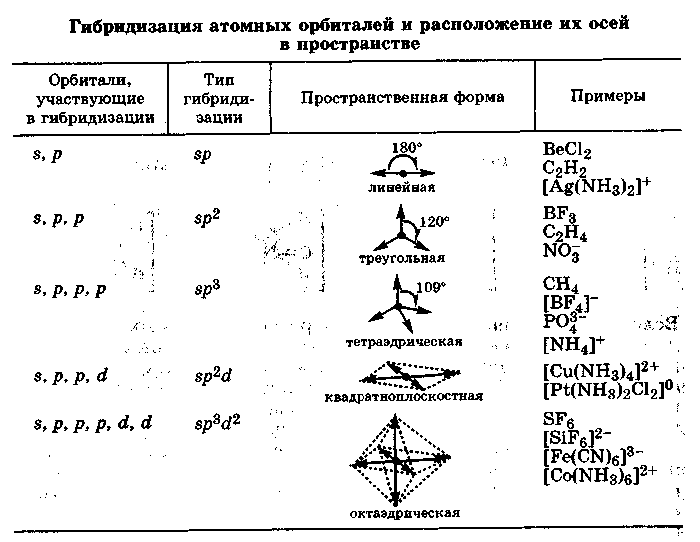
Для объяснения геометрического строения молекул или ионов с учетом направленности ковалентной связи Л. Полинг предложил идею о гибридизации атомных орбиталей.
Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей данного атома с возникновением того же числа новых (гибридных) орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами.
Гибридные орбитали имеют форму несимметричной восьмерки, сильно вытянутой в одну сторону от ядра:

Т акая
форма обусловливает более сильное
перекрывание гибридных орбиталей с
орбиталями других атомов и приводит к
образованию более прочных связей.
Поэтому энергия, затрачиваемая на
гибридизацию, с избытком компенсируется
выделением энергии
акая
форма обусловливает более сильное
перекрывание гибридных орбиталей с
орбиталями других атомов и приводит к
образованию более прочных связей.
Поэтому энергия, затрачиваемая на
гибридизацию, с избытком компенсируется
выделением энергии
Рис. 2.3. Пространственная структура молекул NH3, Н2О и гибридизация атомных орбиталей атомов азота и кислорода
за счет образования более прочных связей с участием гибридных атомных орбиталей. Название гибридных орбиталей определяется числом и типом участвующих орбиталей: sp-, sp2-, sp3-, sp2d-, sр3d2-гибридизация (табл. 2.2).
Направленность гибридных АО в пространстве, а следовательно, и геометрия молекул зависят от типа гибридизации. На практике обычно решается обратная задача: вначале экспериментально устанавливается геометрия молекулы, после чего описываются тип и форма АО, участвующих в ее образовании. Так, пространственная структура молекул NH3 и Н2О близка к тетраэдрической, поэтому считают, что атом азота в NH3 и атом кислорода в Н2О предоставляют для связывания с атомами водорода не чистые р-орбитали, а sр3-гибридные орбитали. Причем неподеленные электронные пары внешнего слоя атомов азота и кислорода также находятся на sр3-гибридных орбита-лях (рис. 2.3).
Таким образом, рассматривая ковалентные связи между атомами как результат взаимодействия атомных орбиталей, можно объяснить форму возникающих при этом частиц, которая зависит от числа и типа атомных орбиталей, участвующих в образовании связей. В табл. 2.2 указаны наиболее важные типы гибридизации и соответствующая им пространственная форма молекул или ионов.
Познакомившись с идеей о гибридизации атомных орбита-лей, необходимо понимать, что гибридизация представляет собой условный прием, позволяющий наглядно объяснить структуру молекулы путем комбинации атомных орбиталей.
Сопряжение ковалентных связей. Сопряжение ковалентных связей наблюдается в молекулах или ионах, когда по обе стороны от ординарной связи имеются кратные связи, л-МО которых частично перекрываются между собой с образованием общей -МО ( , -сопряжение). Другой случай сопряжения наблюдается, когда с одной стороны от ординарной связи имеется кратная связь, содержащая -МО, а с другой — атом с неподеленной электронной
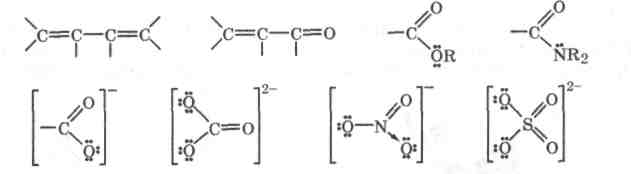
Сопряжение связей - это взаимодействие л-электронов одной связи с -электронами соседних связей ( , -сопряжение) или с неподеленной электронной парой соседнего атома, находящейся на р-орбитали (р, -сопряжение ), с образаванием единой делокализованной -молекулярной орбитали, охватывающей все эти атомы в молекуле или ионе.
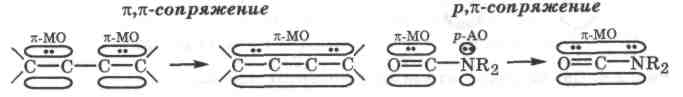
В результате сопряжения -связь становится многоцентровой, так как электронная плотность делокализованной -МО, которая описывает движение образующих ее электронных пар, распределяется между несколькими атомными центрами, что в формулах соответствующих частиц схематично отражается пунктиром:
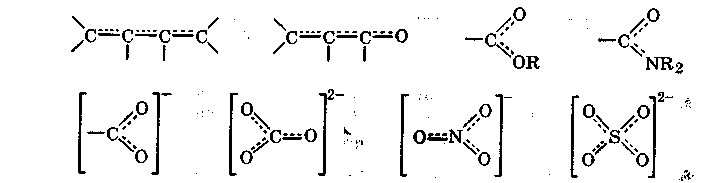
Особенно большую роль сопряжение связей играет в молекуле бензола С6Н6, имеющей плоскую циклическую структуру и содержащей три двойные связи, чередующиеся с тремя простыми связями. Вследствие сопряжения шести л-электронов в молекуле бензола образуется единая замкнутая -МО, равномерно охватывающая все атомы углерода. В результате все связи между атомами углерода оказываются идентичными, с длиной 139 пм (рис. 2.4.).
Бензол относится к ароматическим соединениям. Молекулы таких соединений имеют плоские циклические (замкнутые) сопряженные системы, причем цикл может состоять не только из
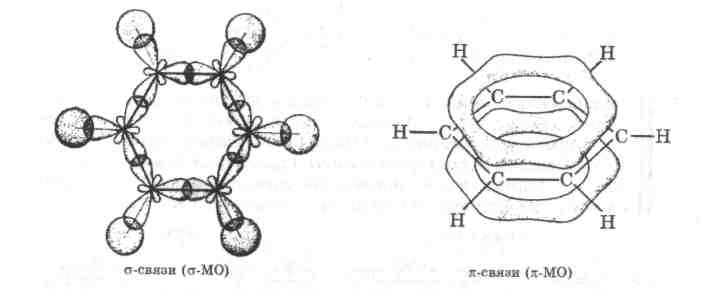
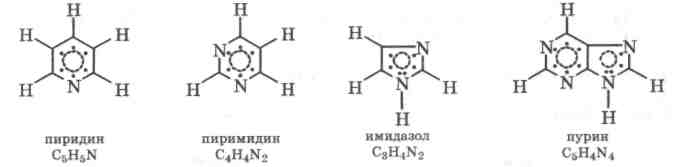
Таким
образом, ароматическими называются
такие ненасыщенные плоские циклические
соединения, у которых все атомы цикла
принимают участие в образовании единой
замкнутой ![]() -электронной
системы (л-МО) за счет сопряжения
ковалентных связей в молекуле.
-электронной
системы (л-МО) за счет сопряжения
ковалентных связей в молекуле.
П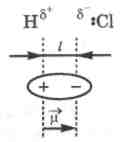 олярность
ковалентной связи. Ковалентная
связь бывает полярной и неполярной.
Неполярная
ковалентная связь образуется
между атомами элементов, имеющих
одинаковую электроотрицательность.
В этом случае электронная плотность
молекулярной орбитали распределена
абсолютно симметрично вокруг ядер
соединяющихся атомов. Неполярная связь
имеет место прежде всего в молекулах
простых веществ: О2, N2, С12,
а также между одинаковыми атомами в
симметричных молекулах (Н3С—СН3, Н2С=СН2,
НО—ОН, H2N—NH2).
олярность
ковалентной связи. Ковалентная
связь бывает полярной и неполярной.
Неполярная
ковалентная связь образуется
между атомами элементов, имеющих
одинаковую электроотрицательность.
В этом случае электронная плотность
молекулярной орбитали распределена
абсолютно симметрично вокруг ядер
соединяющихся атомов. Неполярная связь
имеет место прежде всего в молекулах
простых веществ: О2, N2, С12,
а также между одинаковыми атомами в
симметричных молекулах (Н3С—СН3, Н2С=СН2,
НО—ОН, H2N—NH2).
Полярная
ковалентная связь образуется
между атомами разных элементов,
отличающихся электроотрицательностью.
В этом случае электронная плотность
молекулярной орбитали общей электронной
пары смещена к более электроотрицательному
элементу, что приводит к появлению
на атоме этого элемента частично
отрицательного заряда ![]() -,
а на другом атоме - частично положительного
заряда
+, например в молекуле НСl.
Эта молекула представляет собой диполь,
так как центры распределения положительных
и отрицательных зарядов не совпадают
и находятся на некотором расстоянии l.
-,
а на другом атоме - частично положительного
заряда
+, например в молекуле НСl.
Эта молекула представляет собой диполь,
так как центры распределения положительных
и отрицательных зарядов не совпадают
и находятся на некотором расстоянии l.
Мерой
полярности связи служит дипольный
момент ![]() =
• I,
где
- заряд полюса диполя,
=
• I,
где
- заряд полюса диполя,
а I - длина диполя. Дипольный момент - величина векторная, причем за положительное направление обычно принимают направление от + к -. Единицей измерения полярности связи является Дебай (Д): 1Д = 3,3 * 10-30 Кл * м.
Полярность отдельных связей равна:
![]()
Для двухатомных молекул величина диполъного момента связи является мерой полярности молекул в целом. Для многоатомных молекул дипольный момент равен векторной сумме дипольных моментов отдельных связей.
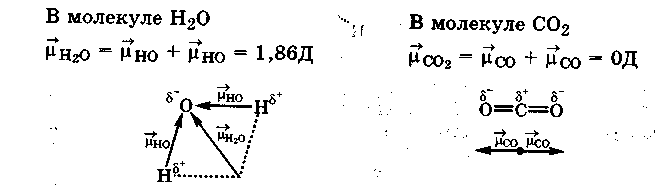
Таким образом, молекула будет полярной, если она содержит полярные связи и имеет несимметричную структуру, при которой центры распределения положительных и отрицательных зарядов в молекуле не совпадают.
Значения дипольного момента как связи, так и молекулы являются важными характеристиками их реакционной способности. Как правило, чем больше полярность системы, тем выше ее реакционная способность. Сильнополярная ковалентная связь под действием полярных молекул растворителя способна к гетеролитическому разрыву с образованием ионов; например, НСl - сильная кислота, так как ее молекулы в водных растворах полностью диссоциированы на ионы:
![]()
Вещества, молекулы которых полярны, обычно имеют более высокие температуры плавления и кипения, чем вещества с приблизительно той же молекулярной массой, молекулы которых неполярны.
Поляризуемость ковалентной связи. Наряду с полярностью связи или молекулы очень важное значение имеет понятие поляризуемость связи.
Поляризуемость химической связи - это способность электронной плотности этой связи смещаться под действием внешнего электрического поля или других воздействий.
Внешним
электрическим полем относительно данной
частицы может быть электрическое
поле соседней полярной молекулы или
соседнего иона. Во всех типах молекул
- полярных и иеполярных, а также в атомах
и ионах под действием внешнего
электрического поля происходит смещение
электронной плотности молекулярной
или атомной орбитали, в результате
возникает наведенный, или индуцированный,
дипольный момент. Индуцированный диполь,
хотя и существует только при наличии
внешнего электрического поля, может
вызывать резкое изменение реакционной
способности отдельных связей и молекулы
в целом. Поляризуемость связи зависит
от подвижности общей электронной пары.
Так, в молекуле HI
подвижность общей электронной пары,
а следовательно, и поляризуемость связи
значительно больше, чем в молекуле HF,
и поэтому связь HI
под действием полярных молекул воды
значительно легче диссоциирует на ионы,
чем связь HF.
Именно поэтому кислота HI
относится к сильным, а кислота HF
- к слабым кислотам, несмотря на более
высокую полярность молекулы HF
(![]() hf
= =
1,5Д;
HI
= 0,4Д). Этот пример наглядно показывает
влияние поляризуемости ковалентной
связи на ее реакционную способность.
hf
= =
1,5Д;
HI
= 0,4Д). Этот пример наглядно показывает
влияние поляризуемости ковалентной
связи на ее реакционную способность.
С поляризуемостью связи тесно связано понятие о поляризуемости атома, молекулы или иона, т. е. способности этих частиц трансформировать свои электронные оболочки под внешним воздействием. Поляризуемость атома, молекулы или иона прежде всего зависит от их размера и числа электронов. Чем меньше размер и число электронов у частицы, тем менее она поляризуема. Большие частицы с большим числом электронов будут легче поляризоваться. В зависимости от способности поляризоваться атомы, молекулы или ионы подразделяют на мягкие — легкополяризуемые частицы и жесткие - малополя-ризуемые частицы.
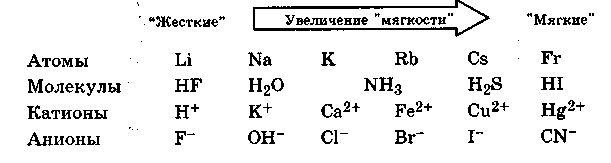
Понятие о "жесткости" и "мягкости" частиц важно при рассмотрении их реакционной способности в различных процессах. В соответствии с общим принципом "подобное с подобным" наиболее эффективно взаимодействуют "жесткие" частицы с "жесткими", а "мягкие" - с "мягкими". Особенно наглядно это проявляется в химии комплексных соединений (разд. 10.3).
