
- •Оглавление
- •Глава 1 16
- •Глава 2 химическая связь 33
- •Глава 3 54
- •Глава 4 82
- •Глава 5 110
- •Глава 6 141
- •Глава 7 173
- •Глава 8 196
- •Глава 9 234
- •Глава 10 комплексные соединения и их свойства 272
- •Глава 11 297
- •Глава 12 316
- •Глава 13 377
- •Глава 14 400
- •Глава 15 основные понятия органической химии 419
- •Глава 16 445
- •Глава 17 474
- •Глава 18 499
- •Глава 19 518
- •Глава 20 562
- •Глава 21 аминокислоты, пептиды и белки 578
- •Глава 22 620
- •Глава 23 651
- •Глава 24 692
- •Глава 25 709
- •Глава 26 740
- •Глава 27 771
- •От автора
- •Глава 1 строение атома, периодический закон и периодическая система элементов д. И. Менделеева
- •1.1. Строение атома
- •1.1.1. Квантовые числа
- •1.1.2. Принципы заполнения атомных орбиталей электронами
- •1.2. Периодический закон и периодическая система элементов д. И. Менделеева
- •1.3. Основные характеристики атомов элементов
- •1.3.1. Радиус атома
- •1.3.2. Энергия ионизации
- •1.3.3. Энергия сродства к электрону
- •1.3.4. Относительная электроотрицательность
- •Глава 2 химическая связь
- •2.1. Ковалентная связь
- •2.1.1. И молекулярные орбитали
- •2.1.2. Механизмы возникновения ковалентной связи
- •2.1.3. Особенности ковалентной связи
- •2.2. Ионная связь
- •2.3. Металлическая связь
- •Глава 3 межмолекулярные взаимодействия и агрегатное состояние вещества
- •3.1. Межмолекулярные взаимодействия
- •3.2. Агрегатное состояние вещества
- •3.2.1. Твердое состояние
- •3.2.2. Жидкое состояние
- •3.2.3. Жидкокристаллическое состояние
- •3.2.4. Паро- и газообразное состояния
- •Глава 4 основы химической термодинамики и биоэнергетики
- •4.1. Основные понятия термодинамики
- •4.2. Первый закон термодинамики
- •4.3. Понятие о самопроизвольных процессах.
- •4.4. Второй закон термодинамики. Энергия гиббса
- •4.5. Принцип энергетического сопряжения биохимических реакций
- •Г лава 5 основы кинетики биохимических реакций и химического равновесия
- •5.1. Основные понятия и терминология раздела
- •5.2. Факторы, влияющие на скорость гомогенных реакций
- •5.2.1. Влияние природы реагирующих веществ
- •5.2.2. Влияние концентрации реагентов.
- •5.2.3. Влияние температуры. Энергия активации
- •5.2.4. Влияние катализатора
- •5.3. Особенности кинетики гетерогенных реакций
- •5.4. Особенности кинетики цепных реакций
- •5.5. Химическое равновесие
- •5.5.1. Смещение химического равновесия
- •5.6. Ферментативный катализ и его особенности
- •5.7. Автоколебательные биохимические процессы
- •Г лава 6 растворы и их коллигативные свойства
- •6.1. Вода как растворитель и ее роль в жизнедеятельности организма
- •6.2. Термодинамика процесса растворения
- •6.З. Способы выражения концентрации растворов
- •6.4. Коллигативные свойства растворов
- •6.4.1. Диффузия
- •6.4.2. Осмос. Осмотическое и онкотическое давление
- •6.4.3. Давление насыщенного пара над раствором
- •6.4.4. Температура кипения и замерзания раствора
- •Глава 7 растворы электролитов и ионные равновесия
- •7.1. Электролитическая диссоциация
- •7.2. Равновесие в растворах слабых электролитов
- •7.2.1. Влияние общего иона и противоиона на равновесие
- •7.2.2. Взаимосвязь константы диссоциации и степени диссоциации
- •7.3. Особенности растворов сильных электролитов. Ионная сила раствора
- •7.4. Электролитическая диссоциация и ионное произведение воды
- •7.5. Водородный и гидроксильный показатели (рН и рОн)
- •7.6. Физико-химические основы водно-электролитного баланса в организме
- •Г лава 8 теория кислот и оснований и протолитические равновесия
- •8.1. Протолитическая теория кислот и оснований
- •8.2. Кислотно-основные свойства а-аминокислот
- •8.3. Важнейшие кислотно-основные реакции
- •8.3.1. Гидролиз солей
- •8.3.2. Реакции нейтрализации
- •8.3.3. Общая, активная и потенциальная кислотность растворов
- •8.4. Протолитический баланс. Буферные растворы и их свойства
- •8.5. Буферные системы организма, их взаимодействие, явления ацидоза и алкалоза
- •9.1. Основные понятия и факторы, влияющие на протекание окислительно-восстановительных реакций
- •9.2. Направление протекания окислительно-восстановительных реакций
- •9.3. Особенности биохимических окислительно-восстановительных процессов в организмах
- •9.3.1. Степень окисления углерода в органических соединениях
- •9.3.2. Биохимические реакции внутри- и межмолекулярной окислительно-восстановительной дисмутации за счет атомов углерода
- •9.3.3. Окислительно-восстановительные превращения кофакторов и коферментов оксидоредуктаз
- •9.3.4. Электронотранспортные цепи
- •9.3.5. Дегидрогеназное окисление-восстановление
- •9.3.6. Окислительное фосфорилирование
- •9.3.7. Фотофосфорилирование
- •9.3.8. Оксигеназное окисление-восстановление
- •9.3.9. Свободнорадикальное окисление и антиоксидантная система организма
- •9.4. Использование окислителей и восстановителей в медико-санитарной практике
- •Глава 10 комплексные соединения и их свойства
- •10.1. Основные понятия и терминология
- •10.2. Химическая связь в комплексных соединениях и особенности их строения
- •10.3. Химические свойства комплексных соединений
- •10.4. Медико-биологическая роль комплексных соединений
- •10.5. Металлолигандный баланс и его нарушения
- •10.6. Комплексонометрия
- •Глава 11 гетерогенные процессы и равновесия в растворах
- •11.1. Основные понятия и теоретические основы
- •11.2. Гетерогенные равновесия в растворах, связанные с процессом кристаллизации
- •11.3. Гетерогенные равновесия в растворах, связанные с процессом расслоения
- •11.4. Гетерогенные равновесия в живых системах
- •Глава 12 химия элементов-органогенов
- •12.2. Строение, химические свойства и роль элементов-органогенов и их соединений в растительном и животном мире
- •12.2.1. Водород и его соединения
- •12.2.2. Углерод и его соединения
- •12.2.3. Азот и его соединения
- •12.2.4. Фосфор и его соединения
- •12.2.5. Кислород и его соединения
- •12.2.6. Сера и ее соединения
- •12.3. Строение и химические свойства галогенов и их соединений
- •Глава 13 химия ионов металлов жизни и их роль в растительном и животном мире
- •13.1. Химия ионов s-металлов в организме
- •13.1.1. Натрий и калий
- •13.1.2. Магний и кальций
- •13.2. Химия ионов d-металлов в организме
- •13.2.1. Марганец
- •13.2.2. Железо и кобальт
- •13.2.3. Медь
- •13.2.4. Цинк
- •13.2.5. Молибден
- •Глава 14 химия и анализ загрязнений окружающей среды
- •14.1. Химия загрязнений атмосферы
- •14.1.1. Токсический смог
- •14.1.2. Фотохимический смог
- •14.1.3. Кислотные дожди
- •14.1.4. Загрязнение атмосферы другими токсикантами
- •14.1.5. Разрушение озонового слоя
- •14.2. Методы анализа токсикантов и методы снижения их поступления в атмосферу
- •14.3. Загрязнение гидросферы. Понятие об общих показателях, характеризующих природные и сточные воды
- •Глава 15 основные понятия органической химии
- •15.1. Основы классификации и номенклатуры органических соединений
- •15.2. Пространственная структура биоорганических молекул и виды изомерии
- •15.3. Понятие о взаимном влиянии атомов в молекуле и электронные эффекты
- •15.4. Классификация органических реакций и их компонентов
- •Г лава 16 алифатические и ароматические углеводороды
- •16.1. Строение и реакционная способность алканов
- •16.2. Строение и реакционная способность ненасыщенных углеводородов: алкенов и диенов
- •16.3. Ароматические углеводороды (арены)
- •Глава 17 спирты, фенолы, простые эфиры, тиолы и сульфиды
- •17.2. Физико-химические свойства спиртов и фенолов
- •17.3. Химические свойства спиртов
- •17.4. Химические свойства фенолов
- •17.5. Простые эфиры
- •17.6. Тиолы и сульфиды
- •Г лава 18 альдегиды, кетоны и их производные
- •18.1. Строение, номенклатура и физико-химические свойства альдегидов и кетонов
- •18.2. Химические свойства альдегидов и кетонов
- •18.2.1. Кислотно-основные свойства
- •18.2.2. Электрофильно-нуклеофильные свойства
- •18.2.3. Окислительно-восстановительные свойства
- •18.2.4. Комплексообразующие свойства
- •18.3. Альдегиды и кетоны в окружающей среде
- •Г лава 19 карбоновые кислоты и их функциональные производные
- •19.2. Химические свойства предельных кислот и их производных
- •19.2.1. Кислотно-основные свойства
- •19.2.2. Карбоновые кислоты как ацилирующие реагенты
- •19.2.3. Производные карбоновых кислот, их свойства и взаимные превращения
- •19.2.4. Окислительно-восстановительные свойства карбоновых кислот и их производных
- •19.3. Особенности свойств замещенных карбоновых кислот и их производных
- •19.3.1. Дикарбоновые кислоты
- •19.3.2. Гидроксикарбоновые кислоты
- •19.3.3. Оксокарбоновые кислоты
- •19.3.4. Ненасыщенные карбоновые кислоты
- •19.4. Основные реакции метаболизма карбоновых кислот
- •19.4.1. Биосинтез жирных кислот
- •1 9.4.2. Биологическое окисление жирных кислот
- •19.4.3. Реакции цикла кребса
- •19.5. Кислоты ароматического ряда и их производные как лекарственные средства
- •Г лава 20 Липиды
- •20.1. Жиры и воски
- •20.2. Омыляемые сложные липиды
- •20.3. Неомыляемые липиды - низкомолекулярные биорегуляторы
- •Глава 21 аминокислоты, пептиды и белки
- •21.1. Строение, классификация и физико-химические свойства а-аминокислот
- •21.2. Химические свойства а-аминокислот
- •21.2.1. Кислотно-основные свойства и прототропная таутомерия
- •21.2.2. К0мплекс00бразующие свойства
- •21.2.3. Электрофильно-нуклеофильные свойства
- •21.2.4. Окислительно-восстановительные свойства
- •21.3. Структура и свойства пептидов
- •21.4. Структура и свойства белков
- •Глава 22 углеводы и полисахариды
- •22.1. Строение, изомерия и свойства моносахаридов
- •22.1.1. Химические свойства моносахаридов и их производных
- •22.1.2. Катаболизм глюкозы - гликолиз
- •22.3. Полисахариды, их структура и свойства
- •22.3.1. Гомополисахариды
- •22.3.2. Гетерополисахариды, протеогликаны, гликопротеины
- •Г лава 23 биологически важные азотсодержащие соединения
- •23.1. Электронные состояния атома азота в его соединениях и свойства этих соединений
- •23.2. Роль аммиака для живых организмов и пути его обезвреживания. Цикл мочевины и ее свойства
- •23.3. Азотсодержащие ароматические гетероциклические соединения
- •23.4. Нуклеозиды, нуклеотиды и нуклеиновые кислоты, их структура и свойства
- •Г лава 24 электрохимия. Электрическая проводимость растворов электролитов
- •24.1. Электрическая подвижность ионов в растворе
- •24.2. Удельная электрическая проводимость растворов электролитов
- •24.3. Молярная электрическая проводимость растворов электролитов
- •24.4. Закон независимого движения ионов в разбавленных растворах (закон кольрауша)
- •24.5. Кондуктометрические методы анализа
- •24.5.1. Кондуктометрическое титрование
- •24.6. Электрическая проводимость биологических объектов в норме и патологии
- •Г лава 25 межфазные электрические потенциалы, гальванические цепи, потенциометрия
- •25.1. Возникновение двойного электрического слоя и виды электрических потенциалов
- •25.2. Электродный потенциал. Стандартный водородный электрод. Гальванические цепи. Уравнение нернста
- •25.3. Восстановительный потенциал
- •25.4. Диффузионный потенциал
- •25.5. Мембранный потенциал
- •25.6. Потенциометрия
- •25.6.1. Хлорсеребряный электрод сравнения
- •25.6.2. Ионо- и молекулярноселективные электроды определения
- •25.6.3. Потенциометрическое титрование
- •Глава 26 физико-химические основы поверхностных явлений
- •26.1. Свободная поверхностная энергия
- •26.2. Сорбция и ее виды
- •26.3. Абсорбция
- •26.4. Адсорбция
- •26.4.1. Адсорбция на неподвижной поверхности раздела фаз
- •26.4.2. Молекулярная адсорбция из растворов на твердых адсорбентах
- •26.4.3. Адсорбция ионов из растворов
- •26.4.4. Ионообменная адсорбция
- •26.5. Адсорбция на подвижной поверхности раздела фаз
- •26.6. Поверхностно-активные вещества
- •26.7. Хроматография
- •Глава 27 физикохимия дисперсных систем
- •27.2. Лиофобные коллоидные растворы
- •27.2.1. Строение мицелл в лиофобных коллоидных растворах
- •27.2.2. Свойства лиофобных коллоидных растворов
- •27.2.3. Влияние высокомолекулярных соединений на устойчивость лиофобных коллоидов. Флокуляция
- •27.3. Лиофильные коллоидные растворы
- •27.3.1. Строение мицелл пав и вмс в водных коллоидных растворах в зависимости от их концентрации
- •27. 3. 2. Получение и свойства лиофильных коллоидных растворов
- •27.3.3. Моющее действие растворов пав
- •27.3.4. Особенности растворов биополимеров
- •27.4. Структурообразование в растворах вмс. Возникновение связнодисперсных систем и их свойства
- •27.5. Грубодисперсные системы
- •27.5.1. Суспензии
- •27.5.2. Эмульсии
- •27.5.3. Аэрозоли
- •27.6. Электрокинетические явления в дисперсных системах
- •27.7. Ткани организма - дисперсные системы
- •27.7.1. Строение и свойства межклеточных мембран
- •27.7.2. Кровь - сложная дисперсная система
- •Приложение 1 применение осмолярной и осмоляльной концентраций в практической медицине
Г лава 18 альдегиды, кетоны и их производные
После изучения этой главы вы должны знать:
строение, классификацию, изомерию и номенклатуру альдегидов и кетонов;
кислотно-основные, электрофильно-нуклеофильные, окислительно-восстановительные и комплексообразующие свойства альдегидов и кетонов;
прототропные таутомерные равновесия: кетоенольное и иминиминное, а также кольчато-цепную таутомерию.
18.1. Строение, номенклатура и физико-химические свойства альдегидов и кетонов
Молекулы
альдегидов и кетонов содержат карбонильную
группу
![]() ,
называемую также оксогруппой
или
прост карбонилом.
В
альдегидах карбонильная группа находится
на конце углеродной цепи и с ней связаны
алкильный или арильный заместитель и
водородный атом. Общая формула альдегидов
,
называемую также оксогруппой
или
прост карбонилом.
В
альдегидах карбонильная группа находится
на конце углеродной цепи и с ней связаны
алкильный или арильный заместитель и
водородный атом. Общая формула альдегидов
![]()
В
кетонах карбонильная группа находится
в середине углеродной цепи и с ней
связаны два алкильных или арильных
заместителя. Общая формула кетонов![]()
Для альдегидов и кетонов широко используются как тривиальные, так и систематические названия. Тривиальные названия альдегидов производятся от названий соответствующих карбоно-вых кислот с добавлением слова альдегид. По систематической номенклатуре ИЮПАК название альдегидов состоит из названия главной углеводородной цепи с суффиксом -аль.

Если альдегидная группа не входит в главную цепь из-за наличия в молекуле старших групп, то она обозначается префиксом формил- и цифрой, указывающей ее местоположение:
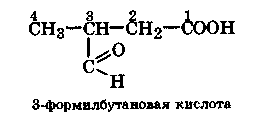
Т ривиальные
названия кетонов обычно представляют
сочетание названий алкильных групп
со словом "кетон". По систематической
номенклатуре ИЮПАК название кетона
состоит из названия главной углеродной
цепи с суффиксом -он
и
цифры, указывающей номер углеродного
атома карбонильной группы, помещаемой
перед суффиксом -он:
ривиальные
названия кетонов обычно представляют
сочетание названий алкильных групп
со словом "кетон". По систематической
номенклатуре ИЮПАК название кетона
состоит из названия главной углеродной
цепи с суффиксом -он
и
цифры, указывающей номер углеродного
атома карбонильной группы, помещаемой
перед суффиксом -он:
При наличии в главной цепи более старшей группы кетонная группа обозначается префиксом оксо- и цифрой, указывающей ее положение:
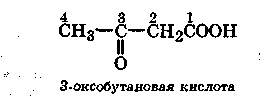 -
-
Физико-химические свойства. В карбонильной группе двойная связь сильнополярна (дипольный момент µ = 2,5 Д), так как ее общие электроны смещены к более электроотрицательному атому кислорода. Этот сдвиг электронов вызывает появление на кислородном атоме частичного отрицательного (5-), а на карбонильном атоме углерода — частичного положительного заряда (5+).
За исключением формальдегида, который при нормальных условиях является газом, остальные представители гомологических рядов альдегидов и кетонов находятся в жидком или твердом состоянии. Так как альдегиды и кетоны - полярные соединения, то между их молекулами имеет место диполь-дипольное (ориентационное) взаимодействие (разд. 3.1). Поэтому альдегиды и кетоны имеют более высокие температуры кипения, чем углеводороды с близкой молекулярной массой. В то же время их температуры кипения значительно ниже, чем у близких по молекулярной массе спиртов, так как в отличие от последних они не ассоциированы за счет водородных связей.
18.2. Химические свойства альдегидов и кетонов
Реакционные
центры альдегидов и кетонов обусловлены
наличием в их молекулах карбонильной
группы. Группа![]() содержит
атомы углерода и кислорода в состоянии
sр2-гиориди-зации,
поэтому их
-связь и две другие
-связи,
образованные карбонильным атомом
углерода, лежат в одной плоскости, а
л-связь,
образованная за счет бокового перекрывания
негибридизованных р-орбиталей атомов
углерода и кислорода, перпендикулярна
ей. Двойная связь С=0 по сравнению со
связью С=С является одновременно и более
реакционноспособной, и более прочной,
что обусловлено ее высокой полярностью.
В то же время карбонильная группа
имеет и высокую поляризуемость. Это
означает, что имеющиеся на атомах
карбонильной группы значительные
эффективные заряды
содержит
атомы углерода и кислорода в состоянии
sр2-гиориди-зации,
поэтому их
-связь и две другие
-связи,
образованные карбонильным атомом
углерода, лежат в одной плоскости, а
л-связь,
образованная за счет бокового перекрывания
негибридизованных р-орбиталей атомов
углерода и кислорода, перпендикулярна
ей. Двойная связь С=0 по сравнению со
связью С=С является одновременно и более
реакционноспособной, и более прочной,
что обусловлено ее высокой полярностью.
В то же время карбонильная группа
имеет и высокую поляризуемость. Это
означает, что имеющиеся на атомах
карбонильной группы значительные
эффективные заряды
![]() могут
быть дополнительно увеличены под
действием внешних факторов, включая
воздействие атакующих реагентов.
могут
быть дополнительно увеличены под
действием внешних факторов, включая
воздействие атакующих реагентов.
Вызванное электроноакцепторным влиянием атома кислорода смещение электронной плотности в молекулах альдегидов и кетонов способствует формированию в них трех реакционных центров, представленных на схеме:
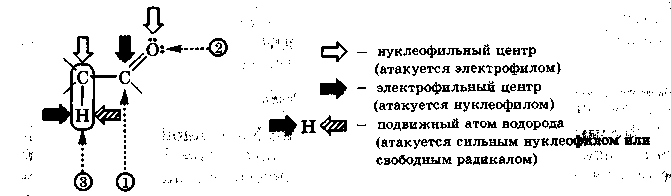
Наличие электронодефицитного углеродного атома карбонильной группы формирует электрофильный центр (1), склонный к нуклеофильной атаке реагента. Местом электрофильной атаки служит нуклеофильный (основный) центр (2) на кислородном атоме карбонильной группы. Кроме того, в альдегидах и кетонах имеется слабый СН-кислотный центр (3) в -положении к карбонильной группе, содержащий водородный атом со слабой протонной подвижностью и склонный к атаке свободным радикалом.
Реакционная способность альдегидов, как правило, выше, чем кетонов, так как у них больше пространственная доступность реакционного центра на карбонильном атоме углерода, больше эффективный положительный заряд на этом атоме, а в то же время степень его окисления меньше, чем в кетонах. Последнее обстоятельство повышает его склонность к окислительно-восстановительным превращениям, включая его дисмутацию.
