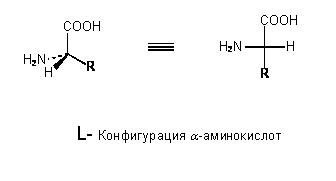- •Лекция №2. Основные этапы развития биосферы на Земле
- •Лекция №3. Наследование групп крови, резус-фактор. Молекулярные машины.
- •Результаты опроса.
- •Наследование групп крови резус
- •Аминокислотная последовательность резус-белка человека
- •Последовательность нуклеотидов кодирующей части гена резус-белка человека
- •Молекулярные машины.
- •Двигатель бактерий
- •Литература по теме лекции:
- •Более подробно
- •Лекция №5. Синтез днк, рнк и белков
- •Репликация днк
- •Транскрипция
- •Трансляция
- •Лекция №6. Структура биологии как науки. Ранние этапы эволюции жизни.
- •Ранние этапы эволюции жизни
- •Биогеохимические циклы
- •Лекция №7. Строение и функции прокариотической клетки
- •Строение клетки прокариот
- •Фотосинтез и азотфиксация
- •Где живут бактерии
- •Симбионты и паразиты человека
- •Вирус иммунодефицита человека
- •Вероятность заражения вич при однократном воздействии
- •Защитные средства.
- •Небактериальные инфекции урогенитального тракта
- •Литература
- •Лекция №8. Поведение бактерий
- •Дополнительный материал. Ориентация в пространстве одноклеточных и многоклеточных эукариот
- •Структура генома прокариот
- •Что удается узнать о бактериях по их геному. Состав генома (какие гены присутствуют)
- •Ориентация генов (направление транскрипции)
- •Минимальный набор генов живой клетки
- •Гомологичные гены и копийность генов
- •Изменение функции гена в процессе эволюции
- •Литература:
- •Лекция №9. Обзорная лекция по эволюции животных
- •Логика зоологии
- •1. Кто такие животные (чем животные отличаются от растений).
- •2. Биологическая систематика.
- •3. Простейшие.
- •4. Тип кишечнополостные.
- •5. Радиально-симметричные животные.
- •6. Тип Плоские черви.
- •7. Тип Круглые черви или Нематоды.
- •8. Тип Кольчатые черви.
- •9. Тип Моллюски.
- •10. Тип Членистоногие.
- •11. Пищевые ресурсы палеозоя.
- •12. Завоевание суши.
- •13. Насекомые.
- •14. Механизм преадаптации.
- •15. Вторичноротые.
- •16. Тип Хордовые.
- •17. Позвоночные, этапы большого пути.
- •Лекция №10. Обзорная лекция по эволюции растений
- •Лекция №11. Кооперативные процессы в эволюции
- •Лекция №12. Процессы кооперации в социальной эволюции
- •Возвращение блудного сына Рембрандт Харменс ван Рейн (1606-1669), 1668/69, Голландия
- •Возвращение блудного сына и.П. Чернов 1795 г.
- •Эволюция социальной организации у человека
- •Лекция №13. Строение эукариотической клетки
- •Лекция №14. Популяционная динамика
- •Лекция №15. Митоз, мейоз, гаметогенез, оплодотворение и эмбриональное развитие
- •Краткий обзор этапов гаметогенеза
- •Гомеозисные гены
- •Лекция №16. Основные принципы наследования и наследственности
- •Лекция №17. Связь генотипа и фенотипа: варианты проявления менделевских закономерностей
- •Лекция №19. Геномика
- •Лекция №20. Геномика (часть 2)
- •Альтернативный сплайсинг, биологическая роль и механизмы
- •Механизм сплайсинга
- •Классификация генов по их функциям
- •Лекция №21. Изменение популяционных частот аллелей у человека в различной природной и культурной среде
- •Генетическое разнообразие современного человечества
- •Адаптация к геоклиматическим факторам
- •Адаптация к особенностям питания и типу хозяйства
- •Инфекции как фактор отбора
- •Генетическая детерминация химических зависимостей
- •Лекция №22. Экология
- •Лекция №23. Нейробиология и генетика поведения
- •Лекция №25. Биоинформатика
- •(Доказать!)
- •Множественное выравнивание
- •Предсказания вторичной структуры рнк
- •Исследование консервативности альтернативного сплайсинга, или Почему мышь не стала человеком?
- •Альтернативный сплайсинг
- •Частота альтернативного сплайсинга
Двигатель бактерий
Перейдем к работе следующего молекулярного мотора – жгутика у бактерии.
Известно, что не все, но некоторые бактерии могут двигаться. Для того, чтобы двигаться, они вертят хвостом, т.е. жгутиком. Если жгутиков несколько, то во время вращения они сплетаются в единый жгут, и вращаются, двигая бактерию, примерно как лопасти у катера (рис. 13).
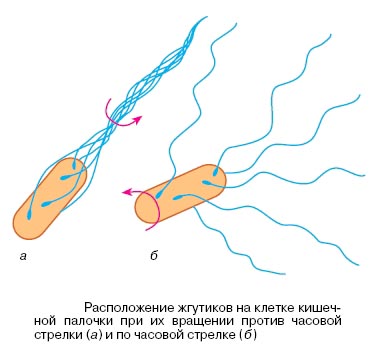
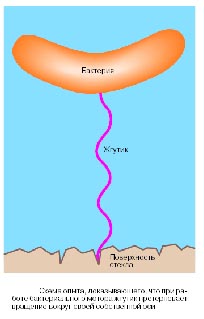
Жгутик очень маленький, в световой микроскоп его трудно увидеть. Для того, чтобы проверить, действительно ли жгутик вращается при движении бактерии, бактериальную клетку за жгутик прикрепили к стеклу (рис. 14). В раствор добавили вещество, которое она любит, например, сахар, и она начала вертеться, потому что она явно хотела добраться до сахара, если не добавляли, то она вела себя более спокойно.
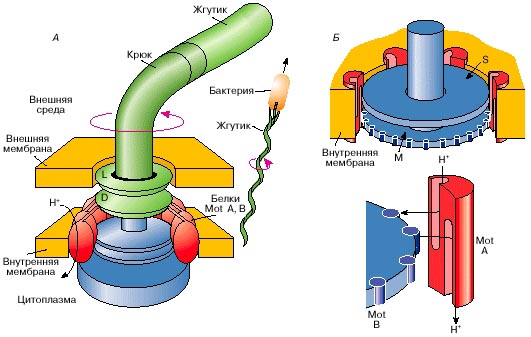
Для того, чтобы жгутик вращался, в его основании находится так называемое базальное тело, которое представляет собой электромотор (рис. 15). Его задача заключается в том, чтобы крутить жгутик. На рисунке изображена мембрана бактериальной клетки (желтая), и части мотора статор (синий) и ротор (зеленый). К ротору прикручен жгутик. Пока неизвестно, как именно передается движение, но в этой молекулярной машине есть свои подшипники, своя молекулярная смазка, и есть белок, в котором, также как и в АТФ-синтазе, имеются два протонных полуканала, смещенных друг относительно друга. И принцип вращения такой же: зарядка-перезарядка группы COOH в аминокислотах. Число протонов, которые должны «провалиться» в канал за время одной прокрутки жгутика,- порядка тысячи; остальные параметры приведены ниже

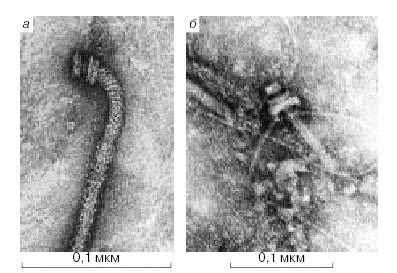
Вот микрофотография жгутика и молекулярного мотора в основании этого жгутика.
В лекции использованы рисунки из Соросовского образовательного журнала.
Литература по теме лекции:
Соросовский образовательный журнал journal.issep.rssi.ru
Скулачев В.П. Законы биоэнергетики// СОЖ 1997, №1, с. 9-14.
Скулачев В.П. Электродвигатель бактерий. // СОЖ 1998, №9, с. 2-7.
Виноградов А.Д. Преобразование энергии в митохондриях // СОЖ 1999, №9, с. 11-19.
Тихонов А.Н.Молекулярные преобразователи энергии.// СОЖ. 1997, № 7, с. 10-17.
Тихонов А.Н. Молекулярные моторы. Часть 1. Вращающиеся моторы живой клетки // СОЖ. 1999, №6, с. 8-16
В.П.Скулачев Рассказы о биоэнергетике. Серия "Эврика". М. 1982.
Более подробно
Уайт А., Хендлер Ф., Смит Р. и др. Основы биохимии. М.: Мир, 1981.
Скулачев В.П. Аккумуляция энергии в клетке. М.: Наука, 1969.
Скулачев В.П. Мембранные преобразователи энергии. М.: Высш. шк., 1989.
Скулачев В.П. Энергетика биологических мембран. М.: Наука, 1989.
Албертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. 2-е изд. М.: Мир, 1994. Т. 1.
Николс Д.Д. Биоэнергетика: Введение в хемиосмотическую теорию. М.: Мир, 1985.
Лекция №4. Строение биополимеров Тема нашей сегодняшней лекции - биополимеры. Для того, чтобы выяснить, как устроены молекулы, образующие клетки, какова структура молекул, где они находятся в клетке, мы сначала вспомним строение клетки. Вспомнив, из чего состоит живая клетка, и какие функции выполняют те или иные органеллы, мы сможем заполнить следующую табличку. Оказывается, можно провести интересную аналогию с элементами, выполняющими схожие функции у живых организмов и государств. Выделим следующие функции:
За внешнюю защиту у клеток отвечает клеточная мембрана; у организмов – кожа, когти, перья, шерсть; у государств – погранвойска. Внутреннюю защиту клеткам обеспечивает система рестрикции- модификации. Для примера приведем бактериальную клетку. У нее есть специальные ферменты – рестриктазы (в пер. с англ. «ограничивать»), которые разрезают чужеродную ДНК. На собственных ДНК есть специальные химические метки, чтобы рестриктазы смогли их распознать. У организмов в качестве внутренней защиты существует иммунная система, а у государства – МВД, ФСК. Структурные и функциональные аналогии в строении различных систем
Обеспечением энергией в животных клетках занимаются митохондрии, а в растительных – хлоропласты, в организмах – пищеварительная и дыхательная системы, в государстве же – организации типа Газпрома и АЭС. Обеспечение клетки веществами идет благодаря трансмембранным каналам, лизосомам, в организме – пищеварительной системе, а в государстве – сельскохозяйственной и др. промышленности. Хранение и воспроизведение информации на клеточном уровне идет в ядре посредством ДНК, в организме эту функцию имеет мозг, центральная нервная система, в стране – школы, библиотеки, культура, искусство. Транспортируются вещества в клетке благодаря эндоплазматической сети, в организме – желудочно-кишечному тракту, дыхательной системе, крови; в стране – нефте- и газопроводам, транспорту. Что же касается передачи информации, то в клетке этим занимается матричная РНК; в организме – нервы и гормоны (нервно-гуморальная система). Причем хочется отметить, что нервную систему можно сравнить с адресной доставкой (человек может получить письмо лично, и никто больше об этом не узнает), то есть по нервам можно доставить информацию очень точно к определенной мышце или определенному органу. А гормональную систему можно сравнить со СМИ, то есть она работает как система всеобщего оповещения. В государстве за информацию отвечают почта, телефонная сеть, Интернет и др. Мы провели аналогию с хорошо известными вам системами (организм и государство), чтобы иметь более абстрактное представление о строении клетки. В таблице добавлены индийские касты. Касты возникли, как структуры, фиксирующие функциональные особенности разных слоев населения. Кшатрии (воины) выполняют функции защиты; шудры (торговцы и ремесленники) – обеспечения питанием и энергией; брахманы (жрецы) – хранения и воспроизведения информации, вайшьи (торговцы) – транспорт вещества и информации. Далее мы переходим к изучению веществ, из которых состоит клетка, и будем говорить о связи структур и функций этих веществ. Этот раздел есть во всех учебниках биохимии. Он есть в нашем основном учебнике Макеева, а также в учебнике Грина, Стаута, Тейлора; для более фундаментального изучения структуры биомолекул, составляющих клетку можно использовать учебник биохимии Месслера. А также на сайте ФМБФ есть хорошая программа по биохимии, где есть раздел про мономеры и биополимеры клеткиhttp://bio.fizteh.ru/student/files/biochemistry Рекомендуемая литература:
Для более подробного изучения:
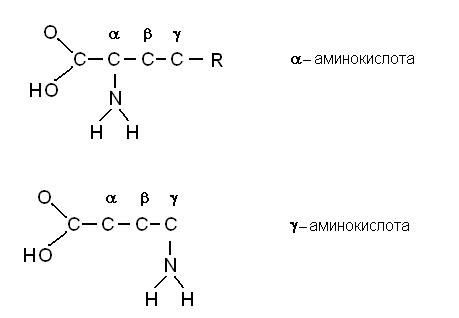
Основные атомы, составляющие живую клетку – это углерод, водород, кислород, азот и фосфор. Конечно, в полимерах присутствуют и другие вещества (например, сера), но сейчас мы рассмотрим комбинации этих пяти элементов. Как вы знаете, образование биополимеров возможно благодаря тому, что углерод четырехвалентен, способен образовывать 4 связи, и атомы углерода, связываясь друг с другом, могут образовывать длинные цепочки, состоящие из десятков атомов. Мы расскажем о четырех видах биополимеров: белках, нуклеиновых кислотах, липидах и углеводах; как они устроены и чем занимаются. Белки Начнем с белков. Белки состоят из мономеров – аминокислот. Каждая аминокислота имеет аминогруппу, связанную с атомом углерода, с этим же атомом связана карбоксильная группа, водород и аминокислотный остаток. Такая конфигурация присутствует во всех аминокислотах. Аминогруппа может быть присоединена к первому за карбоксильной группой атому углерода, или ко второму атому и т.д. Атомы нумеруются греческими буквами, и в зависимости от того, к какому по порядку атому присоединена аминокислота, ее называют альфа-аминокислота, или бета-аминокислота и т.д. В состав белков входят только альфа-аминокислоты.
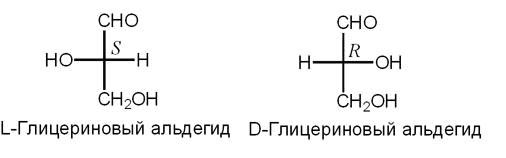
Напомним, что карбоксильная группа имеет кислотный характер, она диссоциирует на ионы в водном растворе с образованием протона и отрицательно заряженной группы СОО¯, а NH2–группа имеет основной характер, она способна присоединять протон водорода, становясь положительно заряженной. В молекуле аминокислоты протон от карбоксильной группы может переносится на аминогруппу – такие образования называются цвиттер-ионы. В растворе аминокислоты находятся в виде цвиттер-ионов. Существенно, что молекулы аминокислот могут отличаться в своей пространственной конфигурации. Это явление называется стереизомерией. Эти молекулы называются D- изомерами и L- изомерами. Молекулы являются зеркальным отображением друг друга, и иначе, чем через четвертое измерение они одна в другую перейти не могут. На плоскости тот атом, который находится ближе, перед плоскостью, изображается треугольной стрелкой, тот, что дальше, за плоскостью – пунктирной линией.
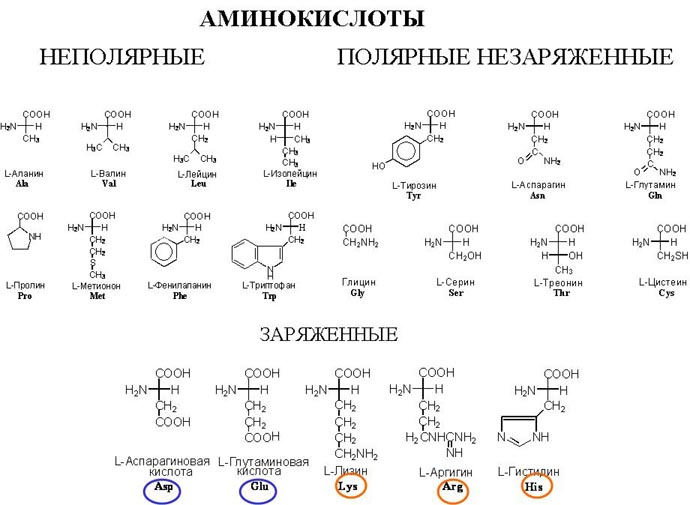
В живом организме все аминокислоты – L–изомеры. D-изомеры встречаются довольно редко и имеют определенные функции, например, могут входить в состав антибиотиков. Всего живая клетка использует 20 аминокислот. Они отличаются строением боковой цепи, как видно из рисунка, могут быть разветвленные цепи, они могут содержать ароматические кольца. Например, у пролина второй углеродный атом израсходовал все свободные связи на ароматическую группу, и поэтому он не обладает такой подвижностью относительно группы С-С, и поэтому в белках, где есть пролин, вращение полипептидной цепи в этих участках ограниченно.
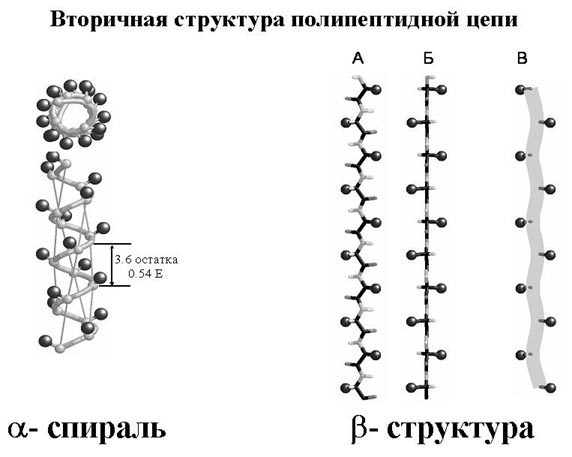
Аминокислоты делят на неполярные, то есть не имеющие заряда и не имеющие групп, которые можно было бы ионизировать, полярные не заряженные и пять кислот относятся к заряженным: это 2 кислоты, которые содержат вторую карбоксильную группу, которая может ионизироваться и нести на себе отрицательный заряд, и три аминокислоты имеющие дополнительные аминогруппы, которые несут в растворах с собой положительный заряд и используются в белках для того, чтобы зарядить необходимые части молекулы. Изменение заряда белковой молекулы может оказать большое влияние на структуру и функцию. Последовательность аминокислот в белке составляет его первичную структуру. Как же они соединяются? Аминокислоты способны взаимодействовать друг с другом, образуя пептидную связь. При этом молекула воды уходит, а углерод соединяется с азотом – собственно пептидная связь. Понятно, что следующая карбоксильная группа может прореагировать с аминогруппой другой кислоты и таким образом образуется полипептидная цепочка, что и называется первичной структурой белка. При записи первичной структуры аминокислоты обозначают либо трехбуквенным кодом, по первым трем буквам названия, либо используют однобуквенный код. В базах данных первичная структура белка записывается обычно однобуквенным кодом. В зависимости от того, какие аминокислоты образовали цепочку, он может свернуться в пространстве и принять ту или иную пространственную структуру, которая называется вторичной структурой белка. Полипептидная цепочка сворачивается в пространстве в различные структуры, например спираль с определенными характеристиками, с определенным шагом (α-спираль), или вытянутую структуру (β-структура). β– спирали могут взаимодействовать между собой, образуя целые белковые листы. α- спирали образуют достаточно жесткие цилиндрические структуры. На рисунках альфа-спирали изображаются или как спиральные ленты или как цилиндры, а бета-структуру изображаются как плоские полосы.
Что же заставляет белки сворачиваться? В формировании вторичной структуры принимают участие гидрофобные взаимодействия, ионные взаимодействия, водородные связи и ковалентные связи. Гидрофобные взаимодействия. Как уже было сказано выше, существуют полярные и неполярные аминокислоты. Если в полипептидной цепи рядом находятся гидрофобные аминокислоты (неполярные), то в водном растворе нерастворимые в воде гидрофобные участки постараются уйти от взаимодействия с водой, свернуться так, чтобы оказаться рядом и укрыться от воды, образовать структуру с минимальной потенциальной энергией. Если рядом находятся заряженные аминокислотные остатки, то они будут притягиваться в случае разноименных зарядов или отталкиваться в случае одноименных зарядов. Поэтому первичная структура белка, то есть, наличие гидрофобных или заряженных участков на полипептидной цепи, определяет то, как этот белок свернется. Или, если, к примеру, имеется пролин, то он будет держать соседние атомы под определенным углом, определяя тем самым их положение в пространстве. Расположение элементов вторичной структуры (альфа-спиралей и других элементов) в пространстве относительно друг друга называется третичной структурой белка.
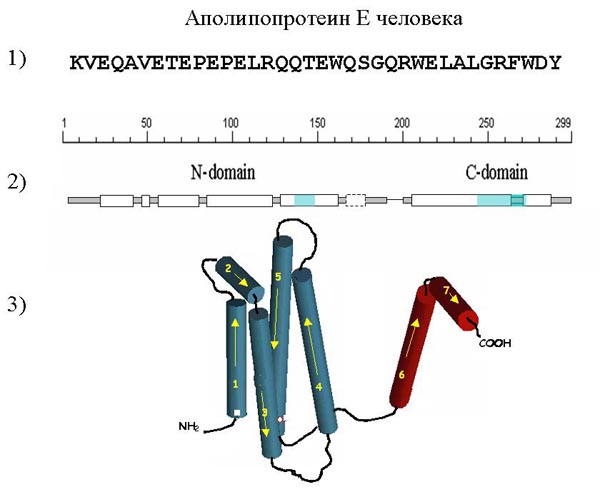
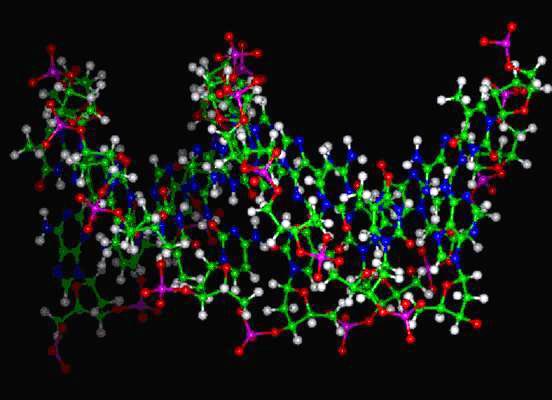
Но, кроме того, что сам белок при попадании в водный раствор примет ту конформацию, в которой он должен работать, в клетке еще есть белки, которые называются шапероны (от слова shape - форма), которые помогают другим белкам правильно сворачиваться. Если белки сворачиваются неправильно, то это может иметь катастрофические последствия. Несколько лет назад в Европе была эпидемия коровьего бешенства, и большое количество коров пришлось уничтожить. Коровье бешенство (губчатая энцефалопатия – мозг животного становится похож на губку) вызывается не вирусом и не бактерией, а особым клеточным агентом – неправильно свернутым белком. Этот белок приводит к образованию в клетке конгломератов, то есть, белки буквально выпадают в осадок, и жизнь клетки нарушается, прежде всего влияя на нервную систему. Это происходит потому, что белки, которые в норме в клетке взаимодействовали бы с этим белком, не могут этого сделать, так как он свернут неправильно, и поэтому клетка начинает неправильно функционировать. Таким образом, это болезнь неправильно свернутых белков. Эта эпидемия разразилась после того, как стали применять новую технологию переработки костной муки. При более низких температурах белки из костей больных животных, которые после переработки шли в качестве добавки к корму, перестали уничтожаться, а стали попадать в корм, вызвав тем самым эпидемию. Каким же образом неправильно свернутые белки попадают из пищеварительного тракта в мозг? Оказывается, что клеточные механизмы (ферменты протеазы), которые уничтожают отработанные белки, этот белок «угрызть» не могут. И прионные белки, не меняясь, могут очень долго сохраняться в организме. К тому же, некоторые белки устойчивы к воздействию температур. У людей есть аналог этой болезни. Это инфекционное заболевание называется куру. Оно описано у народов, имеющих привычку съедать мозги умерших предков (из уважения к последним). В них как раз и находились инфекционные белки. Это так называемая медленная инфекция (белок ведь, в отличие от вируса, не размножается, а постепенно высаживает на себя другие клеточные белки, распространяя вокруг себя плохую «привычку» неправильно сворачиваться). Есть схожая болезнь у овец скрейпи (характер такой же, просто дело в другом белке). И еще есть наследственное заболевание, которое называется синдром Крейтцфельда-Якоба. В одном из белков, который функционирует в мозгах, происходит мутация. В других клетках этот белок также есть, но просто, в первую очередь, нарушения сказываются на нервные ткани, так как они эволюционно самые молодые, и поэтому наиболее чувствительны к любым нарушениям в функционировании клетки. Эта мутация не позволяет белку правильно свернуться, и поэтому у человека развиваются все те же симптомы, что и при коровьем бешенстве у животных. Сейчас по первичной структуре белка можно предсказать многие элементы его вторичной структуры, то есть как белок свернется. Когда были разработаны алгоритмы такого предсказания, устраивались соревнования, кто лучше предскажет структуру белка. Например структура была известна по данным кристаллографии, но ее никому не показывали, и группы ученых , используя свои алгоритмы, смотрели, чей алгоритм будет лучше. На рисунке представлена первичная структура белка аполипопротеина Е, он занимается транспортом холестерина, это человеческий белок. На рисунке однобуквенным кодом записана последовательность аминокислот (первичная структура).
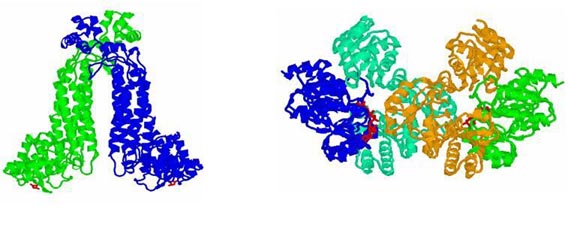
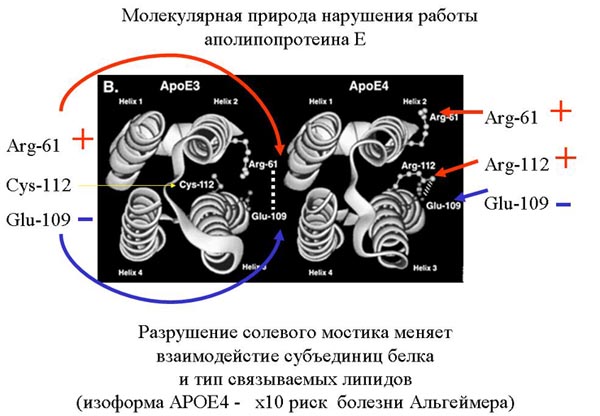
Под первичной структурой представлена вторичная структура белка, альфа-спиральные участки обозначены прямоугольниками. Над ними указаны номера аминокислот (белок состоит из 299 аминокислот). Пунктиром обозначен участок, которые во время функционирования белка то расплетается, то опять сворачивается. Ниже показана третичная структура белка, то есть то, как спирали расположены в пространстве и взаимодействуют друг с другом. У белка есть N – конец, это та часть на которой находится аминогруппа. Та сторона, на которой находится карбоксильная группа, называется соответственно С-конец. Есть мутация в этом белке, которая меняет заряд одной аминокислоты. В результате меняются ионные взаимодействия внутри молекулы белка. Это меняет сродство белка к липидам разных классов. В результате повышается вероятность развития старческого слабоумия, называемого болезнью Альцгеймера. На этом примере, хорошо видно, как изменение одной единственной аминокислоты может повлиять на функции белка.
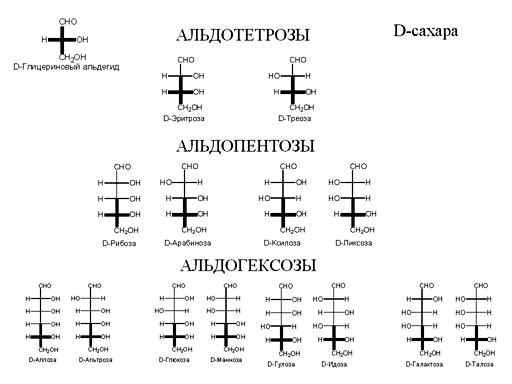
На рисунке показано, как свернут белок. Arg-61, положительно заряженный, взаимодействует с отрицательно заряженной глутаминовой кислотой. Тут образуется своеобразный мостик. Слева на рисунке представлен белок, который отличается одной мутацией от белка, изображенного справа. В нем происходит одна аминокислотная замена. Вместо нейтрального, незаряженного цистеина появляется положительно заряженный аргинин (Arg-112), с которым начинает взаимодействовать с отрицательно заряженной глутаминовой кислотой (Glu-109), так как он расположен к глутаминовой кислоте ближе, чем аргинин-61. Исчезает солевой мостик. Меняются взаимодействия внутри белка. Это приводит к тому, что меняет сродство к липидам. Его функция заключается в переносе липидов. И он, вместо липопротеинов более высокой плотности, начинает иметь большее сродство полипротеинами меньшей плотности. У людей с такой мутацией более высокий уровень холестерина и выше уровень риска развития старческого слабоумия. Кстати, помимо физической нагрузки, профилактикой развития старческого слабоумия является умственная работа. Примерно 15% европейцев имеют такую мутацию, у бушменов же это число достигает 40% . Но им этот белок ничуть не мешает, а старческого слабоумия у них не бывает вообще, так как у них низко холестериновая диета и много физических нагрузок. Им этот белок даже полезен, так как холестерин им нужно запасать. У людей же с западной «диетой» большое содержание жиров, и «жадный» вариант белка, дающий высокий уровень холестерина, становиться вредным. Холестерин нужен, но его не должно быть ни слишком много, ни слишком мало. Таким образом, проявление изменений в первичной структуре белка зависит от образа жизни. Углеводы Перейдем к углеводам. Углеводы – как название уже говорит само за себя, состоит из углерода и воды. У них так же, как и у аминокислот, есть стереоизомеры, (L и D – молекулы), принцип определения такой же, как и в аминокислотах. Стоит заметить, что если в организме человека все аминокислоты – L-изомеры, то сахара– D–изомеры.
В зависимости от количества атомов углерода в основной цепи сахара делятся на тетрозы (4 атома углерода), пентозы (5 атомов), гексозы (6 атомов). В зависимости от того, в какую сторону повернуты водородные и гидроксильные группы, мы получаем набор изомеров, каждый из которых имеет собственное название.
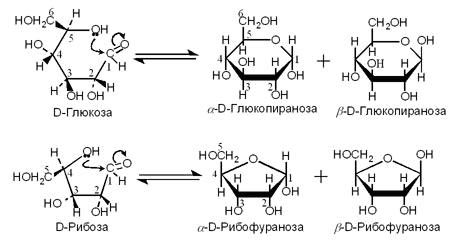
Сахара имеют такую особенность, что они могут переходить из линейной формы в циклическую. Они называются пиранозы, если в основном кольце 5 атомов углерода, и фуранозы – если четыре атома углерода.
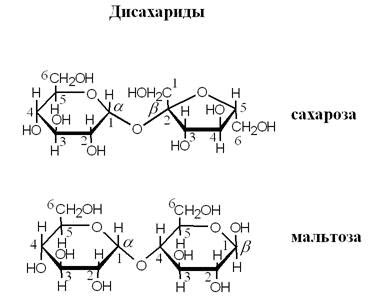
На рисунке изображена глюкоза. Это основной моносахарид. Все остальные клетка стремится перевести в глюкозу, а потом уже глюкозу использовать. Это гораздо более экономичный путь получения энергии, когда все переводится в один универсальный сахар, а потом на этом источнике энергии работают многие биохимические реакции. Рибозы, которые также изображены на рисунке, входит в состав нуклеиновых кислот. Молекулы моносахаров способны соединяться друг с другом, образуя цепочки. Дисахариды состоят из двух звеньев. На рисунке представлены сахароза и мальтоза.
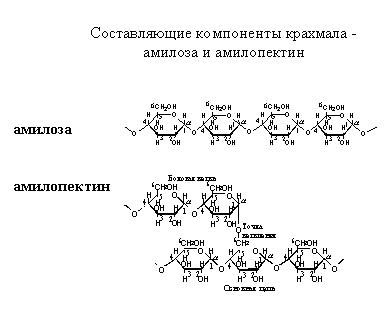
Здесь еще добавляются стереоизомеры за счет различия в расположении мономеров друг относительно друга и связях между соседними звеньями. В зависимости от этого, различают α- и β-сахариды. Цепочки могут быть очень длинными, состоящими из сотен и тысяч звеньев. На рисунке изображены компоненты крахмала.
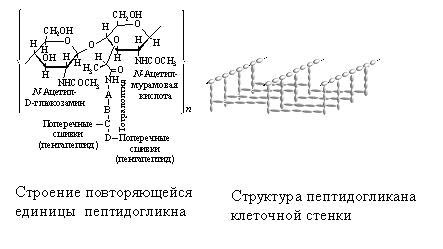
Их два – амилоза (линейная молекула) и амилопектин (молекула разветвленной структуры). Крахмал – это запасной углевод растений. К углеводам относиться также целлюлоза (растительный углевод), гликоген (который накапливается в печени животных как запасное вещество), пектин (который является основой для скелета насекомых) и другие. Углеводы могут присоединяться к белкам, образовывая смешанные структуры. Например, клеточная стенка (не путать с мембраной) у бактерий – это вещество, поверх мембраны защищающая бактерию. Она состоит из смеси углеводов и аминокислот, соединенных в такую регулярную структуру. Пептидогликан (вещество, которое составляет клеточную стенку) выглядит следующим образом:
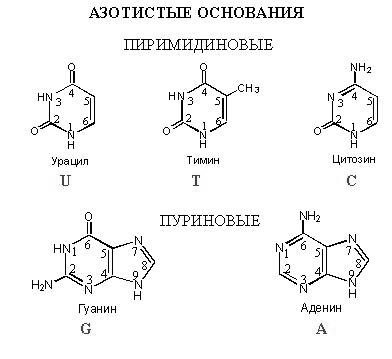
Нуклеотиды Остановимся подробнее на нуклеотидах. Известно, что нуклеотиды называются аденин, гуанин, тимин, цитозин и урацил – азотистые основания, они представлены на рисунке ниже.
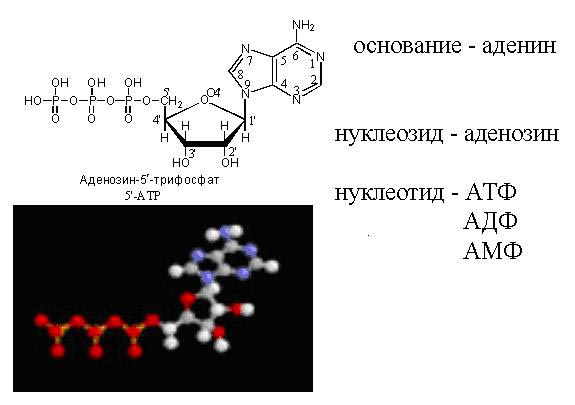
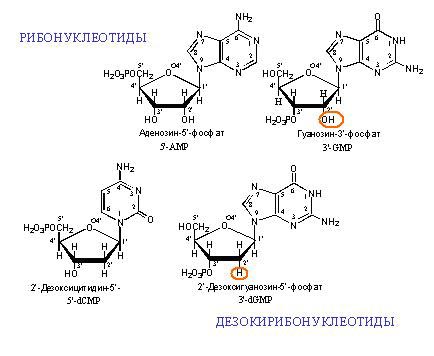
Нуклеотиды – это мономеры нуклеиновых кислот. Нуклеиновые кислоты в эукариотических клетках находятся в ядре. Они есть у всех живых организмов (у тех, у кого нет ядра, нуклеиновые кислоты все равно есть – они находятся в центре клетки у бактерий и образуют нуклеоиды). Мономеры, из которых потом строятся нуклеиновые кислоты, состоят из азотистого основания, остатка сахара (дезоксирибоза или рибоза) и фосфата. Сахара вместе с азотистым основанием называются нуклеозидами (аденозин, гуанозин, тимидин, цитидин). Если к ним присоединены 1-, 2-, или 3-фосфорных остатка, то вся эта структура называется Соответственно, нуклеотизид монофосфатом, дифосфатом или трифосфатом или нуклеотидом (аденин, гуанин, тимин, цитозин).
Вот так модель АТФ выглядит в пространстве. Азотистое основание, входящее в состав ДНК делится на две группы – пиримидиновую и пуриновую. В состав ДНК входит аденин, тимин, цитозин и гуанин, в РНК вместо тимина урацил. Как известно, ДНК – это большой архив, в котором хранится информация, а РНК – это молекула, которая переносит информацию из ядра в цитоплазму для синтеза белков. С различием в функциях связаны различия в строении. РНК более химически активно из-за того, что ее сахар - рибоза – имеет в своем составе гидроксильную группу, а в дезоксирибозе кислорода нет. Из-за отсутствия кислорода ДНК более инертно, что важно для ее функции хранения информации, чтобы она не вступала ни в какие реакции.
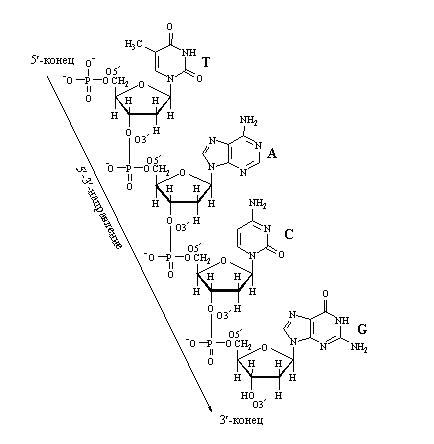
Нуклеотиды способны взаимодействовать друг с другом, при этом «выбрасывается» два фосфора, и между соседними нуклеотидами образуется связь. В молекуле фуранозы молекулы углерода пронумерованы. С первым связано азотистое основание. Когда образуется цепочка нуклеотидов, связь осуществляется между пятым углеродом одной и третьим углеродом другой фосфорной кислоты. Поэтому в цепочке нуклеиновых кислот выделяют разные неравнозначные концы, относительно которых молекула не симметрична.
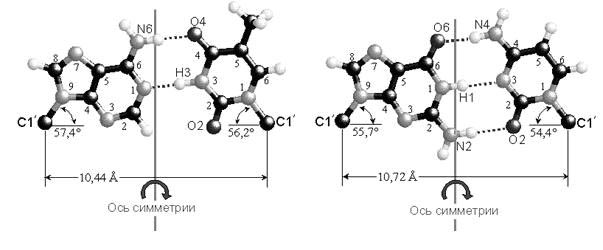
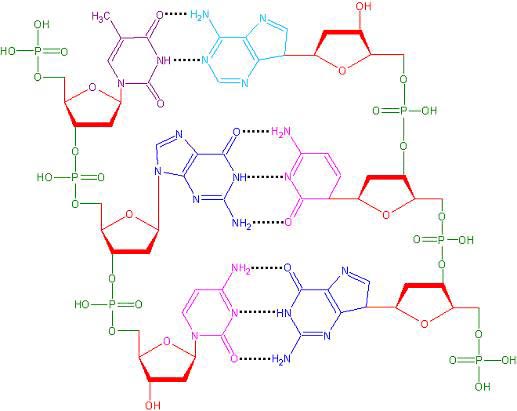
Комплементарные друг другу одноцепочечные молекулы нуклеиновой кислоты способны образовывать двуцепочечную структуру. Внутри этой спирали аденин образует пару с тимином, а гуанин - с цитозином. Встречается утверждение, что нуклеотиды подходят друг другу как осколки разбитого стекла, поэтому они и образуют пары. Но это утверждение неверно. Нуклеотиды способны образовывать пары как угодно. Единственная причина, по которой они соединяются так, и никак иначе, заключается в том, что угол между «хвостиками», которые идут к сахарам, совпадает только в этих парах, и, кроме того, совпадают их размеры. Никакая другая пара не образует такой конфигурации. А поскольку они совпадают, то их через сахаро-фосфатный остов можно связать друг с другом. Структуру двойной спирали открыли в 1953 году Джеймс Уотсон и Фрэнсис Крик.
При соединение друг с другом против 5’-конца одной нити находится 3’-конец другой нити. То есть нити идут в противоположных направлениях – говорят, что нити в ДНК антипараллельны. На рисунке видна модель ДНК, видно, что аденин соединяется с тимином двумя водородными связями, а гуанин соединяется с цитозином тройной водородной связью. Если молекулу ДНК подогревать, то ясно, что две связи легче разорвать, чем три, это существенно для свойств ДНК.
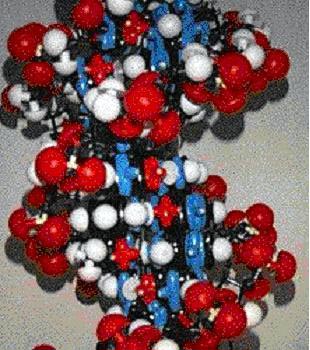
В силу пространственного расположения сахаро-фосфатного остова и нуклеотидов, когда нуклеотиды накладывают один на другой и «сшивают» через сахаро-фосфатный остов, цепочка начинает заворачиваться, тем самым образуя знаменитую двойную спираль. На рисунках представлены шариковые модели ДНК, где каждый атом обозначен шариком. Внутри спирали имеются бороздки: маленькая и большая. Через эти бороздки с ДНК взаимодействуют белки и распознают там последовательность нуклеотидов.
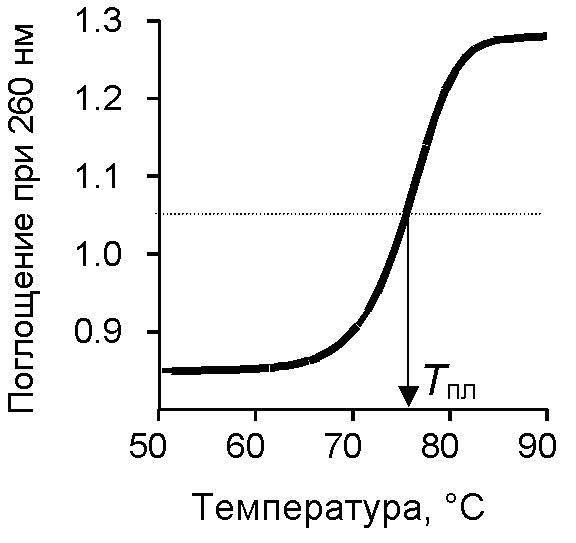
При нагревании ДНК водородные связи разрываются и нити в двойной спирали расплетаются. Процесс нагревания называется плавлением ДНК, при этом разрушаются связи между парами А-Т и Г-Ц .Чем больше в ДНК пар А-Т, тем менее прочно нити друг с другом связаны, тем легче ДНК расплавить. Переход из двухспиральной ДНК в одно-спиральную измеряется на спектрофотометрах по поглощению света при 260 нм. Температура плавления ДНК зависит от А-Т/Г-Ц состава и размера фрагмента молекулы. Ясно, что если фрагмент состоит из нескольких десятков нуклеотидов, то его гораздо легче расплавить, чем более длинные фрагменты.
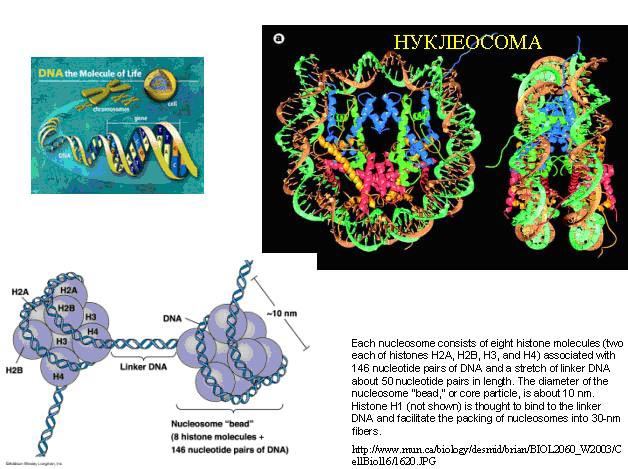
У человека в гаплоидном геноме, то есть единичном наборе хромосом, 3 млрд. пар нуклеотидов, и их длина составляет 1,7 м, а клетка гораздо меньше, как вы догадываетесь. Для того, чтобы ДНК смогла в ней поместиться, она достаточно плотно свернута, и в эукариотической клетке свернуться ей помогают белки – гистоны. Гистоны имеют положительный заряд, а так как ДНК заряжена отрицательно, то гистоны обладают сродством к ДНК. Упакованная при помощи гистонов ДНК имеет вид бусин, называемых нуклеосомами. 200 пар нуклеотидов идет на одну нуклеосому, 146 пар накручиваются на гистоны, а остальные 54 висят в виде линкерных (связывающих нуклеосомы) ДНК. Это первый уровень компактизации ДНК. В хромосомах ДНК свернута еще несколько раз для того, чтобы образовались компактные структуры.
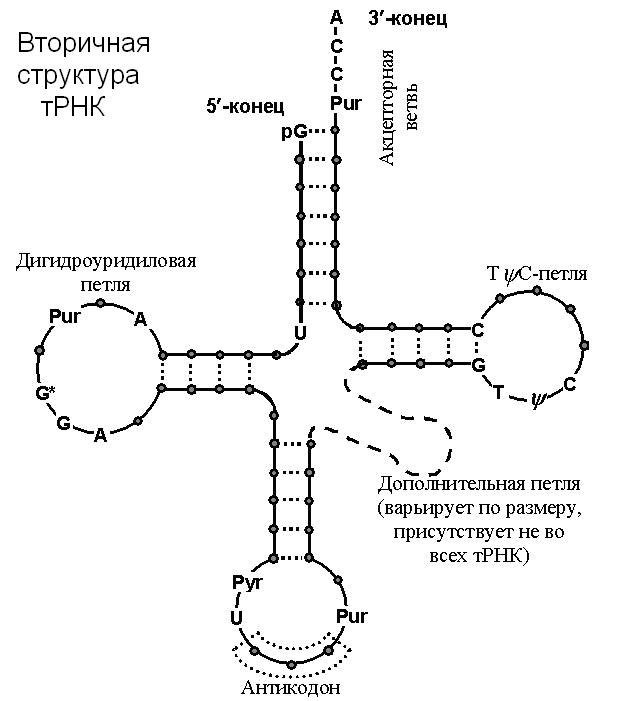
К нуклеиновым кислотам кроме ДНК относится также РНК. В клетке присутствуют разные типы РНК: рибосомные, матричные, транспортные. Существуют и другие виды РНК, о которых мы будем говорить позже. РНК синтезируется в виде одно-цепочечной молекулы, но отдельные ее участки входят в состав двуцепочечных спиралей. Для РНК также говорят о первичной структуре (последовательности нуклеотидов) и вторичной структуре (образование двуспиральных участков).
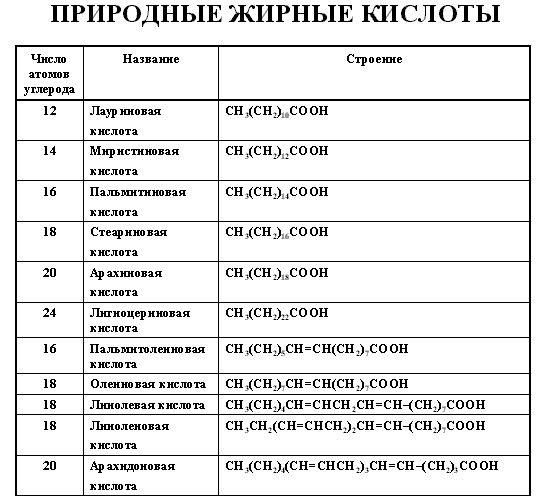
Липиды В состав липидов входят жирные кислоты, имеющие длинные углероводородные цепи. Жирные кислоты гидрофобны, то есть не растворимы в воде.
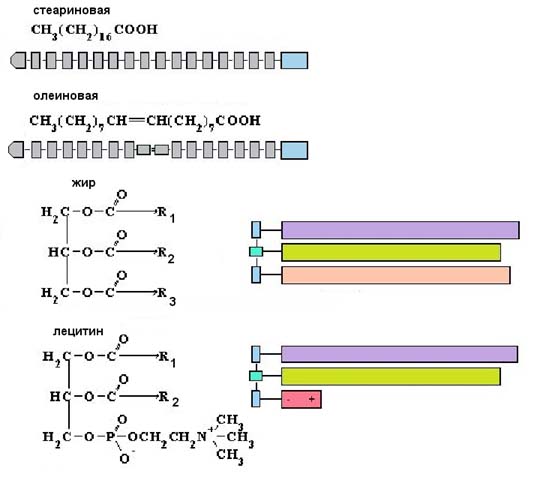
Липиды представляют собой соединения жирных кислот с глицерином (эфиры). Например, на рисунке изображен лецитин.
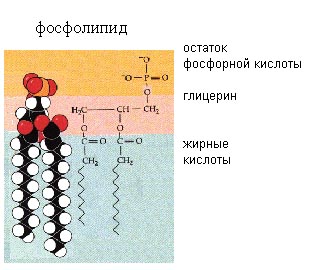
В клетке важную роль играют липиды, в которых к глицерину присоединен остаток фосфорной кислоты и 2 жирных кислоты. Они называются фосфолипидами. Молекулы фосфолипидов имеют полярную (то есть гидрофильную, хорошо растворимую) группу на одном конце молекулы и длинный гидрофобный хвост. К фосфолипидам относится фосфатидилхолин.
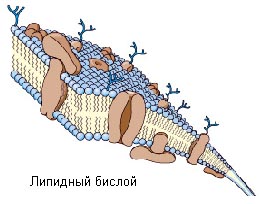
В водном растворе фосфолипиды образуют мицеллы, в которых молекулы обращены полярными "головами" наружу, в сторону воды, а гидрофобные "хвосты" оказываются внутри мицеллы, спрятанными от воды. Клеточную мембрану также липиды с полярными "головами", которые обращены наружу по обе стороны мембраны, а гидрофобные "хвосты" находятся внутри липидного бислоя.
Более подробно со строением липидов можно познакомиться в учебнике Макеева (pdf).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||