
- •I. Химические свойства белков
- •Работа с автоматической пипеткой
- •1.1 Реакция Фоля
- •1.2 Реакция Адамкевича
- •1.3 Реакция Сакагучи
- •1.4 Ксантопротеиновая реакция
- •1.5 Нингидриновая реакция
- •1.6 Обнаружение отпечатков пальцев на бумаге
- •1.7 Биуретовая реакция
- •II. Методы количественного определения белков
- •Работа со спектрофотометром
- •2.1 Метод ультрафиолетового поглощения
- •2.2 Биуретовый метод (микро-модификация)
- •III Методы анализа аминокислот
- •3.1 Радиальная хроматография
- •3.2 Тонкослойная хроматография
- •3.3 Определение содержания аминокислот формольным титрованием
- •IV Физико-химические свойства белков Коллоидные свойства
- •Диализ белков
- •Растворимость белков
- •4.2. Влияние нейтральных солей на растворимость белков
- •4.3 Осаждение при нагревании
- •4.4 Осаждение органическими растворителями
- •4.6 Осаждение органическими кислотами
- •4.7 Осаждение алкалоидными реактивами
- •4.8 Осаждение солями тяжелых металлов
- •Электрофорез белков
- •4.9 Электрофорез по Леммли
- •Вопросы к коллоквиуму по теме «Белки»
- •Использованная литература
- •Приложение. Плотность водных растворов hCl при 20°с
- •Плотности водных растворов hno3 при 20°с
- •Плотности водных растворов h2so4 при 20°с
- •Плотности водных растворов уксусной кислоты при 20°с
ДАЛЬНЕВОСТОЧНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
КАФЕДРА БИОХИМИИ, МИКРОБИОЛОГИИ И БИОТЕХНОЛОГИИ
Методические указания к лабораторным работам по биохимии
(Белки)
Владивосток 2014
Методические указания к практическим занятиям по курс «Биохимия» подготовлены кафедрой биохимии, микробиологии и биотехнологии для студентов 2 курса, обучающихся в бакалавриате по направлению «биология».
В результате выполнения предлагаемых практических работ студенты закрепляют главные положения лекционного курса, получают представления о практическом значении полученных знаний. В ходе выполнения работ формируется умение самостоятельной работы в биохимической лаборатории, навыки выполнения простейших лабораторных операций. Методические указания содержат описание предлагаемых лабораторных работ и краткое изложение теоретических основ используемых методов.
Составители: Мазейка А.Н., Костецкий Э.Я.
© Дальневосточный федеральный университет, 2014
© Кафедра биохимии, микробиологии и биотехнологии, 2014
© Мазейка А.Н, Костецкий Э.Я.
I. Химические свойства белков
Химические свойства белка определяются структурой его молекулы – в первую очередь его аминокислотным составом, то есть набором входящих в его состав аминокислот и их количественным соотношением. По этой причине белок вступает в большинство химических реакций, характерных для, входящих в его состав аминокислот. Примером таких реакций являются реакции: Фоля, Адамкевича, Сакагучи, ксантопротеиновая и нингидриновая реакция. Некоторые из этих реакций специфичны для определенных аминокислот (например, реакция Адамкевича – для триптофана), другие (например, нингидриновая) характерны для всех аминокислот.
Кроме того белкам присущи некоторые свойства, не характерные для аминокислот. Так, в молекуле белка находится большое количество пептидных связей, вследствие чего, для белков характерна биуретовая реакция.
Большинство приведенных реакций сейчас имеют лишь историческое значение, другие (нингидриновая, биуретовая, ксантопротеиновая) лежат в основе методов обнаружения и количественного определения белков и аминокислот.
Все предлагаемые реакции проводятся на яичном белке и желатине. Эти белки выбраны потому, что являются легкодоступными, при этом белок куриного яйца имеет типичный аминокислотный состав (примерно такой же, как и большинство других белков), а вот аминокислотный состав желатина очень бедный (вследствие того, что это специализированный белок соединительной ткани и его состав приспособлен к его функции, табл.1). По этой причине химические свойства белка куриного яйца и желатина сильно различаются.
Таблица 1. Аминокислотный состав желатина и белка куриного яйца
Аминокислота |
Содержание в желатине (из бычьих костей), % |
Содержание в белке куриного яйца, % |
Аланин |
12,0 |
5,7 |
Аргинин |
5,0 |
6,3 |
Аспарагиновая к-та и Аспарагин |
4,5 |
9,8 |
Глицин |
32,7 |
3,3 |
Глутаминовая к-та и Глутамин |
7,7 |
14,2 |
Изолейцин |
0,9 |
4,7 |
Лейцин |
2,1 |
8,7 |
Лизин |
3,7 |
7,2 |
Метионин |
0,7 |
3,4 |
Пролин |
23,1 |
3,2 |
Серин |
3,4 |
7,4 |
Тирозин |
0,4 |
3,8 |
Треонин |
0,9 |
4,9 |
Фенилаланин |
1,2 |
5,2 |
Выделены аминокислоты, содержание которых в белке больше 5%
В качестве отчет о проделанной работе:
1.запишите приведенные схемы химических реакций
2.заполните таблицу
Название реакции |
Белок |
Необходимые реактивы |
Окраска |
Работа с автоматической пипеткой
Автоматическая пипетка – основной инструмент при работе в современной биохимической лаборатории.
Автоматическая пипетка предназначена для дозирования водных растворов низкой вязкости при комнатной температуре – только в этом случае объем, выставленный на пипетке, равен объему жидкости в типе.
Устройство и принцип действия автоматической пипетки представлены на рисунке 1. Автоматическая пипетка состоит из корпуса 3, зажимаемого в руке, с упором для указательного пальца 2. Набор и выдавливание жидкости из пипетки происходит путем нажимания большим пальцем на поршень 1. При надавливании поршень смешается, пока не достигнет первого упора, при большем усилии поршень смещается еще немного и достигает второго (окончательного) упора. Смещение поршня, а следовательно, и набираемый в пипетку объем жидкости регулируется вращением колеса 6, а установленный объем показывается в окне индикатора 4. Набор жидкости происходит непосредственно в сменный наконечник 5, называемый типом. Удаление использованного типа производится нажатием большим пальцем на кнопку 7, которая приводит в действие рычаг 8, непосредственно сталкивающий тип с носика пипетки.
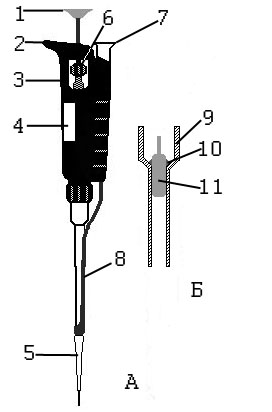
Рис. 1. А-устройство автоматической пипетки, Б- принцип действия
Автоматическая пипетка работает аналогично медицинскому шприцу: внутри корпуса пипетки 9 находится стальной поршень 11, который с помощью уплотнительного резинового кольца 10 и силиконовой смазки герметично с ним соединен. При смещении поршня 11 вверх, в тип, надетый на пипетку, втягивается жидкость, при смещении поршня вниз – жидкость выдавливается. Регулируя колесом 6 ход поршня – регулируется объем всасываемой жидкости.
Автоматическая пипетка плохо подходит для дозирования:
1.Вязких жидкостей (глицерина, агара, концентрированной серной кислоты, триэтаноламина, концентрированных растворов детергентов и белков)
2.Жидкостей с низким поверхностным натяжением, особенно при повторных заборах (детергенты, растворы белков);
3.Холодных и горячих растворов, так как воздух в типе меняет температуру, и, следовательно, объём (охлажденные растворы ферментов, горячие буферы для гибридизации, верхний агар).
4.Органических растворителей (особенно легколетучих, например хлороформа, ацетона, диэтилового эфира)
Во всех этих случаях точность дозирования резко падает, для точного дозирования всех указанных растворов приходится применять специальные приемы
Автоматическая пипетка не подходит для дозирования:
1.Агрессивных жидкостей (концентрированная серная и хлорная кислоты, пергидроль)
2.Жидкостей и растворов, выделяющих агрессивные пары (концентрированная соляная, плавиковая и азотная кислоты, жидкий бром)
В этих случаях возможна порча пипетки
Правила работы с пипеткой:
1. Отжать поршень пипетки до первого упора
2 .
При отборе жидкости, боковыми стенками
типа не касаться боковых стенок сосуда
(часто тип укрепляют на пипетке руками,
поэтому его внешняя поверхность
загрязнена, также на внешнюю поверхность
может налипнуть жидкость со стенок
сосуда, что приведет к неточному
дозированию).
.
При отборе жидкости, боковыми стенками
типа не касаться боковых стенок сосуда
(часто тип укрепляют на пипетке руками,
поэтому его внешняя поверхность
загрязнена, также на внешнюю поверхность
может налипнуть жидкость со стенок
сосуда, что приведет к неточному
дозированию).
3.Жидкость отбирать прямо с поверхности, тип глубоко не опускать.
4.Отпускать поршень пипетки вверх необходимо плавно (иначе раствор попадет внутрь пипетки, что приведет к её порче).
5.Выдавить жидкость, отжав пипетку до второго упора.
6.Жидкость выдавливать, по возможности, на стенку пробирки или на поверхность жидкости – не капать и не погружать тип глубоко.
6.Не класть пипетку с надетым типом на стол - тип может загрязниться/кого-нибудь испачкать; если в типе осталась больше 50µl жидкости, то она может затечь внутрь пипетки. Растворы с низким поверхностным натяжением (растворы белков, детергентов, фенол, хлороформ, спирт) способны затечь в горизонтально лежащую пипетку, даже если их в типе гораздо меньше, чем 50µl.
7.Не сбрасывать тип, в котором есть жидкость – эта жидкость также может попасть внутрь пипетки.
8.Следите, чтобы выставленный на пипетке объем не сбился в ходе работы.
9.Не выставляйте на пипетке объем выше ее номинала.
10.Следует контролировать работу пипетки "на глаз", особенно при повторных дозированиях (часто случается, что отбирается неправильный объём - некачественный тип, тип неплотно одет, тип не сразу коснулся жидкости, тип закупорился).
