
- •Введение
- •Раздел I. Основные расчетные формулы при решении задач на нахождение молекулярной формулы вещества
- •Алгоритмы решения задач по массовой доле химического элемента
- •Алгоритмы решения задач на сгорание вещества
- •Раздел II. Вывод молекулярной формулы по продуктам сгорания
- •Раздел III. Вывод формул соединений на основании массовых долей элементов в соединении
- •Раздел IV Вывод молекулярной формулы вещества по уравнению реакции
- •Раздел V. Задачи с участием кристаллогидрата
- •Раздел VI.
- •Раздел VII. Вывод молекулярных формул неорганических веществ
- •Раздел VIII. Определение молекулярной формулы по электронному н атомному составу
- •Раздел IX. Олнмпиадные задачи
Вывод формул органических и неорганических соединений (задачи части С).
Методическое пособие для подготовки к единому государственному экзамену (для абитуриентов) / Е.Р.Молчанова -Красноярск: типография КрасГМУ, 2009, - 35 стр.
Составитель: Е.Р.Молчанова
СОДЕРЖАНИЕ
Введение 4
Раздел I. Основные расчетные формулы при решении задач на нахождение молекулярной формулы вещества 5
Раздел II.Вывод молекулярной формулы по продуктам сгорания 8
Раздел III. Вывод формул соединений на основании массовых долей элементов в соединении 12
Раздел IV. Вывод молекулярной формулы вещества по уравнению реакции 15
Раздел V. Задачи с участием кристаллогидрата 21
Раздел VI. Вывод формулы вещества на основе общей формулы гомологического ряда органических соединений 23
Раздел VII. Вывод молекулярных формул неорганических веществ 25
Раздел VIII. Определение молекулярной формулы по электронному и атомному составу 28
Раздел IX. Олимпиадные задачи 29
Литература
Введение
С 2003 года Красноярский край участвует в эксперименте по проведению единого государственного экзамена по химии. Опыт проведения ЕГЭ показал, что результаты сдачи экзамена бывают успешными, если выпускники заранее готовятся к нему, знают особенности содержания и выполнения экзаменационной работы. В задания части «С» включены задачи, связанные с выводом формул химических соединений. Практика показывает, что более половины учащихся даже не приступают к выполнению данного раздела ЕГЭ.
В настоящем пособии приведены задания, наиболее часто встречающиеся в ЕГЭ, на олимпиадах районного и городского уровня.
Данное пособие предназначено как для учащихся общеобразовательных школ, так и для профильных классов, а также окажет несомненную помощь учителям при подготовке учащихся к сдаче ЕГЭ и проведении занятий по данному разделу программы в 8-11 классах.
Раздел I. Основные расчетные формулы при решении задач на нахождение молекулярной формулы вещества
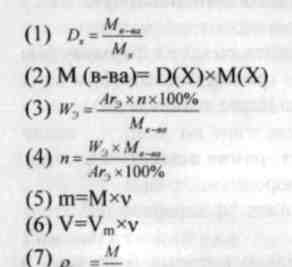
D(X) - относительная плотность вещества.
w - массовая доля химического элемента (проценты или доли единицы)
Аг - относительная атомная масса вещества
М - молярная масса вещества (г/моль)
п - количество атомов элемента в веществе.
m - масса вещества (г)
v - количество вещества (моль)
V- объем (л)
Vm - молярный объем (л/моль).
Алгоритмы решения задач по массовой доле химического элемента
I. Если в задаче дана относительная плотность вещества
по формуле (2) находим молярную массу вещества и подставляем ее в формулу (4)
при нахождении (п) сразу округляем до целого числа.
II. Если в задаче даны масса и объем вещества:
по формуле (6) находим количество вещества, при этом берем после запятой три значащих цифры.
по формуле (5) находим молярную массу вещества, подставляем ее в формулу (4), находим (п),
при нахождении (п) округляем его до целого числа.
III. Если в задаче дана плотность вещества при нормальных условиях:
из формулы (7) находим молярную массу вещества, подставляем в формулу (4), находим (п)
при нахождении (п) округляем его до целого числа.
IV.Если в задаче нет данных, позволяющих найти молярную массу вещества:
- берем молярную массу за 100 г/моль, подставляем ее в формулу (4)
- при нахождении (п) после запятой берем три значащих цифры
-делим на самое маленькое число, получая целое значение (п).
Алгоритмы решения задач на сгорание вещества
I. Если в задаче сказано, что горит углеводород:
пишем уравнение реакции с расстановкой коэффициентов СХНУ+ (х+0,25у)О2— хС02 +0,5уН2О
находим количество веществ, относительно которых идет речь в задаче
составляем количественные соотношения между этими веществами, находим «х» и «у».
Или
- находим количество моль углерода и водорода;
- составляем соотношение между атомами углерода и водорода (СХНУ);
х:у = v(C):v(H)
- если получается дробное значение, находим самое маленькое число и все делим на него, получая целочисленные значения.
II. Если в задаче сказано, что горит органическое вещество, но не дана его масса, значит кислорода в нем нет и решаем по пункту (I).
III. Если в задаче сказано, что горит органическое вещество и дана его масса, необходимо сделать проверку на наличие кислорода:
- найти количество вещества углекислого газа, найти количество углерода, найти его массу;
найти количество вещества воды, количество водорода, его массу;
сложить массу углерода и водорода (т(Н) + т(С));
- если масса углерода и водорода будет равна массе сгоревшего вещества, значит кислорода в нем нет, вещество имеет формулу СХНУ:
- составляем соотношение между атомами углерода и водорода:
x:y=v(C):v(H)
- если не получаются целые значения, находим самое маленькое из них и делим на него, получая целое значение:
если масса углерода и водорода будет меньше массы сгоревшего вещества, кислород есть;
находим массу кислорода (т(0)=т(сгоревшего в-ва_-т(С)-т(Н));
находим количество кислорода (v(0)=m(0)/16):
- составляем соотношение между атомами углерода, водорода и кислорода (СхНуО,):
x:y:z=v(C):v (H):v(0)
- если получаются дробные значения, находим самое маленькое число и деля на него все значения (п) получаем целочисленные значения.
Для решения задач по уравнению реакции необходимо знать общую формулу гомологического ряда.
|
Гомологический ряд |
Общая формула |
Молярная масса |
|
Алканы |
СпН2п+2 |
14п+2 |
|
Алкены, циклоалканы |
СпН2п+2 |
14п |
|
Алкины |
СпН2п-2 |
14п-2 |
|
Алкадиены |
СпН2п-2 |
14п-2 |
|
Арены |
СпН2п-6 |
14п-6 |
|
Моногалогеналканы |
СпН2п+1Гаl |
14п+1+М(Га!) |
|
Дигалогеналканы |
СпН2пГаl2 |
14п+2М(Га1) |
|
Одноатомные спирты |
СпН2п+1ОН |
14п+18 |
|
Двухатомные алифатические спирты |
СпН2п(ОН)2 |
14п+34 |
|
Трехатомные алифатические спирты |
СпН2п-1(ОН)3 |
14п+50 |
|
Альдегиды, кетоны |
CnH2n+1OH |
14п+30 |
|
Предельные одноосновные карбоновые кислоты |
CnH2n+1COOH |
14п+46 |
|
Двухосновные карбоновые кислоты |
CnH2n(COOH)2 |
14п+90 |
|
Простые эфиры |
CnH2n+2O |
14п+18 |
|
Сложные эфиры |
CnH2nO2 |
14п+32 |
|
Первичные, вторичные, третичные амины |
CnH2n+3N |
14п+17 |
|
Аминокислоты, нитросоединения, сложные эфиры аминокислот с алканолами. |
CnH2n +1N02 |
14п+47 |
В большинстве задач на вывод молекулярной формулы необходимо проверить достоверность полученной формулы по ее молярной массе, если она дана или ее можно найти из данных задачи.
