
- •Главные этапы в развитии теории света
- •1.4. Геометрическая оптика
- •Законы распространения света.
- •2.1.4. Преломление света на сферической поверхности.
- •3.1.4. Тонкие линзы. Формула тонкой линзы.
- •4.1.4. Аберрации линз.
- •Оптические приборы.
- •Задачи к зачету
- •2.2. Интерференция света
- •1.2.4. Интерференция света. Условия образования интерференционного максимума и минимума.
- •2.2.4. Методы наблюдения интерференции света
- •3.2.4. Расчет интерференционной картины от двух источников.
- •4.2.4. Интерференция света в тонких пленках.
- •5.2.4. Применение интерференции. Интерферометры.
- •Задачи к зачету
- •3.4. Дифракция света
- •1.3.4. Принцип Гюйгенса.
- •2.3.4. Метод зон Френеля. Закон прямолинейного распространения света.
- •3.3.4. Дифракция Френеля на круглом отверстии и диске.
- •4.3.4. Дифракция Фраунгофера (дифракция в параллельных лучах).
- •5.3.4. Дифракционная решетка
- •6.3.4. Разрешающая способность оптических приборов.
- •Задачи к зачету
- •4.4. Поляризация света.
- •1.4.4. Естественный и поляризованный свет
- •2.4.4. Поляризация света при отражении и преломлении света.
- •3.4.4. Двойное лучепреломление
- •4.4.4. Поляризационные призмы и поляроиды.
- •5.4.4. Искусственная оптическая анизотропия
- •6.4.4. Вращение плоскости поляризации.
- •Задачи к зачету
- •5.4. Элементы теории относительности.
- •1.5.4. Скорость света и ее опытное определение.
- •2.5.4. Принцип относительности Галилея и законы электродинамики
- •2.5.4. Преобразования Лоренца.
- •3.5.4. Следствия из преобразований Лоренца.
- •1. Относительность одновременности.
- •2. Относительность промежутков времени.
- •3. Относительность длин отрезков.
- •4. Релятивистский закон сложения скоростей.
- •5. Интервал между событиями.
- •6.4. Тепловое излучение.
- •1.6.4. Тепловое излучение и его характеристики
- •2.6.4. Закон Кирхгофа. Универсальная функция Кирхгофа.
- •3.6.4. Законы Стефана – Больцмана и смещения Вина.
- •4.6.4. Формулы Релея – Джинса, Вина и Планка
- •4.6.4. Оптическая пирометрия.
- •Задачи к зачету
- •7.4. Квантовые свойства света.
- •1.7.4. Явление фотоэффекта и его законы.
- •2. Максимальная кинетическая энергия фотоэлектронов пропорциональна частоте падающего излучения.
- •3. Существует красная граница фотоэффекта, т.Е. Минимальная частота света, при которой свет любой интенсивности фотоэффекта не вызывает.
- •2.7.4. Уравнение Эйнштейна для фотоэффекта. Фотон.
- •3.7.4. Эффект Комптона и его объяснение на основе квантовых представлений.
- •4.7.4. Фотон. Масса и импульс фотона. Давление света.
- •Задачи к зачету
- •8.4. Теория атома водорода.
- •1.8.4. Спектр атома водорода
- •2.8.4. Атом водорода по Бору.
- •3.8.4. Рентгеновское излучение.
- •4.8.4. Поглощение, спонтанное и вынужденное излучение. Лазеры.
- •9.4. Элементы квантовой механики.
- •1.9.4. Корпускулярно - волной дуализм.
- •2.9.4. Соотношение неопределенностей Гейзенберга
- •3.9.4. Волновая функция и ее статистический смысл.
- •4.9.4. Уравнение Шредингера.
- •5.9.4. Частица в одномерной прямоугольной потенциальной яме с бесконечно высокими стенками.
- •5.9.4. Гармонический осциллятор в квантовой механике.
- •6.9.4. Атом водорода в квантовой механике.
- •Задачи к зачету
- •10.4. Элементы физики атомного ядра.
- •1.10.4. Открытие нейтрона. Строение атомного ядра.
- •2.10.4. Дефект масс. Энергия связи атомного ядра.
- •3.10.4. Радиоактивное излучение и его состав.
- •5.10.4. Ядерные реакции и их основные типы.
2.8.4. Атом водорода по Бору.
После открытия Томсоном электрона стало ясно, что атом имеет сложное строение.
Совокупность сведений об оптических явлениях, свидетельствует о том, что излучение света обусловлено процессами, в которых принимают участие электроны, входящие в состав атома.
Для объяснения линейчатого спектра атома, следовало предположить, что электрон в атоме совершает гармонические колебания, которые и обуславливают монохроматическое излучение.
Опираясь на закон Кулона и законы движения гармонического осциллятора, Томсон предложил модель атома, согласно которой атом представляет собой равномерно заполненную положительным зарядом сферу, в которую вкраплены электроны.
Модель Томсона не опиралась на эксперимент и поэтому важнейшим шагом можно считать попытки непосредственного опытного зондирования внутренних областей атома с целью установления пространственного распределения электрического заряда в атоме.
В 1903 году Нагаока предложил модель атома, о которой он писал: «Очевидно, что такая система будет приближенно реализована, если мы электроны разместим по кольцу, а положительный заряд в центре. Такой атом не будет противоречить результатам недавних опытов с катодными лучами, радиоактивностью и другими связанными с этим явлениями».
Наиболее успешная попытка зондирования атома была предпринята Резерфордом в 1907 -1913 годах. Пользуясь возможностью наблюдения отдельных - частиц, Резерфорд исследовал, каким образом меняется направление полета частиц при прохождении через слой какого-либо вещества.
При прохождении - частицы через вещество происходит изменение направления ее полета в результате взаимодействия с зарядами, входящими в состав атома. При этом столкновение с электронами не может существенно повлиять на изменение направления движения, так как масса электрона почти в 8000 раз меньше массы - частицы. Напротив, столкновение с положительно заряженной частью атома может вызвать более или менее резкое изменение направления движения - частицы.
Опыт показал, что приблизительно одна из 5000 частиц испытывает отклонение на угол, больший , т.е. поворачивает обратно. Для объяснения этого факта приходится предположить, что довольно часто происходят столкновения, вызывающие сразу крутой поворот - частицы.
Объясняя результаты опыта по рассеиванию - частиц Резерфорд предложил планетарную модель атома, согласно которой в центре атома находится положительно заряженное ядро, в котором сосредоточена вся масса атома. Вокруг ядра вращаются электроны. Так как атом в целом нейтрален, то суммарный заряд электронов равен заряду ядра.
Для простоты рассуждений предположим, что электрон в атоме водорода движется по круговой орбите. В этом случае, второй закон Ньютона для электрона запишется в виде
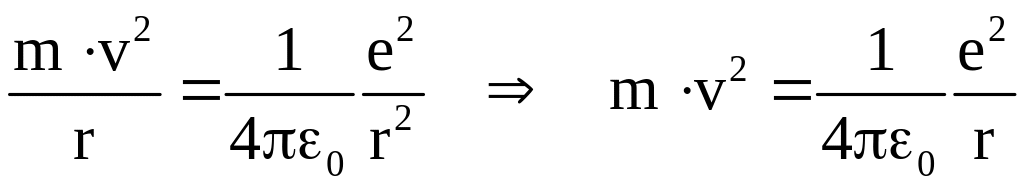 .
8.1
.
8.1
Полученное выражение содержит две
неизвестные величины
![]() ,
а из курса математики известно, что одно
уравнение с двумя неизвестными имеет
множество решений. Следовательно,
существует множество значений радиуса
и соответствующих ему значений скорости
(а значит и энергии), удовлетворяющих
этому уравнению. Иными слова,
,
а из курса математики известно, что одно
уравнение с двумя неизвестными имеет
множество решений. Следовательно,
существует множество значений радиуса
и соответствующих ему значений скорости
(а значит и энергии), удовлетворяющих
этому уравнению. Иными слова,
![]() могут меняться непрерывно и при переходе
с одной орбиты на другую, может испускаться
любая порция энергии. Чего на опыте не
наблюдается.
могут меняться непрерывно и при переходе
с одной орбиты на другую, может испускаться
любая порция энергии. Чего на опыте не
наблюдается.
Кроме того, планетарная модель атома
оказалась электродинамически неустойчивой.
Согласно законам электродинамики,
движущаяся с ускорением заряженная
частица должна излучать энергию и
вследствие этого электрон должен терять
энергию и приближаться к ядру. Как
показали расчеты, за время порядка
![]() с, электрон должен упасть на ядро и атом
прекратить свое существование, что
опять таки противоречит опыту. Итак, по
законам классической физики атом должен
быть неустойчив и в течение времени
существования должен излучать непрерывный
спектр. Оба этих вывода стоят в резком
противоречии с опытом.
с, электрон должен упасть на ядро и атом
прекратить свое существование, что
опять таки противоречит опыту. Итак, по
законам классической физики атом должен
быть неустойчив и в течение времени
существования должен излучать непрерывный
спектр. Оба этих вывода стоят в резком
противоречии с опытом.
Таким образом, построение модели атома в рамках классической физики оказалось невозможным.
В 1913 году Бор предпринял первую попытку построения квантовой модели атома, в которой он попытался объединить планетарную модель атома, спектральные закономерности и гипотезу Планка. В основу своей теории он положил два постулата.
1. Атомная система может находиться
только в определенных стационарных
состояниях. Каждому стационарному
состоянию соответствует определенное
значение энергии
![]() .
Находясь в стационарном состоянии, атом
не излучает энергии.
.
Находясь в стационарном состоянии, атом
не излучает энергии.
По Бору условие квантования имеет вид
![]() .
8.2
.
8.2
Решая совместно два уравнения
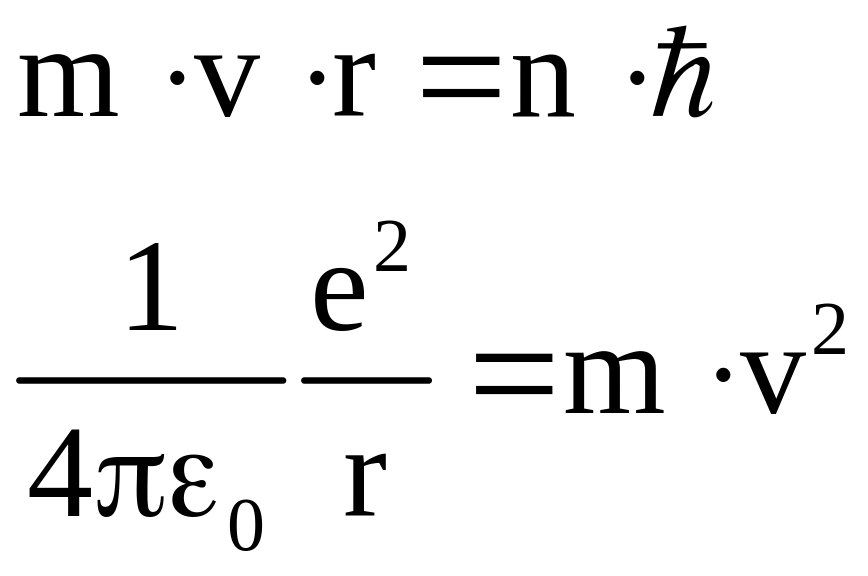 8.3
8.3
найдем, что
![]() и для скорости движения электрона
получаем следующее выражение
и для скорости движения электрона
получаем следующее выражение
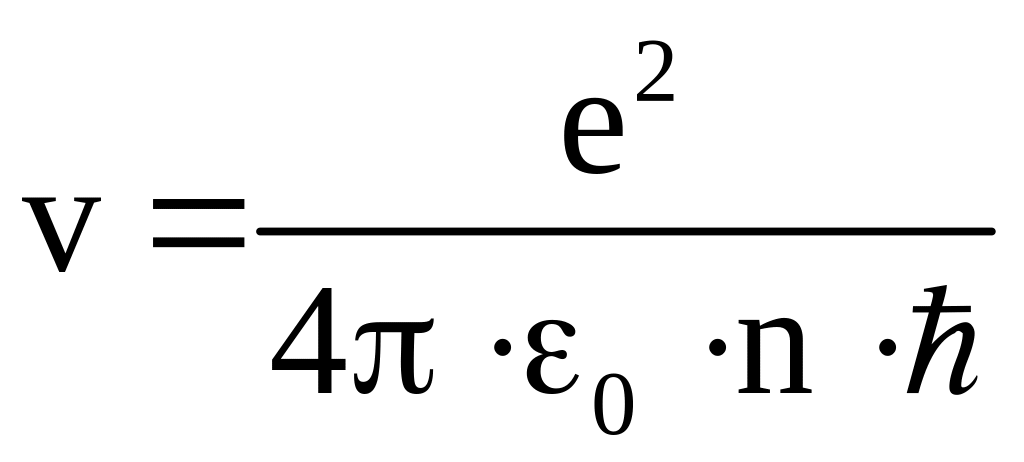 .
8.4
.
8.4
Радиус электронной орбиты будет определяться выражением
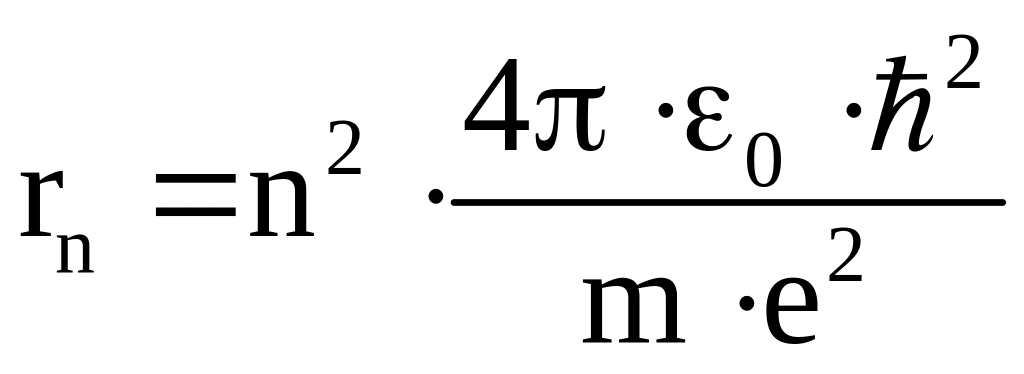 .
8.5
.
8.5
Для первой электронной орбиты получается
значение
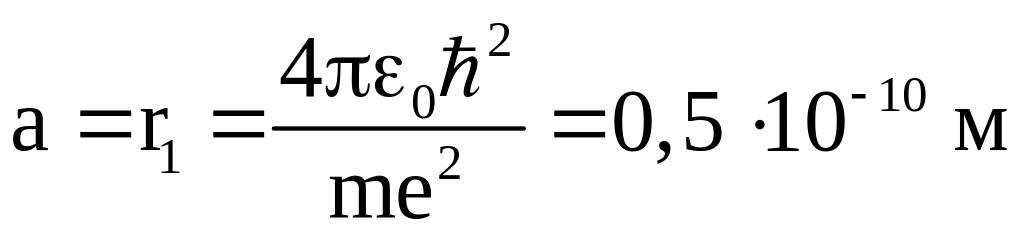 -
Боровский радиус или размер атома. Это
значение хорошо согласуется с данными
о размерах атома, полученными другими
методами.
-
Боровский радиус или размер атома. Это
значение хорошо согласуется с данными
о размерах атома, полученными другими
методами.
2. Излучение и поглощение энергии
атомом происходит при переходе системы
из одного стационарного состояния в
другое и при этом излучается (поглощается)
квант энергии равный разности энергий
стационарных состояний
![]() .
.
Зная скорость электрона и радиус электронной орбиты, мы можем определить полную энергию электрона в атоме водорода
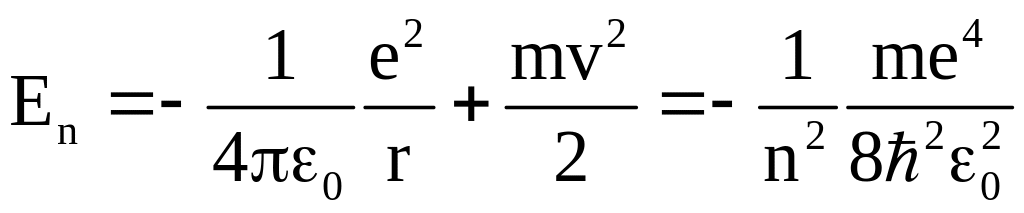 .
8.6
.
8.6
И тогда согласно второму постулату Бора
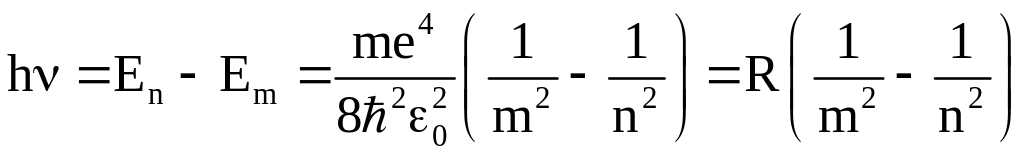 ,
8.7
,
8.7
где
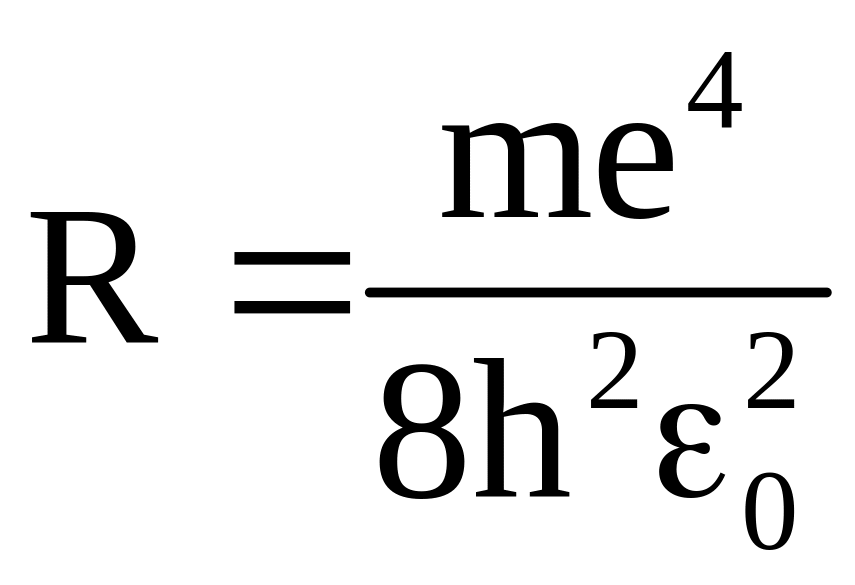 -
постоянная Ридберга. Тот факт, что
расчетное значение постоянной Ридберга
совпадает с экспериментальными данными,
полученными из спектроскопических
измерений, говорит о справедливости
полученной Бором формулы.
-
постоянная Ридберга. Тот факт, что
расчетное значение постоянной Ридберга
совпадает с экспериментальными данными,
полученными из спектроскопических
измерений, говорит о справедливости
полученной Бором формулы.
Теория Бора позволила объяснить возникновение серий в спектре атома водорода. Так серия Бальмера возникает при переходе электрона из возбужденного состояния на второй энергетический уровень, а серия Лаймана на первый уровень.
Спектр поглощения атома водорода, содержащий только серию Лаймана, также объясняется теорией Бора. Так как свободные атомы находятся в основном состоянии (с наименьшим значением энергии), то при поглощении света они могут переходить только из основного состояния в возбужденное.
Теория Бора стала крупным шагом в развитии квантовой теории. Однако она была внутренне противоречивой, так как в ней была предпринята попытка соединить классические законы и законы квантовой механики. Поэтому в рамках этой теории не удалось описать спектры более сложных атомов.
