
- •Тамбовское областное государственное автономное образовательное учреждение среднего профессионального образования «педагогический колледж г. Тамбова»
- •Тамбов , 2014 г.
- •Введение
- •Практическое занятие №1 Изучение газовых законов
- •Справочный материал
- •1. Закон Бойля-Мариотта
- •2. Законы Гей-Люссака и Шарля
- •3. Закон Авогадро
- •4. Уравнение Менделеева — Клапейрона
- •Практическое занятие №2 Расчет парциальных давление смесей газов
- •Справочный материал
- •Практическое занятие № 3 Решение задач по 1 закону термодинамики
- •Справочный материал
- •Частные случаи первого закона термодинамики для изопроцессов
- •Практическое занятие № 4 Расчет теплоемкости газов и их смесей
- •Справочный материал
- •Практическое занятие №5 Изучение термодинамического процесса
- •Справочный материал
- •Практическое занятие № 6 Изучение прямого цикла Карно
- •Справочный материал
- •Практическое занятие № 7 Изучение конструкции компрессора
- •Справочный материал
- •Поршневые компрессоры
- •Принцип работы поршневого компрессора
- •Практическое занятие № 8 Параметры водяного пара
- •Справочный материал
- •Практическое занятие № 9 Диаграмма водяного пара
- •Справочный материал
- •Практическое занятие № 10 Определение количества теплоты переданного через стенку
- •Справочный материал
- •Литература
Практическое занятие №5 Изучение термодинамического процесса
Цель работы: изучить термодинамические газовые процессы
Справочный материал
При исследовании термодинамических процессов используются уравнение состояния идеальных газов и математическое выражение первого закона термодинамики. В общем случае любые два термодинамических параметра из трех могут изменяться произвольно. Термодинамика изучает пять основных процессов идеальных газов:
1.изохорный, (v= const) происходящий при постоянном объеме газа; 2.изобарный, (р = const) происходящий при постоянном давлении; 3.изотермический, (Т = const) происходящий при постоянной температуре; 4.адиабатный, (q = 0) протекающий без подвода или отвода теплоты, т.е. протекающий без теплообмена с окружающей средой;
5.политропный — обобщенный процесс изменения всех параметров рабочего тела при наличии теплообмена; для него четыре предыдущих процесса являются частными случаями.
Для изучения этих процессов необходимо определить:
уравнение процесса, которое устанавливает закономерность изменения состояния рабочего тела; графическое изображение процесса в диаграммах; связь между параметрами в процессе; изменение внутренней энергии рабочего тела в процессе; работу, совершаемую рабочим телом в процессе; теплоту, участвующую в процессе.
Изохорный процесс Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа при v=const. Уравнение изохорного процесса: v = const.
Г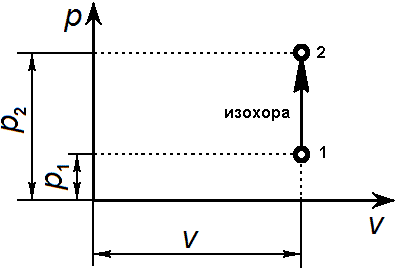 рафически
в p-v-диаграмме изохорный процесс
изображается линией, параллельной
оси давлений Линии изохорного процесса
в диаграмме состояния называется
изохорой.
рафически
в p-v-диаграмме изохорный процесс
изображается линией, параллельной
оси давлений Линии изохорного процесса
в диаграмме состояния называется
изохорой.
Связь между параметрами в изохорном процессе подчиняется закону Шарля
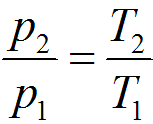
И
изохорном процессе вся подведенная
теплота расходуется на изменение
внутренней энергии тела. Для тела с
произвольной массой вещества m имеем:
![]()
![]()
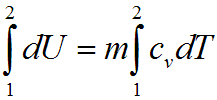
где cv — средняя массовая изохорная теплоемкость в интервале температур от T1, до Т2.
Теплоемкостью называется количество теплоты, которое следует подвести к единице количества вещества для нагревания его на 1 градус. Массовая теплоемкость выражается в кДж/(кг • К), объемная — в кДж/(м3 • К), мольная — в кДж/(кмоль • К).
Так как в изохорном процессе нет изменения объема, то и работа по его изменению не совершается: W1-2 = 0.
Количество
теплоты, подведенное в изохорном
процессе, равно изменению внутренней
энергии. Для произвольной массы вещества:
![]()
Изобарный процесс. Уравнение изобарного процесса р= const.
Графически изобарный процесс в р—v-диаграмме изображается прямой линией, параллельной оси объемов. Линия изобарного процесса называется изобарой.
С вязь
между параметрами в изобарным процессе
выража ется законом Гей-Люссака:
вязь
между параметрами в изобарным процессе
выража ется законом Гей-Люссака:
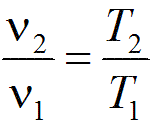
Изменение
внутренней энергии газа рассчитывается
по формуле:
![]()
В
изобарном процессе происходит изменение
объема рабочего тела, следовательно,
совершается работа, определяемая:

![]()
Для произвольной массы газа m формула работы примет:
![]()
где V1, V2 - объем m кг газа в начале и конце процесса, м3. Воспользовавшись первым законом термодинамики, можем рассчитать теплоту процесса (для 1 кг газа) по формуле:
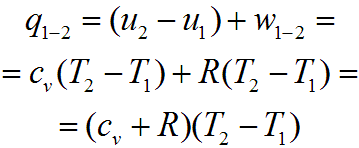
При
этом в термодинамике существует связь
между изохорной cv
и изобарной ср
теплоемкостями. Связь устанавливается
уравнением Майера:
![]()
Тогда выражение для определения количества теплоты для 1 кг газа примет вид:
![]()
для
произвольной массы газа:
![]()
Таким образом, в изобарном процессе теплота расходуется на совершение работы и на изменение внутренней энергии рабочего тела.
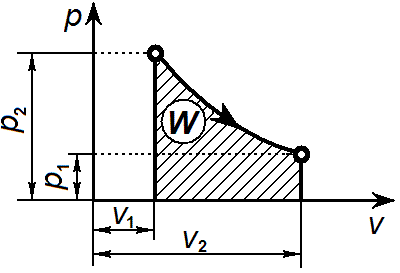
Изотермический процесс. Уравнение изотермического процесса: Т= const или pv = const.Графически изотермический процесс в р—v-диаграмме изображается в виде равнобокой гиперболы что вытекает из уравнения pv = const, и называется изотермой.
 Связь
между параметрами изотермического
процесса определяется законом Бойля —
Мариотта:
Связь
между параметрами изотермического
процесса определяется законом Бойля —
Мариотта:
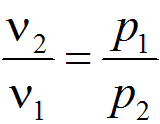
Так
как Т1 = Т2, изменение внутренней энергии
газа в изотермическом процессе равно
нулю:
![]()
Совершенная 1 кг газа работа в изотермическом процессе, c учетом того что RT = const, определяется следующим образом:
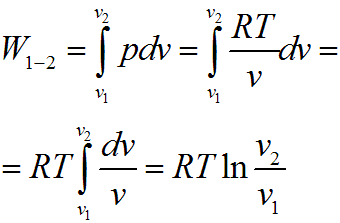
Пользуясь
законом Бойля — Мариотта, получим:

Для произвольной массы рабочего тела уравнение работы примет вид:

Графически в p-v диаграмме работа в процессе 1-2 определяется площадью под изотермой. Теплота, участвующая в изотермическом процессе, определится соотношением:
![]()
Это означает что вся подведенная в изотермическом процессе теплота расходуется на совершение работы.
Адиабатный
процесс. Уравнение
адиабатного процесса имеет вид:
![]()
где k =cp/cv -показатель адиабаты для идеального газа.
Графически адиабатный процесс на p-v-диаграмме изображается неравнобокой гиперболой, называемой адиабатой. Адиабата круче изотермы, так как к > 1.
С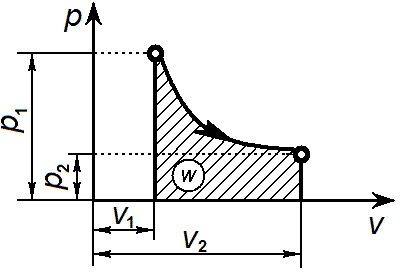 вязь
между параметрами процесса определяется,
используя уравнение адиабаты и уравнение
состояния газа pv = RT:
вязь
между параметрами процесса определяется,
используя уравнение адиабаты и уравнение
состояния газа pv = RT:
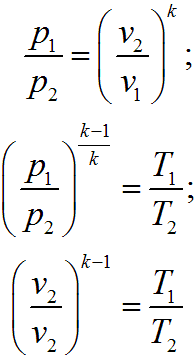
Изменение внутренней энергии для т кг вещества определяется по формуле:
![]()
Работа
в адиабатном процессе, совершенная 1 кг
газа, может быть определена из уравнения
первого закона термодинамики :
![]()
Так как в адиабатном процессе q=0, то:
![]() и
и
![]()
то есть работа расширения в адиабатном процессе совершается за счет уменьшения внутренней энергии газа.
Адиабатный процесс протекает без подвода теплоты, следовательно Q=0.
Политропный
процесс
Уравнение политропного
процесса имеет вид
![]()
где n - показатель политропы, который изменяется для разных процессов от 0 до + бесконечности. Рассмотренные ранее процессы являются частными случаями иолитроппых процессов:
е сли
n = к, то pvk = const — адиабатный процесс;
если
n = 1, то pv = const — изотермический процесс;
если
n = 0, то pv0 = p = const — изобарный процесс;
если
n ± ?, то представив pvn = const как рn v =
const, имеем v=const — изохорный процесс.
Показатель
изотропы n
можно определить, если известны два
состояния политропном процесс
сли
n = к, то pvk = const — адиабатный процесс;
если
n = 1, то pv = const — изотермический процесс;
если
n = 0, то pv0 = p = const — изобарный процесс;
если
n ± ?, то представив pvn = const как рn v =
const, имеем v=const — изохорный процесс.
Показатель
изотропы n
можно определить, если известны два
состояния политропном процесс
![]()

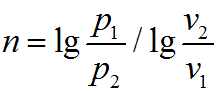
Графическое изображение политропного процесса в р—v-диаграмме имеет вид кривой, которая называется политропой. Соотношение параметров данного процесса можно получить, заменив в уравнениях адиабатного процесса показатель степени k на показатель n: Изменение внутренней энергии в политропном процессе для произвольной массы вещества определяется по формуле
Работа
изменения объема в политропном процессе
для 1 кг рабочего тела равна
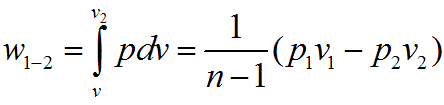 или, учитывая уравнение состояния
Клапейрона,
или, учитывая уравнение состояния
Клапейрона,
![]()
Для
произвольной массы газа
![]()
Количество теплоты в политропном процессе для m кг вещества определяется выражением, полученным в соответствии с первым законом термодинамики
![]()
![]()
Задание: записать в отчет данные о термодинамических процессах
