
- •Тамбовское областное государственное автономное образовательное учреждение среднего профессионального образования «педагогический колледж г. Тамбова»
- •Тамбов , 2014 г.
- •Введение
- •Практическое занятие №1 Изучение газовых законов
- •Справочный материал
- •1. Закон Бойля-Мариотта
- •2. Законы Гей-Люссака и Шарля
- •3. Закон Авогадро
- •4. Уравнение Менделеева — Клапейрона
- •Практическое занятие №2 Расчет парциальных давление смесей газов
- •Справочный материал
- •Практическое занятие № 3 Решение задач по 1 закону термодинамики
- •Справочный материал
- •Частные случаи первого закона термодинамики для изопроцессов
- •Практическое занятие № 4 Расчет теплоемкости газов и их смесей
- •Справочный материал
- •Практическое занятие №5 Изучение термодинамического процесса
- •Справочный материал
- •Практическое занятие № 6 Изучение прямого цикла Карно
- •Справочный материал
- •Практическое занятие № 7 Изучение конструкции компрессора
- •Справочный материал
- •Поршневые компрессоры
- •Принцип работы поршневого компрессора
- •Практическое занятие № 8 Параметры водяного пара
- •Справочный материал
- •Практическое занятие № 9 Диаграмма водяного пара
- •Справочный материал
- •Практическое занятие № 10 Определение количества теплоты переданного через стенку
- •Справочный материал
- •Литература
3. Закон Авогадро
Читается он так: при одной и той же температуре и под одним и тем же давлением в равных объемах различных газов содержится равное число молекул.
Следовательно, грамм-молекулы веществ, находящихся в идеальном газовом состоянии при одинаковых условиях, занимают равные объемы. Установлено, что при нормальных условиях (0°С и давление 760 мм рт. ст.) объем грамм-молекулы газа равен округленно 22,4 литра.
Пример 4. Какова масса 6,825 литра кислорода при нормальных условиях?
Дано: V = 6,825 л Найти: m |
Решение: Молекулярная масса кислорода равна 32; 1 моль кислорода весит 32 г. Объем моля газа при нормальных условиях равен 22,4 л. Составляем пропорцию: 32 г О2 занимают объем 22,4 л m г О2 занимают объем 6,825 л Тогда
масса кислорода равна
|
4. Уравнение Менделеева — Клапейрона
Оно
выведено на основе объединенного закона
Бойля-Мариотта и Гей-Люссака с применением
закона Авогадро. Для одной грамм-молекулы
любого вещества, находящегося в идеальном
газовом состоянии, уравнение
Менделеева-Клапейрона имеет выражение:
 или PV
= RT
(11) .
или PV
= RT
(11) .
В том случае, если имеется не один, а n молей газа выражение принимает вид: PV = nRT (12) ,
где R—универсальная газовая постоянная, не зависящая от природы газа.
Так
как число грамм-молей газа
 , где m—
масса газа, а М—его
молекулярная масса, то выражение (12)
принимает вид:
, где m—
масса газа, а М—его
молекулярная масса, то выражение (12)
принимает вид:
 (13).
(13).
Числовое
значение R
зависит от единицы измерения давления
и объема. Величина ее выражается в
единицах энергия/моль´град.
Для нахождения числовых значений R
используем
уравнение (11), применив его для 1 моля
идеального газа, находящегося в нормальных
условиях,
 .
.
Подставив
в уравнение (11) числовые значения Р=1
атм, T=
273° и V = 22,4 л, получаем

В
международной системе единиц СИ давление
выражается в ньютонах на м2
(н/м2),
а объем в м3.
Тогда
 .
.
Пользуясь уравнением Менделеева - Клапейрона можно производить следующие расчеты: а) нахождение физических параметров состояния газа по его молекулярной массе и другим данным, б) нахождение молекулярной массы газа по данным о его физическом состоянии
Пример 5. Сколько весит азот, находящийся в газгольдере диаметром 3,6 м и высотой 25 м при температуре 25ºС и давлении 747 мм рт. ст.?
Дано: Р = 747 мм рт. ст. Т = 25ºС = 25 + 273 = 298 К d = 3,6 м Мол. масса азота 28 Найти: m |
Решение:
Находим объем газгольдера, т.е. объем,
который занимает азот:
Используем
уравнение Менделеева - Клапейрона и
находим:
|
Задание: произвести запись теоретического материала в отчет, уметь объяснять способы решения приведенных задач.

 .
. ;
;
 .
.
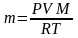 .
Подставив, вычисляем результат:
.
Подставив, вычисляем результат:
