
- •Тамбовское областное государственное автономное образовательное учреждение среднего профессионального образования «педагогический колледж г. Тамбова»
- •Тамбов , 2014 г.
- •Введение
- •Практическое занятие №1 Изучение газовых законов
- •Справочный материал
- •1. Закон Бойля-Мариотта
- •2. Законы Гей-Люссака и Шарля
- •3. Закон Авогадро
- •4. Уравнение Менделеева — Клапейрона
- •Практическое занятие №2 Расчет парциальных давление смесей газов
- •Справочный материал
- •Практическое занятие № 3 Решение задач по 1 закону термодинамики
- •Справочный материал
- •Частные случаи первого закона термодинамики для изопроцессов
- •Практическое занятие № 4 Расчет теплоемкости газов и их смесей
- •Справочный материал
- •Практическое занятие №5 Изучение термодинамического процесса
- •Справочный материал
- •Практическое занятие № 6 Изучение прямого цикла Карно
- •Справочный материал
- •Практическое занятие № 7 Изучение конструкции компрессора
- •Справочный материал
- •Поршневые компрессоры
- •Принцип работы поршневого компрессора
- •Практическое занятие № 8 Параметры водяного пара
- •Справочный материал
- •Практическое занятие № 9 Диаграмма водяного пара
- •Справочный материал
- •Практическое занятие № 10 Определение количества теплоты переданного через стенку
- •Справочный материал
- •Литература
Практическое занятие № 9 Диаграмма водяного пара
Цель работы: изучить процесс парообразования и представления в h-s диаграмме.
Справочный материал
H, s-диагра́мма (чит. «аш-эс-диаграмма») (написание строчными буквами:«h,s-диаграмма»,) — диаграмма теплофизических свойств жидкости и газа (в основном воды и водяного пара), показывающая характер изменения различных свойств, в зависимости от параметров состояния.
В основном большое применение получили h, s-диаграммы воды и водяного пара, так как в качестве рабочего тела втеплотехнике чаще всего применяются именно вода и водяной пар, из-за их сравнительной дешевизны и доступности, причём наиболее пристальное внимание оказывается именно той части диаграммы, в которой вода впарообразном состоянии, так как в жидком состоянии она практически несжимаема.
Ещё в 1904 году немецкий теплофизик Рихард Молье разработал специальную диаграмму для упрощения и облегчения решений практических задач по теплотехнике, в которой в координатах энтальпии (h) и энтропии (s) графически отображаются сведения из таблиц состояний. В 1906 году в Берлине была издана его книга «Новые таблицы и диаграммы для водяного пара». Впоследствии такая диаграмма получила название Диаграмма Молье. В СССР некоторое время было принято название i, s-диаграмма, а в настоящее время - h, s-диаграмма.
Структура
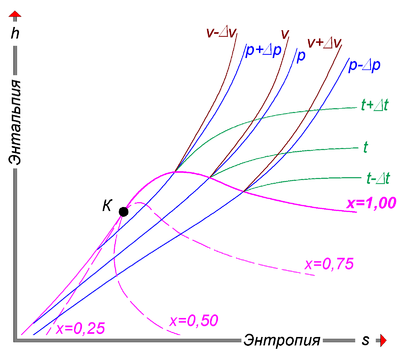
Структура h, s-диаграммы
H, s-диаграммы чаще всего содержат в себе данные о свойствах воды в жидком и газообразном состояниях, так как они представляют наибольший интерес с точки зрения теплотехники.
Степень сухости - это параметр, показывающий массовую долю насыщенного пара в смеси воды и водяного пара. Значение x = 0 соответствует воде в момент кипения (насыщения). Значение х = 1, показывает, что в смеси присутствует только пар. При нанесении соответствующих точек в координатах (h,s), взятых из таблиц насыщения справочников свойств воды и водяного пара, при их соединении получаются кривые, соответствующие определённым степеням сухости. В таком случае, линия х = 0 является нижней пограничной кривой, а х = 1 - верхней пограничной кривой. Область, заключённая между этими кривыми, является областью влажного пара. Область ниже кривой х = 0, которая стягивается практически в прямую линию (не показана), соответствует воде. Область выше кривой х = 1 - соответствует состоянию перегретого пара.
Критическая точка (К). При определённом, достаточно высоком давлении, называемом критическим, свойства воды и пара становятся идентичными. То есть исчезают физические различия между жидким и газообразным состояниями вещества. Такое состояние называют критическим состоянием вещества, которому соответствует положение критической точки. Следует заметить, что она на пограничной кривой лежит гораздо левее максимума этой кривой.
Изотерма - изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённой температуре. Изотермы пересекают пограничные кривые с изломом и, по мере удаления от верхней пограничной кривой, асимптотически приближаются к горизонтали. На схеме для упрощения представлены только три изотермы: t + Δt; t; t - Δt.
Изобара - изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённому давлению. Изобары не имеют изломов при пересечении пограничных кривых. На схеме представлены только три изобары:
p + Δp; p; p - Δp.
Изохора - изолиния, построенная методом объединения точек по значениям энтальпии и энтропии, соответствующих определённому объёму. Изохоры на h, s-диаграмме в области перегретого пара, всегда проходит круче, чем изобары, и это облегчает их распознавание на одноцветных диаграммах. Построение изохор требует более кропотливой работы с таблицей состояний. На схеме представлены только три изохоры:
v - Δv; v; v + Δv.
Изотермы и изобары в области влажного пара совпадают по причине линейной зависимости в состоянии насыщения.
Определение параметров жидкости и пара по таблицам и h-s диаграмме
Таблицы для определения термодинамических свойств веществ различаются в зависимости от того, какое состояние рассматривается: однофазное или двухфазное. В таблицах для состояния насыщения приводятся удельные значения объема, энтальпии и энтропии воды и водяного пара (см. табл. 7 приложения); хладона R-22 (см. табл. 5 приложения); аммиака (см. табл. 6 приложения).
Параметры насыщенной жидкости (х = 0) отмечаются одним штрихом, Параметры сухого насыщенного пара (х = 1) отмечаются двумя штрихами.
Для определения свойств каждой из фаз в состоянии насыщения надо знать только один параметр – давление или температуру, так как при этих условиях параметры однозначно связаны между собой. В этих же таблицах приводится удельная теплота парообразования r.
Для расчета параметров влажного пара необходимо знать дополнительно степень сухости пара х.
Энтальпия h, энтропия s и удельный объем v влажного пара определяются по формулам: h = h˝·x + h΄·(1–x) = h΄+ r · x,
s = s˝∙x + s΄·(1–x) = s΄+ r·x/ТS,
v = v˝· x + v΄· (1–x).
Степень сухости пара определяется по одной из следующих формул:

Для определения свойств ненасыщенной жидкости и перегретого пара (однофазное состояние) нужно знать два параметра (обычно давление и температуру). В ячейке таблицы, соответствующей данному состоянию, помещены удельные значения объема v, энтальпии h и энтропии s.
На h-s диаграмме обычно изображаются:
линии изобар (p = const);
л инии
изотерм (t
= const);
в области влажного пара изотермы не
представлены, так как они совпадают с
изобарами; изохоры (v
= const)
– пунктирной линией или линией другого
цвета;линии постоянной степени сухости
влажного пара (x
= const)
‑ в области влажного насыщенного
пара.
инии
изотерм (t
= const);
в области влажного пара изотермы не
представлены, так как они совпадают с
изобарами; изохоры (v
= const)
– пунктирной линией или линией другого
цвета;линии постоянной степени сухости
влажного пара (x
= const)
‑ в области влажного насыщенного
пара.
З адача
1. Определить
температуру насыщения, энтальпию и
энтропию влажного водяного пара при
давлении 2,0 бара и степени сухости 0,9
(рис. 2).
адача
1. Определить
температуру насыщения, энтальпию и
энтропию влажного водяного пара при
давлении 2,0 бара и степени сухости 0,9
(рис. 2).
Решение: по h-s диаграмме:
Решение по таблице: из таблицы водяного пара находим параметры кипящей воды «′» и сухого насыщенного пара «″» при 2,0·105 Па
р |
tн |
v′ |
v″ |
h′ |
h″ |
r |
s′ |
s″ |
Па |
ºC |
м3/кг |
м3/кг |
кДж/кг |
кДж/кг |
кДж/кг |
кДж/ (кг·К) |
кДж/ (кг·К) |
2,0·105 |
120,23 |
0,0010608 |
0,8859 |
504,7 |
2706,9 |
2202,2 |
1,5301 |
7,1286 |
По этим данным определяются энтальпия пара h и энтропия s:
h = h΄+ r·x = 504,7 + 2202,2·0,9 = 2486,68 кДж/кг.
s = s΄+ (r·x)/TS = 1,5301 + (2202,2·0,9)/(120,23+273) = 6,57 кДж/(кг·К).
Температура насыщения: tS = 120,23 ºС.
Задание: изучить структурудиаграммы состояния водяного пара
