
- •Лекционный комплекс: Лекция №1
- •3. План и тезисы лекции:
- •3.1. План лекции
- •3.2. Тезисы лекции
- •4. Литература
- •5. Контрольные вопросы:
- •6. Иллюстративный и раздаточный материал:
- •Лекция №2
- •3. План и тезисы лекции:
- •3.1. План лекции.
- •3.2. Тезисы лекции
- •4. Литература
- •5. Контрольные вопросы.
- •Лекция №3
- •3. План и тезисы лекции:
- •3.1. План лекции
- •3.2. Тезисы лекции
- •При малых концентрация адсорбтива можно пренебречь в знаменателе его концентрацией с, тогда уравнение примет вид:
- •4. Литература
- •5.Контрольные вопросы
- •Лекция №4
- •3. План и тезисы лекции
- •3.1. План лекции
- •3.2. Тезисы лекции
- •Строение карбоксильной группы
- •4. Литература:
- •5. Контрольные вопросы
- •6. Иллюстративный и раздаточный материал:
- •Лекция №5
- •3. План и тезисы лекции:
- •3.1. План лекции
- •3.2. Тезисы лекции
- •Производные моносахаридов
- •4. Литература:
- •5. Контрольные вопросы
- •Лекция №6
- •3. План и тезисы лекции:
- •3.1. План лекции
- •3.2. Тезисы лекци
- •Химические свойства аминокислот
- •4. Литература:
- •5. Контрольные вопросы:
- •6. Иллюстративный и раздаточный материал:
4. Литература:
Н.А. Тюкавкина, Ю.И. Бауков. Биоорганическая химия. М. 1991. с. 197-207, 247-252.
Н.А. Тюкавкина. Руководство к лабораторным занятиям по биоорганической химии. М. 1985. с. 108-117.
5. Контрольные вопросы
Какие соединения называются карбоновыми кислотами?
Объясните электронное строение карбоксильной группы: сколько реакционных центров в ней?
Объясните устойчивость карбоксилат-иона?
Укажите, разрыв каких связей происходит при получении функциональных производных карбоновых кислот?
Какие реакции характерны для карбоновых кислот?
Какая реакция называется реакцией этерификации? Приведите пример?
В какой среде протекает реакция гидролиза функциональных производных карбоновых кислот?
Дайте общую характеристику сложным эфирам, амидам, ангидридам, галогенангидридам и ацетилкоферменту-А.
Что такое ацилирующий реагент?
Биологическая роль карбоновых кислот и их функциональных производных.
6. Иллюстративный и раздаточный материал:
Таблицы:
1. Распределение электронной плотности в карбоксиле (№25)
2. Монокарбоновые кислоты предельного ряда (№55)
Монокарбоновые кислоты непредельного ряда (№54)
Электрофильные и нуклеофильные реагенты (№202)
Значение рКа некоторых карбоновых кислот и фенолов (№223)
Лекция №5
1. Тема: Углеводы.
2. Цель: Сформировать знания о классификации, о строении, о химических свойствах углеводов. Изучение темы способствует, формирует знание о строении и свойствах углеводов, как основу для понимания их метаболизма в живом организме
3. План и тезисы лекции:
3.1. План лекции
Углеводы, классификация, карбонильные и проекционные формулы Фишера, формулы Колли-Толленса, формулы Хеуорса.
Моносахариды - строение, изомерия, таутомерия.
Химические свойства моносахаридов
Дисахариды: мальтоза, целлобиоза, лактоза, сахароза.
Полисахариды: гомополисахариды и гетерополисахариды.
Биологическое значение углеводов.
3.2. Тезисы лекции
Углеводы – широко распространенные в живой природе органические соединения. Термин «углеводы», предложен в 1844 г химиком К. Шмидтом (Россия) в связи с тем, что большинство представителей этого класса по составу отвечало сочетанию углерода с водой, например: С6Н12О6 → 6С + 6Н2О; Сn(H2O)n.
Класс углеводов делят на две группы:
простые углеводы (моносахариды) или монозы
сложные углеводы (гомополисахара и гетерополисахара)
Простые углеводы не способны гидролизоваться, а сложные углеводы гидролизуются с образованием простых углеводов.
Моносахариды - это гетерофункциональные соединения. Они представляют собой альдегиды и кетоны многоатомных спиртов (или их циклические полуацетали). В зависимости от наличия альдегидной или кетонной группы различают альдозы и кетозы. Моносахариды содержат в молекуле от 3 до 10 углеродных атомов.
Изомерия моносахаридов связана с наличием: 1) альдегидной и кетонной групп; 2) асимметрических углеродных атомов (оптическая изомерия). Принадлежность моносахаридов к D- или L- ряду определяется правилом М.А. Розанова: по конфигурации самого удаленного от старшей (карбонильной) группы асимметричного атома углерода (пентозы С-4, гексозы С-5).
Карбонильные формулы гексоз:
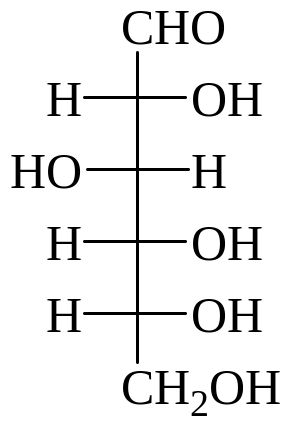
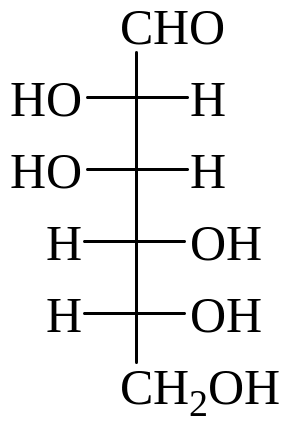

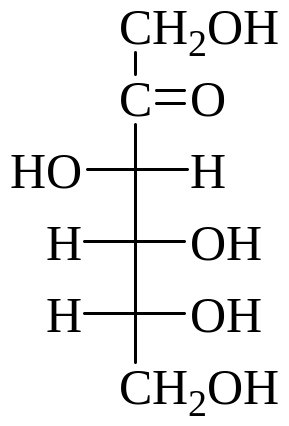
D-глюкоза D-манноза D-галактоза D-фруктоза
Моносахариды существуют в виде ациклических (карбонильные формы) и циклических полуацетальных форм. Ациклические и циклические формы моносахаридов являются изомерами по отношению друг к другу. Такой вид изомерии называется цикло-оксо-таутомерией.
Циклические (Хеуорса) формулы гексоз:



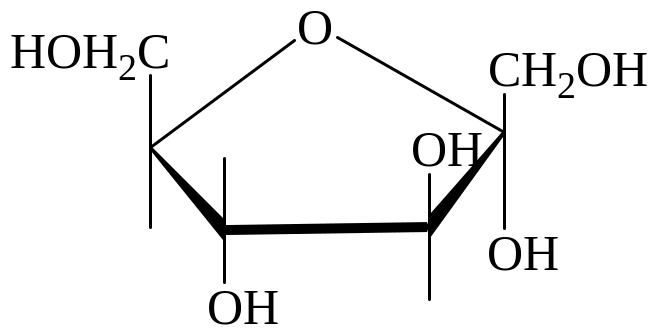
-D-глюкоза -D-глюкоза -D-галактоза -D-фруктоза
Для сахаров в циклическом виде возможна конформационная изомерия, связанная с расположением в пространстве углеродных атомов шестичленного цикла. Реакции полуацетального гидроксила. Моносахариды имеющие строение циклических полуацеталей, при взаимодействии со спиртами в присутствии кислотного катализатора в безводных условиях, образуют полные ацетали.

-D-галактопираноза Метил--D-галактопиранозид
Полуацетальный или гликозидный гидроксил не проявляет свойств спиртов, а ведет себя специфически, образуя О- и N-гликозиды. Гликозиды, как и все ацетали, гидролизуются в кислой среде, устойчивы к действию разбавленных щелочей. Гидролиз гликозидов представляет собой реакцию обратную реакции образования гликозидов
Как многоатомные спирты моносахариды растворяют гидроксид меди (II), образуя хелатное соединение синего цвета. Эта реакция используется для обнаружения моносахаридов и гликозидов.
Простые эфиры образуются при взаимодействии с галогеналканами. Одновременно со спиртовыми гидроксильными группами в реакцию вступает и полуацетальный гидроксил, в результате чего получается простой эфир гликозида.
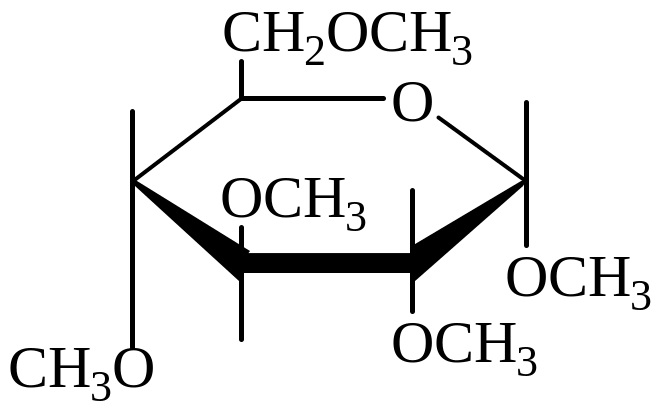

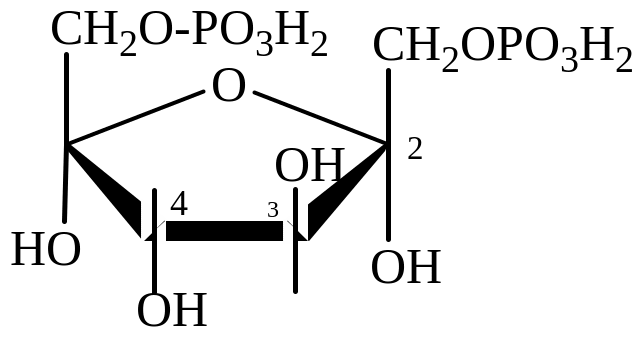
Простой эфир Сложные эфиры: фосфаты α-глюкозы и α-фруктозы
Сложные эфиры образуются по реакции этерификации ОН-групп под действием кислородсодержащих кислот (органических и неорганических) или их ангидридов. Биологическое значение имеют эфиры фосфорной кислоты – фосфаты.
Восстановление карбонильной группы моносахаридов водородом на никеле или палладии приводит к образованию многоатомных спиртов: глюкоза – сорбит (D-глюцит), манноза - маннит, D-ксилоза - ксилит, галактоза - дульцит. Ксилит и сорбит – сладкие на вкус кристаллические вещества, хорошо растворимые в воде, используются как заменители сахара при сахарном диабете. Сорбит является промежуточным продуктом в промышленном получении аскорбиновой кислоты (витамин С).
Окисление моносахаридов.
Схема химической реакции Сх(Н2О)у + хО2 хСО2 + уН2О + Q соответствует процессу полного окисления (сгорания) углеводов.
В зависимости от условий окисления моносахаридов образуются гликановые, гликаровые и гликуроновые кислоты.
Нейтральная среда. Происходит окисление только альдегидной группы в карбоксильную в нейтральной или кислой среде (мягкое окисление). Окисление глюкозы бромной водой в присутствии мела (идет на нейтрализацию образующейся НВr) при комнатной температуре приводит к образованию глюконовой (гликоновой) кислоты:
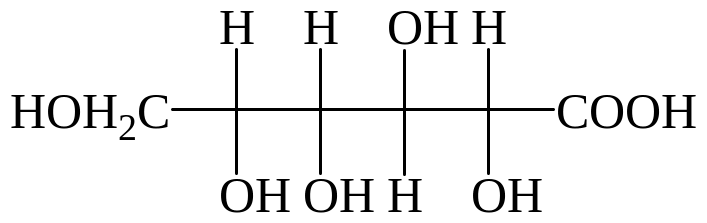
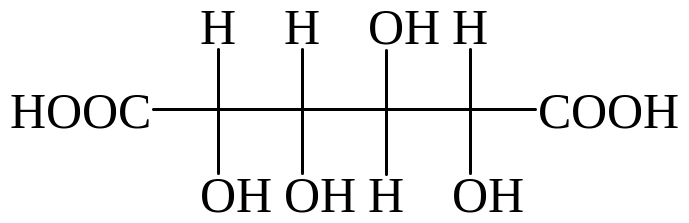
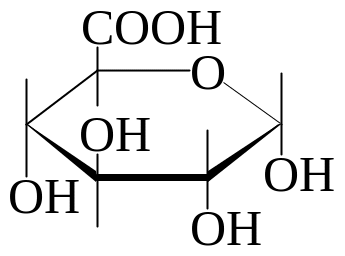
глюконовая кислота глюкаровая кислота глюкуроновая кислота
Глюконовая кислота в виде кальциевых солей (глюканат кальция) нашла широкое прменение в практической медицине (при аллергиях, повышенной проницаемости кровеносных сосудов и т.д.).
Кислая среда. При нагревании моносахаридов с разбавленной азотной кислотой одновременно с альдегидной группой окисляется первичная спиртовая группа на другом конце цепи моносахарида, что приводит к образованию двухосновных гидроксикислот (гликаровые кислоты). Глюкоза – глюкаровая кислота.
Щелочная среда. При окислении в щелочной среде с нагреванием моносахариды претерпевают глубокие изменения с расщеплением углеродной цепи. При этом такие окислители как оксид серебра Ag2O (реакция серебряного зеркала) и гидроксид меди (II) Сu(OH)2 восстанавливаются до металлического серебра и оксида меди (I) (проба Троммера).
В тканях организма человека при окислении глюкозы может образоваться глюкуроновая кислота (альдегидная группа защищена и сохраняется, окисляется только первичная спиртовая группа). При окислении галактозы образуется галактуроновая кислота. Уроновые кислоты выполняют в печени человека защитную роль, участвуя в обезвреживании ядовитых веществ, поступающих извне или образующихся в результате жизнедеятельности. Декарбоксилирование уроновых кислот приводит к образованию пентоз (глюкуроновая кислота → ксилоза + СО2).
