
- •Анализдің электрохимиялық әдістері
- •Жұмыстың орындалу реті
- •Кондуктометриялық титрлеу қондырғысын құрастыру.
- •Қысқаша теориялық мағлұмат
- •Электрөткізгіштік.
- •Кондуктометриялық титрлеу қисықтары.
- •Жаттығулар мен есептер
- •Бақылау сұрақтары
- •Жұмыстың орындалу реті
- •Қысқаша теориялық мағлұмат
- •Жұмыстың орындалу реті
- •Қысқаша теориялық мағлұмат
- •Бақылау сұрақтары
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Жұмыстың орындалу реті
- •Нитрат иондарын анықтау жолы
- •Бақылау сұрақтары:
- •Жұмыстың орындалу реті.
- •Қысқаша теориялық мағлұмат
- •Диффузиялық ток
- •Тамшылайтын сынап электроды (т.С.Э.). Илькович теңдеуі
- •Жұмыстың орындалуы
- •Қысқаша теориялық мағлұмат Амперометриялық титрлеу
- •Амперометриялық титрлеудің түрлері
- •Жалғыз және қос индикаторлық электродтарды пайдалануға арналған амперометриялық титрлеу әдістері
- •Бақылау сұрақтары:
- •Жұмыстың орындалуы
- •Никель (іі) иондарын титрлеу.
- •Амперометриялық титрлеудің түрлері
- •Бақылау сұрақтары
- •1. Кулонометрия. Кулонометрлік қондырғылар.
- •2. Кулонометриялық титрлеу әдісінің негізі.
- •Қысқаша теориялық мағлұмат
- •Бақылау сұрақтары:
- •1. Кулонометрия. Кулонометрлік қондырғылар.
- •2. Кулонометриялық титрлеу әдісінің негізі.
- •Қысқаша теориялық мағлұмат Кулонометриялық титрлеу
- •Кулонометриялық титрлеуде жиі қолданылатын электрогенерацияланатын титранттар мен олардың көмегімен анықталынатын заттар
- •Бақылау сұрақтары:
- •Жұмыстың орындалу реті
- •Қысқаша теориялық мағлұмат
- •Құрамында хром иондары бар ағызынды суларды тазарту әдістері
- •Реагенттік әдістің модификациялары.
- •Бақылау сұрақтары:
- •Жұмыстың орындалу реті
- •Жұмыстың орындалу реті
- •Бақылау сұрақтары
- •Жұмыстың орындалуы:
- •NaF салыстыру ерiтiндiлерiн дайындау
- •Қысқаша теориялық мағлұмат
- •9 Сурет. Фторид селективтi электрод:
- •Бақылау сұрақтары:
- •Жұмыстың орындалу реті
- •Бихромат-кобальтты шкаласы бойынша судың түсін анықтау
- •Қысқаша теориялық мағлұматlkbbbnb
- •Бақылау сұрақтары:
- •Сабақ тақырыбына сәйкес әдебиеттер тізімі:
Жұмыстың орындалу реті
рН-ты өлшеу алдында жаңа шыны электрод бiр күн уақыттай 0,1 М HCl ерiтiндiсiнде немесе дистилденген суда тұруы қажет. Электродтарды тексеру және приборды (рН-метр) дайындауды буферлi ерiтiндi бойынша жүргiзедi.
Егер бiр буферлi ерiтiндi қолданылса мүмкiндiгiнше зерттелетiн ерiтiндi рН-ы тұратын диапазондағы рН-ты таңдаған дұрыс. Сенiмдi болу үшiн прибор көрсеткiшiн басқа буферлi ерiтiндi бойынша тексередi. Өлшеу қателiгi 0,05 рН мәнiнен аспауы тиiс.
Приборлың дұрыстығын буферлік ерітінділер бойынша келесі реттілікпен тексереді: стаканға буферлі ерітіндінің біреуін (мысалы, рН=4,01) құяды, оған электродтарды батырып, электродтарды приборға жалғайды. Приборды рН өлшеуіш диапазонына қосады. Температура көрсеткіш корректорды қажетті температураға сәйкестендіріп, приборды берілген буферлі ерітіндінің рН мәндері бойынша тексереді. Буферлік ерітіндіге әрбір батырған сайын электродтарды жақсылап дистилденген сумен шайып, сүзгі қағазымен құрғатады. Прибор шкаласы бойынша рН-ты өлшеу 0,5-1 минут сайын жүргізіледі.
Анықтаудың орындалуы:
Приборды ток көзіне қосады 30 минут қыздыруға қояды. Приборды екі буферлі ерітінді бойынша рН-тың қышқылдық және сілтілі аумақтарына дайындайды. Ол үшін стаканға сәйкес келетін буферлі ерітіндіні құйып, электродтарды батырады, рН мәнін тіркейді, егер қажет болса арнайы дайындау көмегімен дұрыстайды. Буферлі немесе зерттелетін ерітіндіге электродтарды әрбір рет батырғанда, электродтарды дистелденген сумен жуады және электродтың беттік қабатын судың артық мөлшерін фильтр қағазымен абайлап сүртеді.
Анализденетін ерітіндіге рН шамасын өлшейді, электродтарды дистельденген сумен жуып, оларды суға батырылған күйде қалдырады.
Стаканға зерттелетін судың сынамасын алады, оған шайылған және құрғатылған электродтарды батырып, рН-ын өлшейді.
Сутегі және гидроксил иондарының концентрациясын (моль/л) есептейді: [H+]=10-pH, [OH-]=10pH-pKw.
Қысқаша теориялық мағлұмат
Анализ және зерттеудiң электрохимиялық тәсiлдерi негiзiнде, электродтарда немесе электрод арасындағы кеңiстiкте жүретiн процестер жатыр. Анализдi орындау кезiнде, анализденетiн ерiтiндi концентрациясына ток, потенциал, электроөткiзгiштiң (кедергi) функцияналды тәуелдiлiгiн қолданады немесе осы параметрлердi, анықталатын затты сәйкес келетiн титрантпен титрлеудiң соңғы нүктесiн анықтау мақсатында өлшейдi. Ерiтiндiнiң электрлiк қасиетiн сипаттайтын параметрлер санының шектеулi болуына қарамастан, анализдiң көптеген электрохимиялық тәсiлдерi белгiлi.
Анализдiң электрохимиялық тәсiлдерi, қазiргi заманғы аналитикалық химияда маңызды роль атқарады; ол жоғары сезiмталдықпен, анықтаудың төменгi шектерiмен, анықталатын қоспаның кең интервалымен, аппаратураның қарапайымдылығымен және арзан болуымен сипатталады. Электроаналитикалық тәсiлдiң айтарлықтай ерекшелiктерiне, оларды практикалық қолданудың кең спектрi – су, атмосфералық жауын-шашын құрамынан улы металл iздерiн анықтау, қоршаған ортаның басқа объектiлерiн идентификациялау және күрделi органикалық заттарды, дәрiлiк препараттар, белоктар, нуклейн қышқылдарын, пестицидтердi сандық анықтау жатады.
Потенциометриялық тәсілдер.
Потенциометрлік анализ тәсілі, қайтымды гальваникалық элементтердің электр қозғаушы күшін (ЭҚК) өлшеуге негізделген. Гальваникалық элемент, бір ерітіндіге батырылған (тасымалдаусыз тізбек) екі – индикаторлы және салыстырмалы электродтан тұрады. Немесе сұйықтықты контактымен байланысқан (тасымаудаушы тізбек) құрамы бойынша өзгешеленетін екі ерітіндіден тұрады.
Потенциометрияда индикаторлы электродтардың екі класын қолданады:
Фазалық шекарадағы электродтар, электрон алмасу процестері жүреді. Мұндай электродтардың функциясы, зерттелетін ерітіндінің құрамы мен концентрациясына тепе-теңтік потенциалының тәуелділігіне негізделген, ол Нернст теңдеумен сипатталады.
Е=Е0ох/Rеd + 0,059/ nlg а ох/ аRеd
Мұндағы, Е-тепе теңдік потенциалы, Е0 – стандартты потенциал, егер электрохимиялық реакцияға қатысатын барлық компоненттердің активтіліктері бірге тең болса, стандартты потенциал тепе-теңдік потенциалына тең болады; n- жартылай реакцияға қатысатын электрондар саны.
Негізінен, бұлар активті бірінші реттік металдық электродтар (күміс, мыс, кадмий және басқалар) және инертті электродтар (платина, алтын).
Фазааралық шекараларда ион алмасу процестері жүретін электродтар – ионоселективті электродтар (ИСЭ).
Потенциометрияның екі түрі бар: тура потенциометрия (ионометрия) – тепе –теңдік потенциалын және ерiтiндiдегi иондардың активтiлiктерiн тiкелей өлшейдi; жанама потенциометрлиялық титрлеу – химиялық реакция процесiнде, анықталатын зат пен титрант арасындағы потенциалдың өзгеруiн тiркейдi.
Тура потенциометрия (ионометрия).
Тура потенциометрия – тәсiлi, анализденетiн ерiтiндiге сәйкес келетiн индикаторлы электрод салып, оның потенциалын салыстырмалы электродпен, әдетте күмiсхлорлы электродын өлшеуге арналған. Сосын, Е-рС (С-анықталатын ионның стандартты ерiтiндiлерiнiң концентрациясы) координатасында тұрғызылған градуирленген қисық бойынша, анализденетiн ерiтiндiдегi анықталатын ионның концентрациясын табады.
Потенциометрлиялық өлшеулерде, индикаторлы электрод ретiнде металдық электродтарға электрон өткiзгiштiк тән.
Металдық электродтар. Металдық электродтарды активтi және инерттi деп бөледi. Активтi металдық электродтарды Ag, Cu, Cd, Pb металдардан дайындайды, бұл металдар қайтымды тотығу-тотықсыздану жартылай реакциясының тотықсызданған формасын түзедi. Мұндай электродтардың кез келгенi, өз иондары бар ерiтiндiде, осы иондардың активтiлiктерi өзгеруi кезiнде қайтымды өзгеретiн потенциалға ие болады. Мысалы, Ag+ + e- ®Ag қайтымды жартылай реакциясы теңдеуiне сәйкес, Ag+ иондарының активтiлiгiне күмiс электроды потенциалының тәуелдiлiгi, Нернст теңдеуiмен сипатталады:
E=E0 Ag+/Ag + 0,059 lg aAg
Бұдан, күмiс электродының өлшенген потенциалы бойынша, ерiтiндiдегi Ag+ иондарының активтiлiгi туралы айтуға болады. Күмiс электродына ұқсас, ерiтiндiдегi өз иондарының активтiлiгiне қайтымды тәуелдi болатын электродтарды бiрiншi реттiк электродтар деп атайды.
Активтi металдық электродтарды тек өз иондарын ғана емес, осы иондармен аз еритiн немесе комплекстi қосылыстар түзетiн аниондарды анықтау үшiн де қолдануға болады. Потенциалдары иондардың активтiлiктерiне тәуелдi болып, аз еритiн қосылыстар түзетiн электродтарды салыстырмалы электродтар деп атайды.
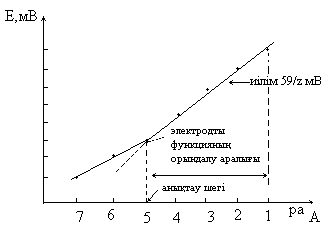
6 - сурет. Электродты функциясының орындалу интервалы және ионселективтi электродтың анықтау шегi.
Электрод селективтiлiгi басқа В ионының қатысында анықталатын А ионына салыстырмалы түрде электродты селективтiлiгi, селективтiлiктiң потенциометрлiк коэффициентiмен kA,B-сипатталады. Егер kA,B <1 болса, онда электрод А ионына салыстырмалы түрде, ал kA,B >1 болса, В ионына салыстырмалы түрде селективтi.
Ионселективтi электродтың селективтiлiк коэффициентiн анықтау үшiн, құрамында басқа В иондары бар және айнымалы құрамды А иондары бар ерітінділерде осы электродтың потенциалын өлшейді. 3-ші суретте электрод потенциалының анықталынатын ион А, активтілігіне тәуелділігі келтірілген. А активтілігінің төмендеуімен, түзу сызықты тәуелділіктен ауытқуы байқалады және қандай да бір уақытта электрод потенциалы ион А активтілігіне тәуелді болмайды. Бұл, электрод А иондарына салыстырмалы түрде электродты функцияны орындауы тоқтайды және оларды В иондарынан бөлмейді. Ерітіндідегі А иондарының активтілігі тұрақты болғандықтан, электрод потенциалы осы мезгілден бастап өзгермейді.
Түзу сызықты бөліктердің қиылысу нүктесінде ЕА=EB және ZА=ZB кезінде
aA/aB=kAB
kAB мәні аз болған сайын электрод селективтілігі А ионына салыстырмалы түрде жоғары болады. 3-суреттен көрініп тұрғандай, қарастырылып отырған электрод үшін
kAB=10-3.5/10-1=10-2.5
Ионоселективті электродтың уақыты электродтың тұрақты потенциалға жету уақытын сипаттайды. Белгі беру уақыты аз болған сайын, электрод жақсара түсіде. Белгі беру уақыты, секундтай бірнеше минуттарға дейін өзгеруі мүмкін. Бұл мембрана табиғатына, сондай-ақ потенциалды өлшеу әдістемесіне, яғни электродтың сұйытылған ерітіндіде анағұрлым концентрлі ерітіндіге немесе керісінше ауыстыруына тәуелді. Көптеген электрод үшін, электрод потенциалы 1 минут барысында соңғы шаманың 90 -та аса мәніне жетеді.
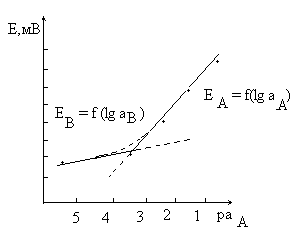
7 - сурет. Селективтілік коэффициентін анықтау.
Гальваникалық элементтің ИСЭ-пен ЭКҚ-ін өлшеу үшін, көбнесе жоғары кіру кедергісі бар (иономерлер, рН-метрлер) әртүрлі марқалы электронды вольтамперлер қолданылады.
ИСЭ-пен жұмыс жүргiзгенде, оны алдын-ала калибрлеу қажет - электрод потенциалымен анықталатын ионның концентрациясы немесе активтiлiгi арасында тәуелдiлiк орнату қажет. Е-раi(Е-рсi) координаталарында градуирленген график тұрғызу үшiн, анықталатын қосылыстардың стандартты ерiтiндiлерiн қолданады. Көбiнесе, бастапқы ерiтiндiнi дистилденген сумен кезектi сұйылту жолын қолданады. Бұл кезде, зерттелiп отырған ионның активтiлiк коэффициентi белгiлi немесе оңай есептелуi мүмкiн деп есептеледi.
Тұрақты иондық күш тәсiлi танымал және универсалды: индифференттi электролитi бар потенциал анықтайтын компонент-ерiтiндiлерi қолданылады, ол зерттелетiн және стандартты ерiтiндiлерде тұрақты иондық күш жасайды. ИСЭ калибрлi -қисығының мәлiметтерi бойынша келесi электрохимиялық сипаттамаларды анықтайды.
Электродты функцияның Нернстi аумағы - потенциалдың потенциал анықтаушы иондардың активтiлiгiне (концентрациясына) түзу сызықты тәуелдiлiгiнiң интервалы.
Электродты функцияның бiрден бұзылуы (крутизна) - градуирленген графиктiң (Е- раi, Е-рсi) иiлуiнiң бұрыштық коэффициентi.
Потенциал анықтаушы ионды (Сminp) анықтау шегi, ол үшiн екi бағытты қолдануға болады:
а) Е-рсi тәуелдiлiгiнiң түзу сызықты бөлiгiн экстрополирлейдi, алынған нүктесi абсцисса өсiндегi Сmin, р шамасына сәйкес келедi.
б) электродты функцияның экстрополирленген түзу сызықты бөлiгiнде, эксперименттiк қисықтағы 18/z мВ-да нүктенi табады /Сmin, Р, ионометрияда ауытқуы Нернст тәуелдiлiгiнен 59/zlg2, яғни 18z мВ-ты құрайтын концентрацияға сәйкес келедi, электродты функцияның теориялық шамадан бiрден бұрылуының (крутизна ) ауытқуы жағдайында, Сmin, Р анықтау үшін градуирленген графиктен экспериментальды табылған мәндерді қолданады.
ИСЭ белгі беру уақыты - стационарлы потенциалға жету уақыты.
Электродтардың басқа иондардың қатысында анықталатын ионға жоғары селективтілік көрсететіндей құрамда таңдап, арнайы шынылардан дайындайды.
Алғашқы шыны мембранасы бар электрод – рН өлшеу үшін қолданылған басқа барлық электродтарды ығыстырған Н+ иондарына салыстырмалы түрде селективті электрод болған.
р
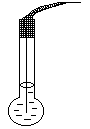
8 - сурет. рН өлшеуге арналған шыны электрод. Оның негізгі бөлігі - шыны түтікке дәнекерленген шарик формасындағы жұқа шыны мембрана.
Мембраналарды дайындау үшін, көбіне құрамында 22 Na2O, 6% CaO, 72% SiO2 бар шыны қолданылады. Шариктiң iшiне күмiс хлоридiмен қанықтырылған 0,1 М тұз қышқылы ерiтiндiсiн құяды және күмiс сым салады, ол iшкi салыстырмалы электрод қызметiн атқарады. Шыны құрылымын, кремний атомы арқылы бiр-бiрiмен байланысқан оттегi атомдарының торы құрайды. Кремнийдiң әрбiр атомы, оттегiнiң төрт атомымен байланысқан, ал оттегiнiң әрбiр атомы екi SiO4 тобына қатысады, сондықтан үш өлшемдi тор түзiледi. Ондағы бос жерлер оттегiмен электростатикалық әрекеттесуi есебiнен ұсталып тұрған катиондармен толтырылған. Катион заряды жоғары болған сайын ол берiк ұсталады. Сондықтан шынының гидратациялану кезiнде протондармен алмасу реакциясында тек бiр зарядты катиондардың практика жүзiнде қатысуға қабiлеттi.
Егер шыны электродты бiршама уақыт суда ұстаса, онда мембрананың екi беттiк қабатында гидратталған гельдiң жұәа қабаты /10-4 мм/ түзiледi. Бұл кезде, натрий иондарын ығыстырып, барлық жерлерде Н+ иондары орналасады. Жақсы жуылған шыны электродтың потенциалы келесi теңдеумен сипатталады:
Е=0,059/lg aH+
Бұл, электродтың сутектi функцияға ие екендiгiн көрсетедi және оны рН өлшеу үшiн қолдануға болады. Бiрақ, күштi қышқылдық және күштi сiлтiлi орталарда электродтар қате нәтижелер беретiндiгiн естен шығармау керек, яғни өлшеудiң (рН) үлкен қателiгi байқалады. Осы күнге дейiн күштi қышқылдық орталарда рН өлшеудiң нәтижелерiнiң жоғары болуын түсiндiретiн бiркелкi түсiндiрмелер жоқ. Күштi сiлтiлi орталардағы төмен нәтижелер, гидратталған гельдiң беттiк қабатында алмасу реакциясының салдарынан сiлтiлiк металдар иондарының әсерiмен түсiндiредi:
Н+ + Gel- + M+ M+ Gel- + H+
шыны ерiтiндi шыны ерiтiндi
Бұл реакцияның тепе- теңдік константасы Кн-м, шыны сортына тәуелді, сондықтан әртүрлі шыны мембраналары, әртүрлі селективтілік kH,M= Кн-м UM/UH сипатталады.
Сiлтiлi ерiтiндiлердiң рН-ын өлшеудегi қателiк, сондай-ақ шыны сортына тәуелдi болады.
Шыны электродтың негiзгi артықшылығы: жұмыстың қарапайымдылығы, рН кең аумағында қолданылуы, тепе-теңдiктi тез орнату және тотығу-тотықсыздану жүйелерiнде рН анықтау мүмкiндiгi болып табылады. Ал кемшiлiгiне, олардың конструкциясының омырылғыштығы және күштi сiлтi және күштi қышқыл ерiтiндiлерге өту кезiндегi жұмыстың күрделiлiгi жатады.
№ 3 Лабораториялық жұмыс
Тақырыбы: Потенциометрлік титрлеу әдісімен тұз қышқылының мөлшерін анықтау.
Өлшеу жұмыстарына қажетті құрал-жабдықтар мен реактивтер:
рН-метр, индикаторлы шыны электроды, хлоркүміс салыстырмалы электроды, сыйымдылығы 50-100 мл стакандар.
Натрий гидроксидiнің 0,1 М стандартты ерiтiндiсi, ацетон.
Буферлі ерітінділер: рН=3,56/КС4Н5О6 қаныққан ерітіндісі және рН=9,18/0,05М N2В4О7 ∙ 10Н2О ерітіндісі.
Жұмыстың мақсаты: Потенциометриялық анализ әдісінің теориялық негізін оқытып, потенциометрлік титрлеу әдісімен шыны электрод көмегiмен ерiтiндi рН-ын анықтау, тотығу-тотықсыздану реакциясын қолдану арқылы индикатор электродының көмегімен анықталатын заттар мөлшерін анықтау.
Зерттеу тақырыбының қажеттілігі: Қазіргі замандық инструменталды анализ әдістерінің ішінде кең қолданыс тапқан потенциометрия тәсілін студенттерге іс жүзінде көрсетіп, қондырғыда жұмыс істеу тәсілін меңгеруге, әртүрлі ерітінділер құрамындағы анықталатын заттар мөлшерін ионселективті электродтар көмегімен анықтауды үйрету болып табылады.
Пререквезиттер: жалпы химия, физикалық химия.
Постреквизиттер: электрохимия негіздері, аналитикалық химия, химиялық сараптама және т.б. пәндерді игеру қажет.
Студенттің алдын-ала меңгеріп келуге тиісті дағдылары:
Потенциометриялық анализ әдістері тақырыбы бойынша орындалатын жұмыстың методикасы.
Электрохимияның негізгі заңдары.
Электродтар классификациясы, электродтар түрлері.
Индикатор электроды, ионселективті электродтар, олардың конструкциясы.
Потенциометриялық анализ әдісі.
Нернст теңдеуі. Электр қозғаушы күш. Электрод потенциалы.
Студенттің алдын-ала біліп келуге тиісті мәліметтері:
Электр қос қабаты.
Электрод потенциалының пайда болуы.
Электрохимияның негізгі заңдары.
Электродтар классификациясы, электродтар түрлері.
Ионометрия. Ионселективті электродтар.
