
Розділ 5 хіміко-термічна обробка сталі
Теорія хіміко-термічної обробки
Хіміко-термічна обробка в порівнянні з поверхневим загартуванням, наприклад високочастотної, має деякі особливості і перевагами (уступаючи поверхневому загартуванню в продуктивності):
1. Незалежність від зовнішньої форми виробу. З однаковим успіхом можна обробляти і складні, і прості за формою виробу, одержуючи по всій поверхні зміцнений кулю однакової товщини. При поверхневому ж загартуванні зовнішня форма виробу має велике значення, у багатьох деталей машин зовнішня форма така, що виключає можливість застосування поверхневого загартування.
2. Більше розходження між властивостями серцевини і поверхні, чим при поверхневому загартуванні. При хіміко-термічній обробці різниця у властивостях визначається розходженням у будівлі й у складі, а при поверхневому загартуванні — тільки розходженням у будівлі.
3. Наслідку перегріву поверхні можуть бути усунуті наступною термічною обробкою, тоді як при поверхневому загартуванні перегрівши не може бути усунутий, тому що вона є останньою операцією.
Звичайно при хіміко-термічній обробці деталь поміщають у середовище, багату елементом, що дифундує в метав.
У випадку газового оточення (найбільш приватний випадок) при хіміко-термічній обробці відбуваються три елементарних процеси.
Перший процес — дисоціація. Протікає в газовому середовищі і складається в розпаді молекул і утворенні активних атомів елемента, що дифундує. Наприклад
2С→СО2 + С чи NH3-→3 H + N.
При цьому утворяться активні атоми вуглецю й азоту, здатні розчинятися в металі. Ступінь розпаду молекул газу (%) називається ступенем дисоціації.
Другий процес — абсорбція. Відбувається на границі газ–метал і складається в поглинанні (розчиненні) поверхнею вільних атомів. Цей процес можливий тільки в тому випадку, якщо елемент, що дифундує, У здатний розчинятися в основному металі А.
Проникнення елемента, що насичує, усередину - дифузія. Вона характеризує третій процес.
В результаті утвориться дифузійний куля, на поверхні якого концентрація елемента, що дифундує, найбільша; у міру видалення поверхні концентрація падае (мала.5.1), глибина проникнення (мал.5.1 ) буде представляти собою товщину шаруючи. Так це є, якщо елемент, що дифундує, утворить з металом систему безупинних твердих розчинів. Якщо, однаково, насичений елемент В образу з металом А систему сплавів з ограненою розчинністю і з хімічними зеднаними (мал.5.2 , а), те стан шаруючи буде визначатися ізотермічним розрізом діаграми стану ціеї системи при температурі дифузійного насичення.
Припустимо, що системі (метал А и елемент, що дифундує, У) відповідає діаграма стану, зображена на малий..5.2, і що насичення проходити при температурі tx.
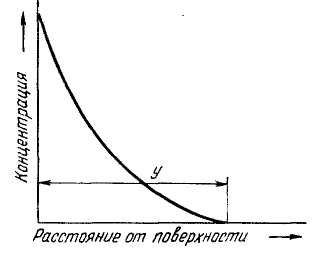
мал..5.1 Зміна концентрації дифундируючого елемента по глубині
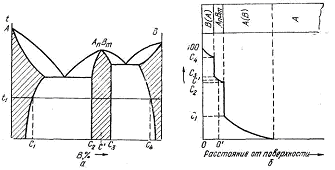
мал..5.2 Система сплавів з граничністю і хімічними з’єднаннями:
а-діаграма стану; б-розподілення концентрації дифундируючого елемента і строєній дифузійного слою.
Якщо процеси дисоціації, абсорбції і дифузії протікають досить активно і часи досить, то на поверхні може утворитися шар твердого розчину В (А) перемінної концентрації (мал. 5.2,6), під ним буде знаходитися підшар твердого розчину хімічної сполуки АпВт теж перемінної концентрації і, нарешті, шар твердий розчин* А (У), що убуває від межі насичення (при даної температурі) до нуля. На границях роздягнула шарів концентрація з міняється стрибкоподібно, відповідно до умов рівноважного співіснування фаз, як это випливає з діаграми стану, приведеної на мал. 5.2, а.
Якщо процес насичення протікає менш активно, то концентрація на поверхні не досягне 100% В.
Розрізняються два види дифузійного переміщення атомів у металах: а) самодифузія, коли відбувається переміщенням атомів основного металу у власних кристалічних ґратах; б) гетеродиффузія, коли відбувається переміщення сторонніх (розчинених) атомів у чужих кристалічних ґратах.
У першому випадку в результаті хаотичного теплового руху окремі атоми основного металу час від часу змінюють місця у своїх кристалічних ґратах, роблячи перескок з одного положення в інше. Цей процес переміщення однорідних атомів відбувається безупинно і хаотично по напрямку і не змінює концентрації.
В другому випадку переміщення сторонніх атомів відбувається в напрямку від місць високої концентрації до місць низької концентрації. Цей процес відбувається мимовільно, тому що стан з нерівномірною концентрацією володіє більшою вільною енергією, чим стан з рівномірним розподілом розчинених атомів1.
Як здійснюється дифузійне переміщення атомів?
Як указувалося раніше (гл. I), у будь-якій речовині відбувається флуктуація теплових коливань, у результаті якої окремі атоми здобувають значно велику енергію, чим середній рівень енергії атомів, характеризуемий температурою даного тіла. Ці атоми можуть залишати рівноважні положення у вузлах ґрат і переміщатися в междоузлиях, залишаючи місця у вузлах ґрат незайнятими.
Атом, розташований у междоузлии ґрати, називається дислокованим атомом (мал. ), а вузол у кристалічних ґратах, не зайнятий атомом, називається, як уже говорилося в гл. I, вакансією. Для атомів навколо чи вакансії дислокованого атома порушується рівномірність оточення атомами-сусідами в порівнянні з бездефектними ділянками ґрат (див. мал. 5.3). У результаті цього навколо чи вакансії навколо Дислокованого атома виникає поле пружних перекручувань ^кристалічних ґрат.
Гіпотетичний механізм гетеродиффузии, що аналогічний механізму самодифузії, описаний Я. И. Френзелем і в даний час є загальноприйнятим. Якщо по сусідству З атомом А (мал. 5.3) мається вакансія (дірка), то він може легко переміститися зі свого місця в дірку; на місце атома А встане атом У, на місце атома В — атом С и т.д. Одночасно з переміщенням атомів відбувається як би переміщення «дірки». Процес гетеродиффузии зручніше описувати як переміщення сторонніх атомів, а процес самодифузії — як переміщення «дірок».
Для того щоб атом А перейшов зі свого вихідного положення в сусідню «дірку», він повинний попередньо зайняти проміжне положення в міждовузлів. Робота, що потрібно для того, щоб вирвати атом з регулярного положення, називається енергій активації (чи теплотою розпушення) і є найважливішою характеристикою здатності атомів до переміщення. Величина ця не залежить від температури, а визначається природою речовини'.
Вплив температури, що значно прискорює дифузійні процеси, обумовлене тим, що з підвищенням температури збільшуються теплові коливання і завдяки цьому збільшується число «дірок» у ґратах.
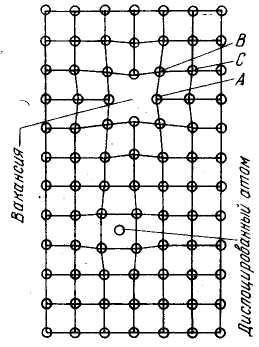
мал..5.3
Кількісно процес дифузії характеризується так називаним коефіцієнтом дифузії D, що чисельно дорівнює кількості речовини, продиффундировавшого через площадку в 1 див2 протягом секунди при перепаді концентрацій по обох сторони площадки, рівному одиниці (0 і 100% верства В), і має розмірність квадратний сантиметр, ділений на секунду (див2/с).
Залежність D від температури виражається рівнянням
![]()
(!)
де А-коефіціент, що залежить від кристалічних ґрат;
Q — енергія активації;
е — підстава натуральних логарифмів;
R — газова постійна;
Т— абсолютна температура.
Тому що R і Q не залежать від температури, то для даної речовини коефіцієнт дифузії дуже сильно зростає з підвищенням температури (мал. 5.4, а), а в координатах lg D і
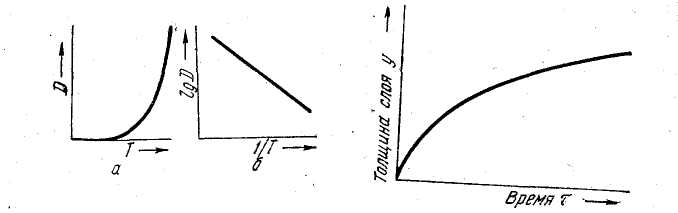
мал..5.4 Залежність коефіцієнта мал.5.5Глубина дифузійного слою
дифузії від температури:D-коефіцієнт в залежності від продовжую чого процеса
дифузії;T-абсолютна температура
1/Т ця залежність зобразиться прямою лінією (мал..5.4)
З рівняння (1) випливає, що коефіцієнт дифузії різних речовин надзвичайно сильно залежить від рівня енергії активації; чим більше Q, тим різко менше D
У твердих розчинах упровадження процес дифузії полегшується тим, що не потрібно висновку атома (іона) розчинника в іррегулярне положення, і тому енергія активації менше, ніж при утворенні твердих розчинів заміщення. Наприклад, при дифузії вуглецю в γ-залозі Q≈30 ккал/г-атом
У випадку дифузії металів у γ-залозі (розчини заміщення) Q«60 ккал/г-атом. Коефіцієнти дифузії в цих двох випадках розрізняються в тисячі і десятки тисяч разів. Так, для сталі з 0,2% Із при 1100 С коефіцієнт D=6-10-7. для дифузії вуглецю і D=6.10 -11 для дифузії молібдену.
Тривалість процесу хіміко-термічної обробки визначається необхідною глибиною дифузійного шару
При постійних параметрах процесу (температура й ін.) збільшення глибини шаруючи (у) у часі (τ) підкоряється параболічному закону (мал. 5.5).
Чим більше товщина вже наявного шару, тим менше він збільшується за однаковий відрізок часу.
Деякі особливості дифузії в металах порозуміваються їхньою кристалічною будівлею.
Анізотропія властивостей кристалів виявляється й у відношенні здатності до дифузії. Так, дифузія міді в гексагональному цинку протікає в різних напрямках з різною швидкістю: у площині базису швидше, у напрямку головної осі повільніше. У ґратах з великою симетрією (кубічні ґрати) дифузія залежать від орієнтації незначно.
Границі зерен є ділянками, у яких дифузійні процеси полегшені через наявність у цих місцях дефектів кристалічної будівлі. Якщо розчинність речовини, що дифундує, у металі мала, то часто спостерігається переважна дифузія по границях зерен. У випадку значної розчинності елемента, що дифундує, в основному металі роль прикордонних шарів підвищеної розчинності зменшується. У момент фазових перетворень дифузія протікає швидше.
