- •Биохимия (часть 1)
- •060101.65 – Лечебное дело
- •060103.65 – Педиатрия
- •060105.65 – Стоматология
- •СОдержАние
- •Предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •5) Положительно заряженные
- •1.4. Структурная организация белков
- •Методы определения n-концевой аминокислоты
- •Методы определения с-концевой аминокислоты
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Производные гемоглобина
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2.1. Влияние на ферменты активаторов и ингибиторов.
- •2.2. Химическая модификация фермента.
- •2.3. Аллостерическая регуляция.
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •D2 (эргокальциферол) d3 (холекальциферол)
- •3.2. Водорастворимые витамины
- •Методы определения витаминов
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •4.2. Транспорт веществ через мембрану
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Микросомальное окисление
- •6.6. Антиоксидантная система
- •6.7. Реакции общего пути катаболизма
- •6.7.1. Окислительное декарбоксилирование пвк
- •6.7.2. Цикл трикарбоновых кислот
- •Анаболические функции цикла Кребса
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •Литература
- •11. Харитонов, я.Ю. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. / я.Ю. Харитонов. – м.: геотар-Медиа, 2014. – 656 с.
2. Протамины и гистоны.
Протамины – низкомолекулярные белки в ядрах сперматозоидов у рыб и птиц. Они содержат 60-85% аргинина и обладают основными свойствами. Хорошо растворяются в воде, кислой и нейтральной среде. Осаждаются щелочами. В ядрах клеток ассоциированы с ДНК.
Гистоны также являются небольшими белками основного характера. В их состав входят лизин и аргинин, содержание которых не превышает 20-30%. Существует пять различных типов гистонов: H1, H2A, H2B, H3 и H4. Эти белки находятся в основном в ядрах клеток, принимают участие в структурной организации хроматина и необходимы для регуляции экспрессии генов.
3. Проламины и глютелины.
Проламины - белки растительного происхождения. Содержат 20-25% глутаминовой кислоты и 10-15% пролина. Растворимы в 60-80% водном растворе этанола (все остальные простые белки в этих условиях обычно осаждаются).
Глютелины - простые белки, содержатся в семенах злаков, в зеленых частях растений. Для них характерно высокое содержание глутаминовой кислоты и наличие лизина. Растворимы в разбавленных растворах щелочей. Глютелины - запасные белки.
1.6.2. Сложные белки
1. Хромопротеины (от греч. chroma - краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины и флавопротеины. Они участвуют в таких процессах, как дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
К группе гемопротеинов относятся гемоглобин, миоглобин, цитохромы, каталаза, пероксидаз. Все они содержат железопорфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции. Видовые различия гемоглобина обусловлены глобином.
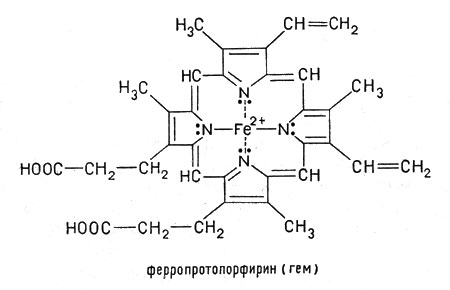
Рассмотрим строение гемоглобина – белка крови. Небелковым компонентом гемоглобина является гем - пигмент, придающий крови красный цвет. Основу его структуры составляет протопорфирин IX (рис. 6). В центре гема расположен ион железа в степени окисления +2, связанный с двумя атомами азота ковалентно и с двумя другими - координационными связями. Гем «обернут» одной полипептидной цепью. В гемоглобине железо соединяется с атомом азота имидазольной группы гистидина белковой молекулы пятой координационной связью. Шестая координационная связь железа предназначена для присоединения кислорода или других лигандов (рис. 7).
|
|
Рис. 6. Гем |
Рис. 7. Координационные связи Fe2+ в геме |
Гемоглобин взрослого человека НbА (от англ. аdult - взрослый) имеет четыре полипептидные цепи, составляющие глобин (рис. 8) - белковую часть молекулы. Две α-цепи содержат по 141 аминокислотному остатку, две β-цепи - по 146.
Рис. 8. Гемоглобин |
В крови взрослого человека присутствуют также гемоглобин НbА2 (2α-, 2δ-цепи, 2,5%) и НbA3 (менее 1%, отличается строением -цепи).
Известен фетальный гемоглобин (гемоглобин новорожденных) HbF, состоящий из 2α- и 2γ-цепей. Гемоглобин F обладает повышенным сродством к кислороду и позволяет сравнительно малому объему крови плода выполнять функцию снабжения кислородом более эффективно. Кровь новорожденного содержит до 80% HbF, к концу 1-го года жизни он почти целиком заменяется на НbА.
Гемоглобинозы – болезни гемоглобинов.
1. Гемоглобинопатии. В их основе лежит наследственное изменение структуры какой-либо цепи нормального гемоглобина. В крови человека открыто около 150 различных типов мутантных гемоглобинов. Аномальные гемоглобины различаются по физико-химическим свойствам (электрофоретическая подвижность, растворимость, изоэлектрическая точка, сродство к кислороду).
Пример гемоглобинопатии - серповидно-клеточная анемия. Заболевание распространено в странах Южной Америки, Африки и Юго-Восточной Азии. Химический дефект сводится к замене глутаминовой кислоты в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК. У HbS снижены растворимость и сродство к кислороду. Эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. HbS после отдачи кислорода в тканях превращается в плохо растворимую дезоксиформу и выпадает в осадок в виде веретенообразных кристаллов (тактоидов). Тактоиды деформируют клетку и приводят к гемолизу. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии. Болезнь протекает остро, и дети часто умирают в раннем возрасте.
Примерами аномальных гемоглобинов являются также гемоглобин С (в -цепи на 6 месте вместо глутаминовой кислоты находится лизин) и гемоглобин D (в -цепи на 28 месте вместо глутаминовой кислоты находится лейцин). Данные мутации обнаружены в основном в Африке.
2. Талассемии - группа заболеваний с наследственным нарушением синтеза одной из цепей глобина. Различают α-талассемии, когда не происходит синтез α-цепи, и β-талассемии (не синтезируются β-цепи). Гемоглобинопатия Н (один из вариантов -талассемии) проявляется гемолитической анемией, выпадением в осадок гемоглобина Н, увеличением селезенки, тяжелыми костными изменениями.
3. Железодефицитные анемии - нарушение синтеза гемоглобина вследствие дефицита железа. Основными причинами являются кровопотери и недостаток богатой гемом пищи - мяса и рыбы.