
- •Биохимия (часть 1)
- •060101.65 – Лечебное дело
- •060103.65 – Педиатрия
- •060105.65 – Стоматология
- •СОдержАние
- •Предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •5) Положительно заряженные
- •1.4. Структурная организация белков
- •Методы определения n-концевой аминокислоты
- •Методы определения с-концевой аминокислоты
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Производные гемоглобина
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2.1. Влияние на ферменты активаторов и ингибиторов.
- •2.2. Химическая модификация фермента.
- •2.3. Аллостерическая регуляция.
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •D2 (эргокальциферол) d3 (холекальциферол)
- •3.2. Водорастворимые витамины
- •Методы определения витаминов
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •4.2. Транспорт веществ через мембрану
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Микросомальное окисление
- •6.6. Антиоксидантная система
- •6.7. Реакции общего пути катаболизма
- •6.7.1. Окислительное декарбоксилирование пвк
- •6.7.2. Цикл трикарбоновых кислот
- •Анаболические функции цикла Кребса
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •Литература
- •11. Харитонов, я.Ю. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. / я.Ю. Харитонов. – м.: геотар-Медиа, 2014. – 656 с.
7.9. Глюконеогенез
Глюконеогенез – синтез глюкозы из веществ неуглеводной природы, протекающий в основном в печени, и, менее интенсивно, – в корковом веществе почек и слизистой оболочке кишечника. Большинство реакций глюконеогенеза являются обратными гликолизу и катализируются теми же ферментами (рис. 41).

Рис. 41. Схема гликолиза и глюконеогенеза
Функция глюконеогенеза – поддержание уровня глюкозы в крови при длительном голодании и интенсивных физических нагрузках. Постоянное поступление глюкозы в качестве источника энергии особенно необходимо для нервной ткани и эритроцитов.
Субстраты глюконеогенеза – ПВК, молочная кислота, глицерин, аминокислоты, метаболиты цикла Кребса. Их включение в глюконеогенез зависит от физиологического состояния организма.
На примере синтеза глюкозы из пирувата рассмотрим подробно реакции, не являющиеся обратными реакциям гликолиза (гексокиназная (1), фосфофруктокиназная (3), пируваткиназная (10)).
1-ый этап – образование фосфоенолпирувата из ПВК.
а) карбоксилирование ПВК под влиянием пируваткарбоксилазы с образованием оксалоацетата в митохондрии:

Пируваткарбоксилаза – митохондриальный фермент, аллостерическим активатором которого является ацетил-KоА.
Для оксалоацетата митохондриальная мембрана непроницаема, поэтому оксалоацетат в митохондриях превращается в малат при участии митохондриальной НАД-зависимой малатдегидрогеназы:

Малат выходит из митохондрии через митохондриальную мембрану в цитозоль, где под действием цитоплазматической НАД-зависимой малатдегидрогеназы окисляется в оксалоацетат:

б) в цитозоле клетки протекает декарбоксилирование и фосфорилирование оксалоацетата с образованием фосфоенолпирувата; фермент – фосфоенолпируваткарбоксикиназа:

2-ой этап – превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат.
Фосфоенолпируват в результате обратимых реакций гликолиза превращается во фруктозо-1,6-фосфат. Далее следует необратимая фосфофруктокиназная реакция гликолиза. Глюконеогенез идет в обход этой реакции:

3-ий этап – образование глюкозы из фруктозо-6-фосфата.
Фруктозо-6-фосфат превращается в глюкозо-6-фосфат, который дефосфолирируется (реакция протекает в обход гексокиназной) под влиянием глюкозо-6-фосфатазы:
![]()
7.10. Регуляция обмена углеводов
Печень отличается наиболее сложным обменом глюкозы по сравнению с другими органами. В ней происходят противоположные процессы: синтез/распад гликогена и гликолиз/глюконеогенез.
Направление метаболизма глюкозы в печени связано с ритмом питания.
Переключение процессов синтеза и мобилизации гликогена в печени происходит при переходе состояния пищеварения в постабсорбтивный период или состояния покоя на режим мышечной работы.
Абсорбтивным периодом называют период пищеварения.
Постабсорбтивным называют период после завершения пищеварения до следующего приема пищи.
В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин. Их влияние осуществляется путем изменения в противоположном направлении активности двух ключевых ферментов - гликогенсинтазы и гликогенфосфорилазы - с помощью фосфорилирования и дефосфорилирования.
Инсулин и глюкагон постоянно присутствуют в крови, но при переходе из абсорбтивного состояния в постабсорбтивное изменяется их относительная концентрация (рис. 42) – инсулин-глюкагоновый индекс.
В период пищеварения инсулин-глюкагоновый индекс повышается. Под влиянием инсулина стимулируется транспорт глюкозы в клетки мышечной ткани, изменяются активность и количество ферментов путем фосфорилирования и дефосфорилирования, индукция их синтеза. Введение инсулина вызывает понижение содержания глюкозы в крови, повышение запасов гликогена в мышцах.
В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается, и решающим фактором является влияние глюкагона, который стимулирует распад гликогена в печени. Механизм действия глюкагона включает каскад реакций, приводящий к активации гликогенфосфорилазы. Итогом является увеличение концентрации глюкозы в крови.
|
Рис. 42. Изменение концентраций глюкозы, инсулина, глюкагона после приема пищи
|
Биосинтез и секреция инсулина и глюкагона контролируются главным образом концентрацией глюкозы по принципу обратной связи. Повышение содержания глюкозы в крови вызывает увеличение секреции инсулина и замедление секреции глюкагона, а снижение, наоборот, замедление секреции инсулина и повышение – глюкагона. Этот контроль по типу обратной связи - один из важнейших механизмов регуляции содержания глюкозы в крови.
Адреналин повышает уровень обмена углеводов в организме, усиливая распад гликогена в мышцах и ингибируя синтез гликогена из УДФ-глюкозы. Он вызывает резкое повышение уровня глюкозы в крови.
Переключение печени с гликолиза на глюконеогенез и наоборот также происходит с участием инсулина и глюкагона и осуществляется с помощью:
- аллостерических механизмов;
- фосфорилирования/дефосфорилирования;
- индукции/репрессии синтеза ключевых ферментов.
Регуляция направлена на необратимые стадии гликолиза и глюконеогенеза.
При уменьшении инсулин-глюкагонового индекса синтез ключевых ферментов гликолиза снижается, а ферментов глюконеогенеза (фосфоенолпируваткарбоксикиназа, фруктозо-6-фосфатаза, глюкозо-6-фосфатаза) - увеличивается, и стимулируется глюконеогенез.
Направление реакций гликолиза регулируется содержанием глюкозы. При пищеварении концентрация глюкозы в крови возрастает до 10-20 мкмоль/л и активность глюкокиназы будет максимальной. Ускоряется гликолитическая реакция
глюкоза → глюкозо-6-фосфат.
Инсулин индуцирует синтез глюкокиназы и поэтому ускоряет фосфорилирование глюкозы.
Важная роль в регуляции гликолиза и глюконеогенеза принадлежит фруктозо-2,6-бисфосфату. Фруктозо-2,6-бисфосфат образуется фосфорилированием фруктозо-6-фосфата при участии бифункционального фермента (БИФ). Этот фермент обладает двумя видами ферментативной активности:
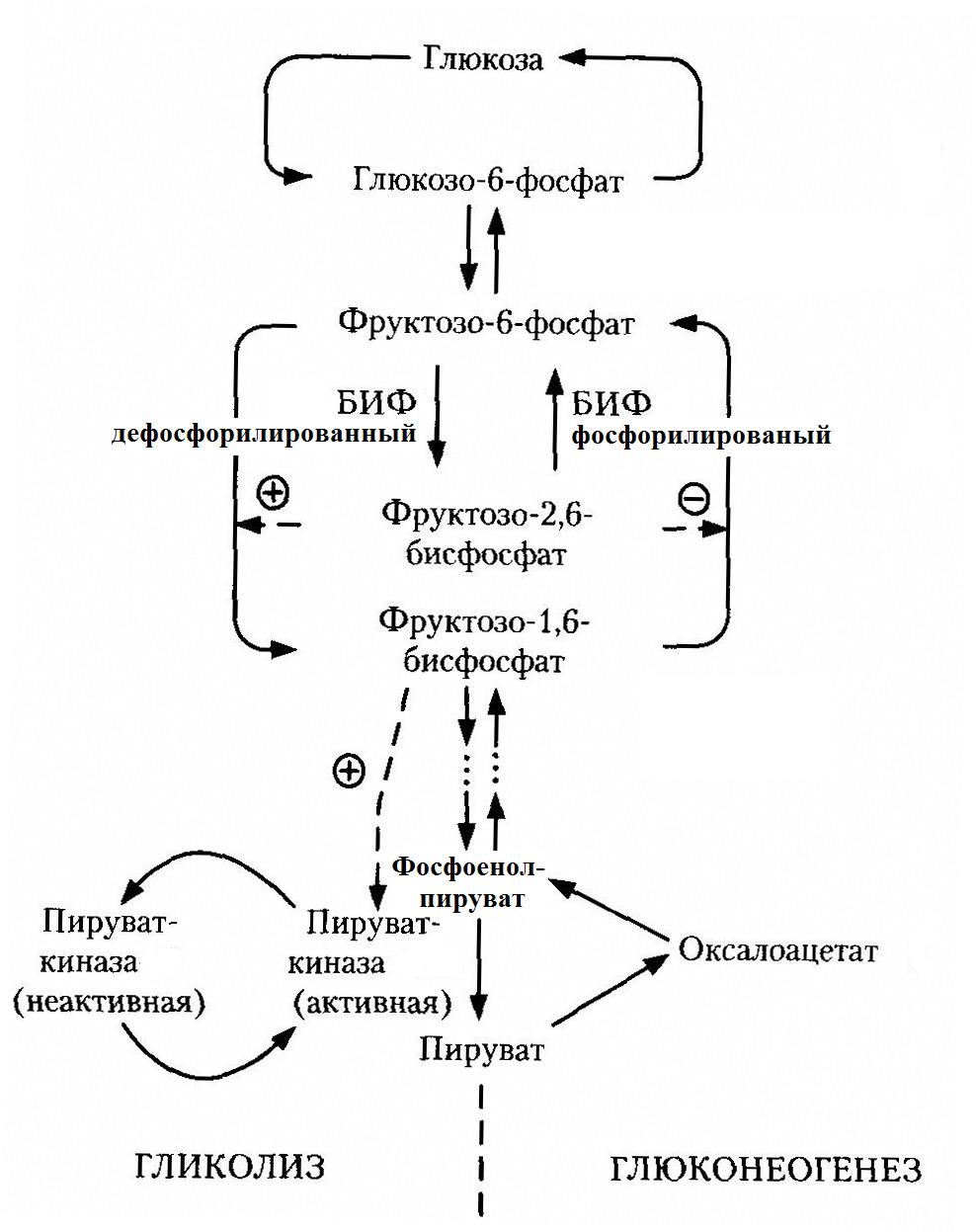
Киназная активность проявляется при дефосфорилированной форме БИФ, которая характерна для абсорбтивного периода (инсулин-глюкагоновый индекс высокий). Увеличивается количество фруктозо-2,6-бисфосфата, который аллостерически активирует фосфофруктокиназу – гликолиз усиливается. Фруктозо-2,6-бисфосфат также ингибирует фосфатазу фруктозо-1,6-бифосфата (замедляется глюконеогенез).
Фосфатазная активность проявляется при фосфорилированной форме БИФ (длительное голодание, инсулин/глюкагоновый индекс низкий): снижается количество фруктозо-2,6-бисфосфата, гликолиз замедляется и переключается на глюконеогенез.
В период пищеварения инсулин активирует протеинфосфатазу, которая дефосфорилирует пируваткиназу и переводит ее в активное состояние: реакция
фосфоенолпируват → пируват (гликолитическая)
ускоряется при пищеварении и замедляется в постабсорбтивном периоде.
Реакции глюконеогенеза
пируват → оксалоацетат → фосфоенолпируват
могут протекать при любом состоянии организма.
В период пищеварения из-за ускорения начальных стадий гликолиза повышается содержание фруктозо-1,6-бисфосфата, что ведет к активации пируваткиназы (гликолиз усиливается).
После приема пищи, богатой углеводами, инсулин-глюкагоновый индекс возрастает, увеличивается количество глюкокиназы, фосфофруктокиназы, пируваткиназы (гликолитические ферменты), и стимулируется гликолитический путь.
Глюкоза в клетках печени используется также для энергообеспечения гепатоцитов. Основными потребителями АТФ в гепатоцитах являются трансмембранный перенос веществ, синтез белков, гликогена, жиров, глюконеогенез.
АТФ и АМФ – аллостерические эффекторы некоторых гликолитических ферментов: АМФ активирует гексокиназу, фосфофруктокиназу и пируваткиназу и ингибирует фосфатазу фруктозо-1,6-бисфосфата. АТФ ингибирует фосфофруктокиназу и пируваткиназу. Т.о., при расходовании АТФ (растет концентрация АМФ) активируются гликолиз и синтез АТФ, глюконеогенез замедляется.

