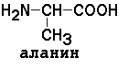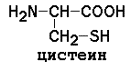- •Биохимия (часть 1)
- •060101.65 – Лечебное дело
- •060103.65 – Педиатрия
- •060105.65 – Стоматология
- •СОдержАние
- •Предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •5) Положительно заряженные
- •1.4. Структурная организация белков
- •Методы определения n-концевой аминокислоты
- •Методы определения с-концевой аминокислоты
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Производные гемоглобина
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2.1. Влияние на ферменты активаторов и ингибиторов.
- •2.2. Химическая модификация фермента.
- •2.3. Аллостерическая регуляция.
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •D2 (эргокальциферол) d3 (холекальциферол)
- •3.2. Водорастворимые витамины
- •Методы определения витаминов
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •4.2. Транспорт веществ через мембрану
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Микросомальное окисление
- •6.6. Антиоксидантная система
- •6.7. Реакции общего пути катаболизма
- •6.7.1. Окислительное декарбоксилирование пвк
- •6.7.2. Цикл трикарбоновых кислот
- •Анаболические функции цикла Кребса
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •Литература
- •11. Харитонов, я.Ю. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. / я.Ю. Харитонов. – м.: геотар-Медиа, 2014. – 656 с.
1.2. Функции белков
Структурная функция. В комплексе с липидами белки участвуют в образовании биомембран клеток. Структурные белки цитоскелета придают форму клеткам и многим органоидам. Примерами структурных белков являются коллаген в соединительной ткани, кератин в волосах, ногтях, коже.
Сократительная (двигательная) функция. Сократительная функция присуща мышечным белкам (актин и миозин). Белки цитоскелета необходимы для расхождения хромосом в процессе митоза.
Питательная (резервная) функция. Белки яйца (овальбумины) - источники питания для плода. Основной белок молока (казеин) также выполняет питательную функцию.
Каталитическая функция. Большинство известных в настоящее время ферментов (биологических катализаторов) является белками.
Транспортная функция. Белок эритроцитов гемоглобин участвует в переносе кислорода и углекислого газа, выполняя дыхательную функцию. Альбумины сыворотки крови участвуют в транспорте липидов.
Защитная функция. В ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков синтезируются защитные белки - антитела (иммунная защита). Ряд белков плазмы крови способны к свертыванию, что предохраняет от кровопотери при ранениях (физическая защита).
Гормональная функция. Группа гормонов представлена белками или полипептидами, например, гормон поджелудочной железы инсулин.
Рецепторная функция. Клеточные белки образуют специфические рецепторы и участвуют в передаче гормонального сигнала.
Другие важные функции белков - способность поддерживать онкотическое давление в клетках и крови, буферные свойства, обеспечивающие физиологическое значение рН внутренней среды, и др.
1.3. Аминокислотный состав белков
Для определения аминокислот, входящих в состав белков, применяют кислотный (НС1), щелочной (Ва(ОН)2) и ферментативный гидролиз. При гидролизе чистого белка, не содержащего примесей, освобождаются 20 различных аминокислот.
Аминокислоты, входящие в состав белков, являются a-аминокислотами. Все они принадлежат к L-ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора. В белках человека D-аминокислоты не обнаружены, однако они встречаются в клеточной стенке бактерий, в составе некоторых антибиотиков (актиномицинов).
Аминокислоты отличаются друг от друга химической природой радикала R, который не участвует в образовании пептидной связи.
Современная рациональная классификация аминокислот основана на полярности радикалов:
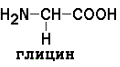
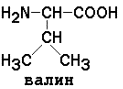
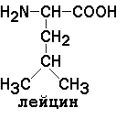
неполярные (гидрофобные)
|
|
|
|
|
|
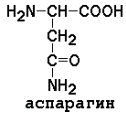
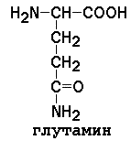
2) полярные (гидрофильные)
|
|
|
|
|
|
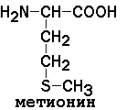
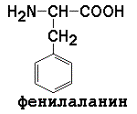
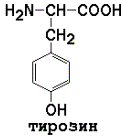
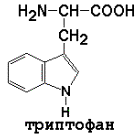
3) ароматические (главным образом неполярные)
|
|
|
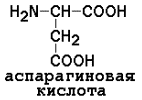
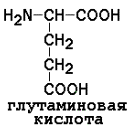
4) отрицательно заряженные
|
|
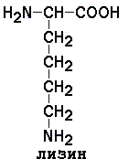
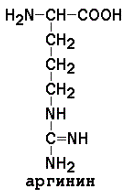
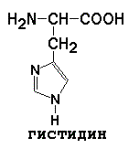
5) Положительно заряженные
|
|
|
В некоторых белках обнаружены производные аминокислот. В белке соединительной ткани коллагене содержатся оксипролин и оксилизин. Дийодтирозин является основой структуры гормонов щитовидной железы.

Аминокислоты обладают общим свойством - амфотерностью (от греч amphoteros - двусторонний). В интервале рН 4,0-9,0 почти все аминокислоты существуют в форме биполяных ионов (цвиттерионов). Значение изоэлектрической точки аминокислоты (ИЭТ, рI) рассчитывается по формуле:
![]() .
.
Для моноаминодикарбоновых кислот рI рассчитывается как полусумма значений рK (таблица 1) - и -карбоксильных групп, для диаминомонокарбоновых кислот – как полусумма значений рK - и -аминогрупп.
Существуют заменимые аминокислоты (могут синтезироваться в организме человека), и незаменимые, которые в организме не образуются и должны поступать с пищей.
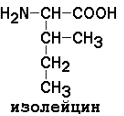
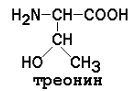
Незаменимые аминокислоты: валин, лейцин, изолейцин, лизин, метионин, треонин, триптофан, фенилаланин.
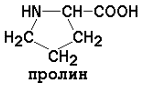
Заменимые аминокислоты: глицин, аланин, аспарагин, аспартат, глутамин, глутамат, пролин, серин.
Условно заменимые (могут синтезироваться в организме из других аминокислот): аргинин (из цитруллина), тирозин (из фенилаланина), цистеин (из серина), гистидин (при участии глутамина).
Содержание различных аминокислот в белках неодинаково.
Для открытия в биологических объектах и количественного определения аминокислот используют реакцию с нингидрином.
Таблица 1. Константы диссоциации аминокислот
Аминокислота |
pK1 |
pK2 |
pK3 |
Алании |
2,34 |
9,69 |
|
Аргинин |
2,18 |
9,09 |
13,2 |
Аспарагин |
2,02 |
8,80 |
|
Аспарагиновая кислота |
1,88 |
3,65 |
9,60 |
Валии |
2,32 |
9,62 |
|
Гистидин |
1,78 |
5,97 |
8,97 |
Глицин |
2,34 |
9,60 |
|
Глутамин |
2,17 |
9,13 |
|
Глутаминовая кислота |
2,19 |
4,25 |
9,67 |
Изолейцин |
2,26 |
9,62 |
|
Лейцин |
2,36 |
9,60 |
|
Лизин |
2,20 |
8,90 |
10,28 |
Метионин |
2,28 |
9,21 |
|
Пролин |
1,99 |
10,60 |
|
Серии |
2,21 |
9,15 |
|
Тирозин |
2,20 |
9,11 |
10,07 |
Треонин |
2,15 |
9,12 |
|
Триптофан |
2,38 |
9,39 |
|
Фенилаланин |
1,83 |
9,13 |
|
Цистеин |
1,71 |
8,33 |
10,78 |