- •Биохимия (часть 1)
- •060101.65 – Лечебное дело
- •060103.65 – Педиатрия
- •060105.65 – Стоматология
- •СОдержАние
- •Предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •5) Положительно заряженные
- •1.4. Структурная организация белков
- •Методы определения n-концевой аминокислоты
- •Методы определения с-концевой аминокислоты
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Производные гемоглобина
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2.1. Влияние на ферменты активаторов и ингибиторов.
- •2.2. Химическая модификация фермента.
- •2.3. Аллостерическая регуляция.
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •D2 (эргокальциферол) d3 (холекальциферол)
- •3.2. Водорастворимые витамины
- •Методы определения витаминов
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •4.2. Транспорт веществ через мембрану
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Микросомальное окисление
- •6.6. Антиоксидантная система
- •6.7. Реакции общего пути катаболизма
- •6.7.1. Окислительное декарбоксилирование пвк
- •6.7.2. Цикл трикарбоновых кислот
- •Анаболические функции цикла Кребса
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •Литература
- •11. Харитонов, я.Ю. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. / я.Ю. Харитонов. – м.: геотар-Медиа, 2014. – 656 с.
6.2. Биоэнергетика
Одна из основных функций катаболизма - извлечение химической энергии из содержащихся в пище веществ и использование этой энергии на обеспечение необходимых функций.
Энергия окисляющихся веществ используется для синтеза АТФ из АДФ.
Если энергия, освобождающаяся при реакции гидролиза вещества, превышает 30 кДж/моль, то гидролизуемую связь называют высокоэнергетической (макроэргической). Примеры макроэргических соединений – ацетилКоА, креатинфосфат, фосфоенолпируват и др. Однако АТФ – универсальный источник энергии в организме. Энергия гидролиза АТФ в среднем 50 кДж/моль. Макроэргическая связь в формуле обозначается знаком « » (тильда).
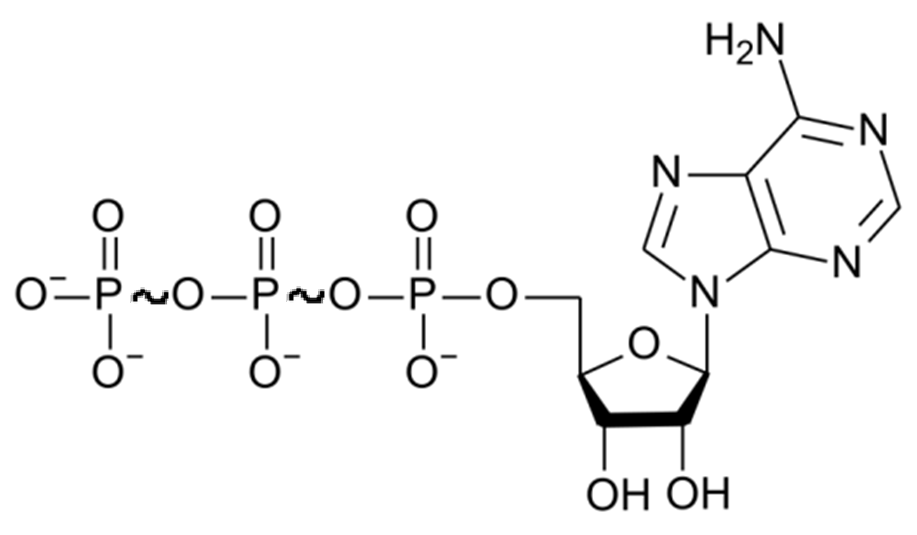 АТФ
АТФ
Один из путей синтеза АТФ из АДФ - субстратное фосфорилирование - образование АТФ за счет энергии другого макроэргического соединения. Такой тип энергетического обеспечения клетки может происходить в бескислородных условиях, например, распад глюкозы до молочной кислоты:
С6Н12О6 = 2С3Н6О3 + 65 кДж/моль.
Одной из реакций данного многостадийного процесса является реакция субстратного фосфорилирования – синтеза АТФ за счет макроэргической связи 1,3-дифосфоглицерата:

Использование клетками кислорода открывает возможности для более полного окисления субстратов.
Тканевое дыхание - совокупность реакций окисления субстратов в живых клетках, сопровождающихся потреблением молекулярного кислорода и приводящих к выделению углекислого газа и воды и образованию биологических видов энергии.
Впервые сущность дыхания объяснил Антуан Лоран Лавуазье (1777), обративший внимание на сходство между горением органических веществ вне организма и дыханием животных. В организме окисление протекает при относительно низкой температуре в присутствии воды, и его скорость регулируется обменом веществ.
Рассмотрим реакцию окисления глюкозы:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О + 2780 кДж/моль.
В организме этот процесс протекает многостадийно. Углерод превращается в диоксид углерода за счет кислорода самого окисляемого вещества и кислорода воды. В реакции участвуют акцепторы водорода, которые переносят его на кислород. Кислород используется для синтеза воды за счет водорода окисляемых субстратов.
С6Н12О6 + 6Н2О + 12А = 6СО2 + 12АН2
12АН2 + 6О2 = 12Н2О + 12А
______________________________________
С6Н12О6 + 6О2 = 6СО2 + 6Н2О
Таким же способом окисляются и другие вещества. Наибольшей скоростью тканевого дыхания характеризуются почки, мозг, печень, наименьшей - кожа, мышечная ткань (в покое).
Главный путь синтеза АТФ из АДФ - окислительное фосфорилирование – синтез АТФ из АДФ и неорганического фосфата, происходящий благодаря энергии, выделяющейся при окислении органических веществ в процессе клеточного дыхания, т.е. сопряжение дыхания и фосфорилирования. В упрощенном виде сущность процесса передает следующее уравнение:
АДФ + Н3РО4 + энергия АТФ + Н2О.
6.3. Организация и функционирование дыхательной цепи
Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов (т. е. атомов водорода) от органических веществ на кислород. В этом процессе участвует ряд промежуточных переносчиков, образующих дыхательную цепь.
Дыхательная цепь (электронотранспортная цепь, цепь переноса электронов) - система трансмембранных белков и переносчиков электронов, которые передают электроны от субстратов на кислород. В клетках эукариот дыхательная цепь расположена во внутренней мембране митохондрий.
При взаимодействии НАД+ и НАДФ+ с атомами водорода происходит обратимое присоединение атомов водорода.
В молекулу НАД+ (НАДФ+) включаются 2 электрона и один протон, второй протон остается в среде:
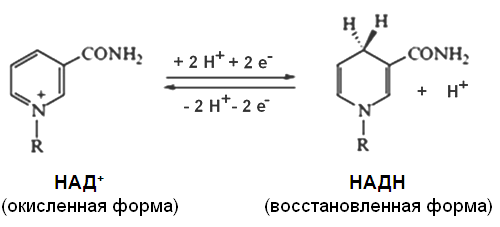
Другим первичным источником атомов водорода и электронов служит восстановленный флавопротеин (ФАД или ФМН):
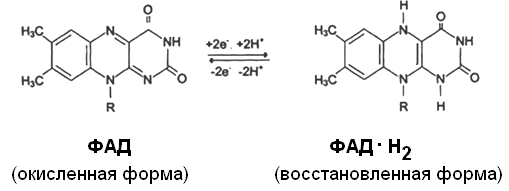
Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дыхательной цепи митохондрий.
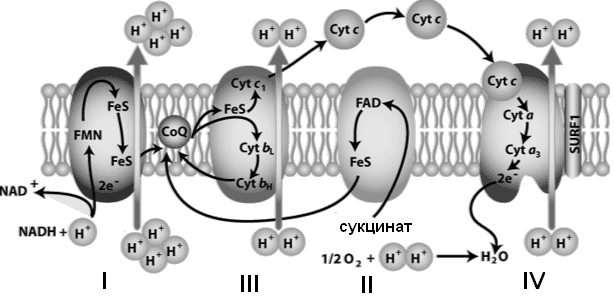
Компоненты дыхательной цепи встроены в митохондриальную мембрану в виде 4 белково-липидных комплексов (рис. 33).
|
Рис. 33. Митохондриальная дыхательная цепь
|
Комплекс I (НАДН-дегидрогеназа) включает ФМН и железосерный белок FeS (негемовое железо). Железосерный белок участвует в окислительно-восстановительном процессе. Комплекс I окисляет НАДН, перенося с него 2 электрона на кофермент Q (KоQ) и перекачивает 4 протона из матрикса в межмембранное пространство митохондрии.
KoQ (убихинон) - производное бензохинона. Это некрупная липофильная молекула. Перемещаясь в липидном слое мембраны, убихинон обеспечивает передачу электронов между комплексами I - III и II - III.
Комплекс II (сукцинат-дегидрогеназа) включает ФАД и железосерный белок. Обеспечивает вход в цепь дополнительных электронов за счет окисления сукцината.
Комплекс III (QН2-дегидрогеназа) включает цитохромы b и с1 и железосерный белок. Цитохромы - гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Комплекс III переносит электроны с убихинона на цитохром с и перекачивает 2 протона в межмембранное пространство.
Комплекс IV (цитохром c оксидаза) состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди. Комплекс IV катализирует перенос электронов с молекул цитохрома на O2 и перекачивает 4 протона в межмембранное пространство.
Цитохром а3 - терминальный участок дыхательной цепи (цитохромоксидаза): происходит окисление цитохрома с и образование воды. В организме человека митохондриальная дыхательная цепь образует 300-400 мл воды за сутки (метаболическая вода).
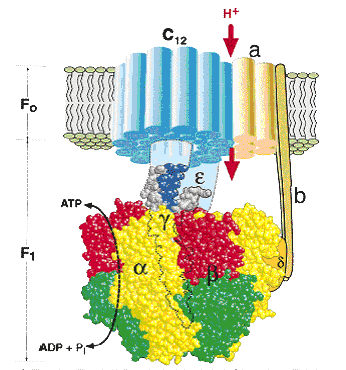
Компоненты дыхательной цепи митохондрий расположены в порядке убывания окислительно-восстановительного потенциала. Перемещение электронов в дыхательной цепи происходит по градиенту окислительно-восстановительного потенциала и является источником энергии для переноса протонов. Перенос двух электронов через каждый комплекс обеспечивает перекачку четырех протонов. В результате по сторонам мембраны возникает разность концентраций протонов и одновременно разность электрических потенциалов со знаком «плюс» на наружной поверхности. Электрохимический потенциал понуждает протоны двигаться в обратном направлении - с наружной поверхности внутрь. Однако мембрана непроницаема для них, за исключением участков, где располагается фермент протонная АТФ-синтаза (рис. 34).
АТФ-синтаза состоит из двух частей – статора и ротора.
Статор состоит из трех α-субъединиц и трех β-субъединиц – они участвуют непосредственно в синтезе АТФ из АДФ и фосфата. К ним примыкает δ-субъединица, и все вместе они образуют F1-субъединицу.
Ротор состоит из - и -субъединиц.
Статор держится в мембране, а ротор вращается за счет энергии протонов.
В статоре имеется протонный канал (F0). Он состоит из двух полуканалов, которые смещены один относительно другого. Протон проходит одну половину канала, затем на вращающемся роторе попадает во вторую половину канала.
|
Рис. 34. Строение протонной АТФ-синтазы
|
Движущей силой для АТФ-синтазы, катализирующей реакцию
АДФ + Н3РО4 = АТФ + Н2О,
является разность электрохимических потенциалов, создаваемая при движении протонов через канал.
П. Митчелл для объяснения молекулярного механизма сопряжения транспорта электронов и образования АТФ в дыхательной цепи в 1960 г. предложил хемиосмотическую концепцию: в дыхательной цепи есть только 3 участка (комплексы I, III, IV), где перенос электронов сопряжен с накоплением энергии, достаточным для образования АТФ.
Коэффициент фосфорилирования - отношение величины образовавшейся АТФ к поглощенному кислороду: АТФ/О или Р/О. Максимальная величина коэффициента фосфорилирования 3, если реакция окисления идет с участием НАДН+Н+, и 2, если окисление субстрата протекает через ФАДН2. Реально получаемые величины меньше (2,5 и 1,5), т.е. процесс дыхания не полностью сопряжен с фосфорилированием. Степень сопряжения зависит главным образом от целостности митохондриальной мембраны.
Образующаяся АТФ при участии АДФ-АТФ-транслоказы транспортируется из матрикса на наружную сторону мембраны и попадает в цитозоль. Одновременно та же транслоказа переносит АДФ в обратном направлении, из цитозоля в матрикс митохондрии.
Общее содержание АТФ в организме 30-50 г, но средняя продолжительность жизни молекулы АТФ меньше 1 мин. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается.
На каждое сокращение сердечной мышцы расходуется около 2% имеющейся в ней АТФ. Вся АТФ израсходовалась бы за 1 мин., если бы не было ее регенерации. При образовании тромба в коронарной артерии поступление кислорода в клетки прекращается, соответственно прекращается и регенерация АТФ, и клетки погибают (инфаркт миокарда).
Увеличение концентрации АДФ приводит к ускорению дыхания и фосфорилирования. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем.
Для оценки влияния адениловых нуклеотидов на процессы метаболизма используют энергетический заряд клетки (ЭЗК):
![]()
В норме ЭЗК = 0,7-0,8: скорость образования АТФ равна скорости ее использования, адениловая система насыщена энергией.
При ЭЗК < 0,7 ускоряется образование АТФ путем увеличения скорости реакций общего пути катаболизма.
Если ЭЗК = 1, то процессы синтеза АТФ тормозятся и ускоряется ее использование.
Механизм дыхательного контроля характеризуется высокой точностью. Относительные концентрации АТФ и АДФ в тканях изменяются в узких пределах, тогда как потребление энергии клеткой может изменяться в десятки раз.
Т.о., энергия пищевых веществ в клетке трансформируется сначала в энергию АТФ, а затем АТФ служит непосредственным источником энергии для биохимических и физиологических процессов. Эти превращения энергии и есть энергетический обмен.
Гипоэнергетические состояния подразделяются на:
1. Алиментарные (голодание, авитаминоз).
2. Гипоксические. Связаны:
- с нарушением поступления кислорода в кровь. Экзогенная гипоксия - недостаток кислорода во вдыхаемом воздухе, легочная (дыхательная) –нарушение легочной вентиляции;
- с нарушением транспорта кислорода в крови. Гемодинамическая гипоксия связана с нарушениями кровообращения (генерализованные – пороки сердца, кровопотеря; локальные – спазм сосудов, тромбоз); причины гемоглобиновой гипоксии – гипогемоглобинемия, гемоглобинопатии, блокирование гемоглобина ядами.
3. Митохондриальные. Затруднено использование кислорода в клетках в результате нарушения функций митохондрий ингибиторами ферментов дыхательной цепи, разобщителями окисления и фосфорилирования, мембранотропными веществами.
При полном голодании пищевых резервов организма хватает на несколько недель. При лишении же организма кислорода смерть наступает через 2-3 минуты. Поэтому гипоксия - наиболее частая причина гипоэнергетических состояний, а гипоксия мозга - непосредственная причина смерти. Среди реанимационных процедур ведущее место занимают меры, направленные на восстановление снабжения органов кислородом.