
- •Биохимия (часть 1)
- •060101.65 – Лечебное дело
- •060103.65 – Педиатрия
- •060105.65 – Стоматология
- •СОдержАние
- •Предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •5) Положительно заряженные
- •1.4. Структурная организация белков
- •Методы определения n-концевой аминокислоты
- •Методы определения с-концевой аминокислоты
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Производные гемоглобина
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2.1. Влияние на ферменты активаторов и ингибиторов.
- •2.2. Химическая модификация фермента.
- •2.3. Аллостерическая регуляция.
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •D2 (эргокальциферол) d3 (холекальциферол)
- •3.2. Водорастворимые витамины
- •Методы определения витаминов
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •4.2. Транспорт веществ через мембрану
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Микросомальное окисление
- •6.6. Антиоксидантная система
- •6.7. Реакции общего пути катаболизма
- •6.7.1. Окислительное декарбоксилирование пвк
- •6.7.2. Цикл трикарбоновых кислот
- •Анаболические функции цикла Кребса
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •Литература
- •11. Харитонов, я.Ю. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. / я.Ю. Харитонов. – м.: геотар-Медиа, 2014. – 656 с.
2.2. Химическая модификация фермента.
Регуляция активности ферментов путем фосфорилирования-дефосфорилирования. Протекает при участии протеинкиназ по ОН-группам серина и треонина, а в ряде случаев – тирозина. Активным ферментом может быть или фосфорилированная или дефосфорилированная форма. Фермент липаза активируется путем фосфорилирования.
Регуляция активности путем ассоциации-диссоциации субъединиц в олигомерном ферменте. Например, фермент протеинкиназа в неактивной форме является тетрамером. Для активации протеинкиназы необходима диссоциация субъединиц.
Активация ферментов путем частичного протеолиза. Некоторые ферменты синтезируются неактивными и лишь после секреции из клетки переходят в активную форму путем удаления части белковой молекулы. Так происходит активация протеолитических ферментов, в частности, трипсина.
2.3. Аллостерическая регуляция.
Во многих случаях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Конечный продукт подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Он связывается с аллостерическим центром молекулы фермента. Это ингибирование по принципу обратной связи, или ретроингибирование.
2.6. Классификация и номенклатура ферментов
Современные классификация и номенклатура ферментов разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в г. Москве.
В основу классификации легли три принципа:
1. Химическая природа фермента.
2. Химическая природа субстрата, на который действует фермент.
3. Тип катализируемой реакции.
Ферменты делят на шесть классов.
1
СООН
СООН
НО
– С – Н малатдегидрогеназа
С = О
+
НАД+
----------------------------
+ НАДН + Н+ Н
– С – Н ---------------------------
СН2
СООН
СООН L
– малат
оксалоацетат
Аэробные дегидрогеназы, или оксидазы, катализируют перенос протонов (электронов) непосредственно на кислород;
Анаэробные дегидрогеназы ускоряют перенос протонов (электронов) на промежуточный субстрат, но не на кислород.
Наиболее распространены оксидоредуктазы, содержащие в качестве кофактора никотинамидадениндинуклеотид (НАД+), либо никотинамидадениндинуклеотидфосфат (НАДФ+). Их называют пиридинферментами.
Коферментами оксидоредуктаз являются также флавопротеины (ФП) – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Подобные ферменты получили название флавиновых дегидрогеназ.
2. Трансферазы - ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
Фосфотрансферазы катализируют перенос остатка фосфорной кислоты. Донором фосфатных остатков в большинстве случаев является АТФ. Фосфорные эфиры органических соединений обладают повышенной химической активностью. Реакция фосфорилирования глюкозы катализируется гексокиназой или АТФ,D-глюкоза-6-фосфотрансеразой:
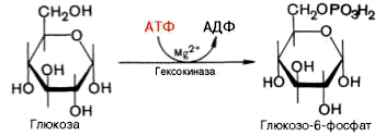
Протеинкиназы переносят остаток фосфата с АТФ на белки, изменяя их биологическую активность.
Аминотрансферазы ускоряют реакцию переноса аминогруппы с аминокислоты на a-кетокислоту:
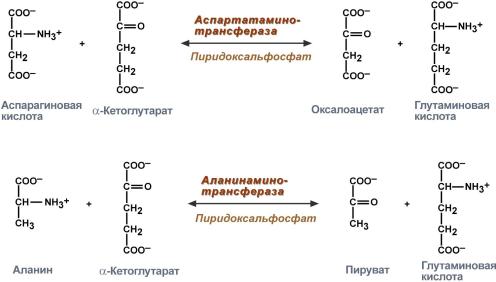
аспарагиновая α-кетоглутарат оксалоацетат глутаминовая
кислота кислота
Гликозилтрансферазы катализируют реакции переноса гликозильных остатков; ацилтрансферазы – реакции переноса ацилов (остатков карбоновых кислот).
3. Гидролазы катализируют расщепление внутримолекулярных связей органических веществ при участии молекулы воды.
Э
СН2
– О – СО – С15Н31
СН2
– ОН
липаза
СН
– О – СО – С15Н31
+ 2НОН ---------
СН – О – СО – С15Н31
+ 2С15Н31СООН
--------
пальмитиновая СН2
– О – СО – С15Н31
СН2
– ОН кислота
трипальмитин
-пальмитилглицерин
Фосфатазы гидролизуют фосфорные эфиры:
Г-1-Ф
+ Н2О
![]() Г + Н3РО4
Г + Н3РО4
Гликозидазы катализируют гидролиз гликозидов. Амилаза расщепляет гликозидные связи в молекулах крахмала.
Пептидгидролазы ускоряют гидролиз пептидных связей в белках и пептидах.
4. Лиазы - ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов негидролитическим путем. Эти реакции, как правило, сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т. д..
Декарбоксилазы относятся к углерод-углерод-лиазам:
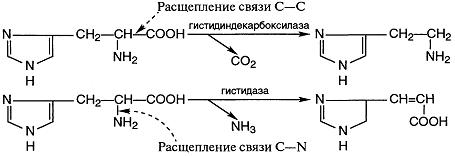
Некоторые лиазы ускоряют реакции не только отщепления, но и присоединения.
5. Изомеразы - ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
Мутаротаза ускоряет реакцию превращения α-D-глюкопиранозы в β-D-глюкопиранозу:

6. Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии АТФ либо других веществ:
пируваткарбоксилаза
СН3-СО-СООН + СО2 + АТФ ---------------------------- НООС-СН2-СО-СООН + АДФ + Рi.
пировиноградная оксалоацетат
кислота
Международная комиссия подготовила Классификацию ферментов (КФ). Код каждого фермента содержит четыре цифры, разделенные точками. Первая цифра указывает номер класса, вторая означает подкласс и характеризует вид субстрата (у трансфераз указывает на природу переносимой группы, у гидролаз - на тип гидролизуемой связи). Третья цифра уточняет природу участвующих в реакции соединений или групп. Четвертая цифра – номер фермента в данном подподклассе. В подподклассе ферменты располагаются по алфавиту. Пример: пепсин – пептид-пептидогидролаза; КФ 3.4.4.1.
