- •Биохимия (часть 1)
- •060101.65 – Лечебное дело
- •060103.65 – Педиатрия
- •060105.65 – Стоматология
- •СОдержАние
- •Предмет биохимии
- •1. Химия белков
- •1.1. Методы выделения и очистки белков
- •1.2. Функции белков
- •1.3. Аминокислотный состав белков
- •5) Положительно заряженные
- •1.4. Структурная организация белков
- •Методы определения n-концевой аминокислоты
- •Методы определения с-концевой аминокислоты
- •1.5. Физико-химические свойства белков
- •1.6. Классификация белков
- •1.6.1. Простые белки
- •1. Альбумины и глобулины.
- •2. Протамины и гистоны.
- •3. Проламины и глютелины.
- •1.6.2. Сложные белки
- •Производные гемоглобина
- •Структура нуклеиновых кислот
- •Контрольные вопросы
- •2. Ферменты
- •2.1. Химическая природа ферментов
- •2.2. Механизм действия ферментов
- •2.3. Кинетика ферментативных реакций
- •2.4. Свойства ферментов
- •2.5. Регуляция активности ферментов
- •1. Контроль количества фермента.
- •2.1. Влияние на ферменты активаторов и ингибиторов.
- •2.2. Химическая модификация фермента.
- •2.3. Аллостерическая регуляция.
- •2.6. Классификация и номенклатура ферментов
- •2.7. Ферменты в медицине
- •2. Приобретенные энзимопатии.
- •Контрольные вопросы
- •3. Витамины
- •3.1. Жирорастворимые витамины
- •D2 (эргокальциферол) d3 (холекальциферол)
- •3.2. Водорастворимые витамины
- •Методы определения витаминов
- •Контрольные вопросы
- •4. Основные принципы организации биомембран
- •4.1. Строение и функции мембран
- •4.2. Транспорт веществ через мембрану
- •Контрольные вопросы
- •5. Механизмы передачи гормонального сигнала
- •Трансмембранная передача гормонального сигнала
- •Контрольные вопросы
- •6. Введение в метаболизм
- •6.1. Общая схема катаболизма
- •6.2. Биоэнергетика
- •6.3. Организация и функционирование дыхательной цепи
- •6.4. Разобщение окисления и фосфорилирования
- •6.5. Микросомальное окисление
- •6.6. Антиоксидантная система
- •6.7. Реакции общего пути катаболизма
- •6.7.1. Окислительное декарбоксилирование пвк
- •6.7.2. Цикл трикарбоновых кислот
- •Анаболические функции цикла Кребса
- •Контрольные вопросы
- •7. Обмен углеводов
- •7.1. Переваривание углеводов
- •7.2. Обмен гликогена
- •7.3. Гликолиз
- •7.4. Включение фруктозы и галактозы в гликолиз
- •7.5. Челночные механизмы
- •7.6. Цикл кори
- •7.7. Спиртовое брожение
- •7.8. Пентозофосфатный путь превращения глюкозы
- •7.9. Глюконеогенез
- •7.10. Регуляция обмена углеводов
- •7.11. Нарушения углеводного обмена Нарушение гидролиза и всасывания углеводов
- •Гликогенозы
- •Нарушения промежуточного обмена углеводов
- •Гипер- и гипогликемия
- •Глюкозурия
- •Контрольные вопросы
- •Литература
- •11. Харитонов, я.Ю. Аналитическая химия. Аналитика 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. / я.Ю. Харитонов. – м.: геотар-Медиа, 2014. – 656 с.
2.2. Механизм действия ферментов
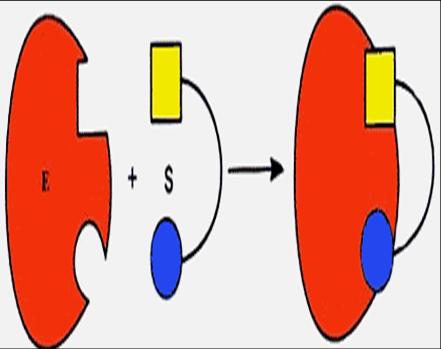
Фермент Е обратимо соединяется с субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р:
![]()
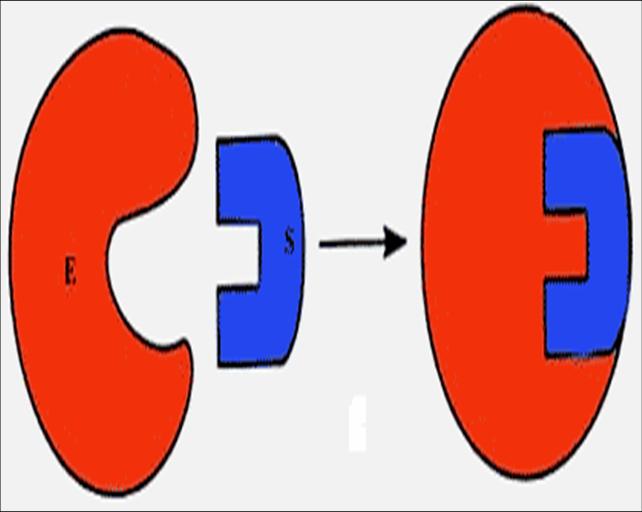
Эти представления легли в основу теории «ключ-замок» Э. Фишера (1890). Структура активного центра комплементарна молекулярной структуре субстрата, что обеспечивает высокую специфичность фермента (рис. 16а). В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи.
|
а. Теория «перчатка – рука» |
б. Теория «индуцированного соответствия» |
Рис. 16. Теории ферментативного катализа
Д. Кошлендом была разработана теория «индуцированного соответствия» (1958). Пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выражено формулой «перчатка - рука». Субстрат индуцирует конформационные изменения молекулы фермента таким образом, что активный центр принимает необходимую для связывания субстрата пространственную ориентацию (рис. 16б). Т.е. фермент только в момент присоединения субстрата будет находиться в активной (напряженной) Т-форме (tensile) в отличие от неактивной R-формы (relaxe).
В настоящее время все более популярной становится гипотеза топохимического соответствия. Сохраняя основные положения теории «индуцированного соответствия», она объясняет специфичность действия ферментов узнаванием той части субстрата, которая не изменяется при катализе. В момент присоединения субстрата к активному центру фермента последний индуцирует переход субстрата в напряженное состояние (рис. 17).
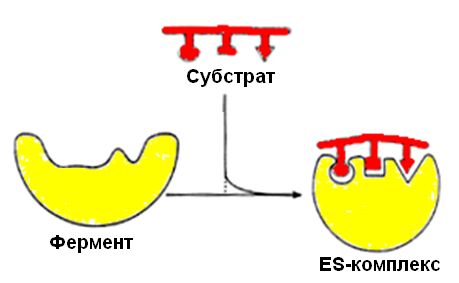
Рис. 17. Гипотеза топохимического соответствия
Ферменты ускоряют химические реакции за счет снижения энергии активации (рис. 18).
Энергия активации - энергия, необходимая для перевода всех молекул 1 моль вещества в активированное состояние при данной температуре.
Как катализируемая ферментом, так и не катализируемая им реакция имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Однако ферментативная реакция имеет более низкую энергию активации. Действуя на скорость реакции, ферменты не изменяют положения равновесия между прямой и обратной реакциями, а лишь ускоряют его наступление.

Рис. 18. Энергетическая диаграмма ферментативной реакции
2.3. Кинетика ферментативных реакций
Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температура, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Скорость ферментативной реакции () измеряют по убыли количества субстрата или приросту продукта за единицу времени.
При низкой концентрации субстрата скорость реакции

прямо пропорциональна его концентрации. При высокой концентрации субстрата, когда все активные центры фермента заняты субстратом (насыщение фермента субстратом), скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [S] и целиком определяется концентрацией фермента (рис. 19).
KS – константа диссоциации фермент-субстратного комплекса ES, обратна константе равновесия:
![]() .
.
Чем меньше значение KS, тем выше сродство фермента к субстрату.
|
Рис. 19. Зависимость скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента |
Количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции выражает уравнение Михаэлиса-Ментен:
![]() ,
,
- скорость реакции, max - максимальная скорость ферментативной реакции.
Бриггс и Холдейн усовершенствовали уравнение, введя в него константу Михаэлиса Km, определяемую экспериментально.
Уравнение Бриггса – Холдейна:
![]() ,
,
где
![]() .
.
Константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость ферментативной реакции составляет половину от максимальной (рис. 20). Кm показывает сродство фермента к субстрату: чем меньше ее значение, тем больше сродство.
|
Рис. 20. Графическое определение константы Михаэлиса
|
Экспериментальные значения Кm для большинства ферментативных реакций с участием одного субстрата обычно 10-2-10-5 М. Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Кm, отличающейся от таковой для субстрата обратной реакции.
Г. Лайнуивер и Д. Берк преобразовали уравнение Бриггса – Холдейна и получили уравнение прямой линии: у = ах + b (рис. 21):
![]() .
.
Метод Лайнуивера – Берка дает более точный результат.
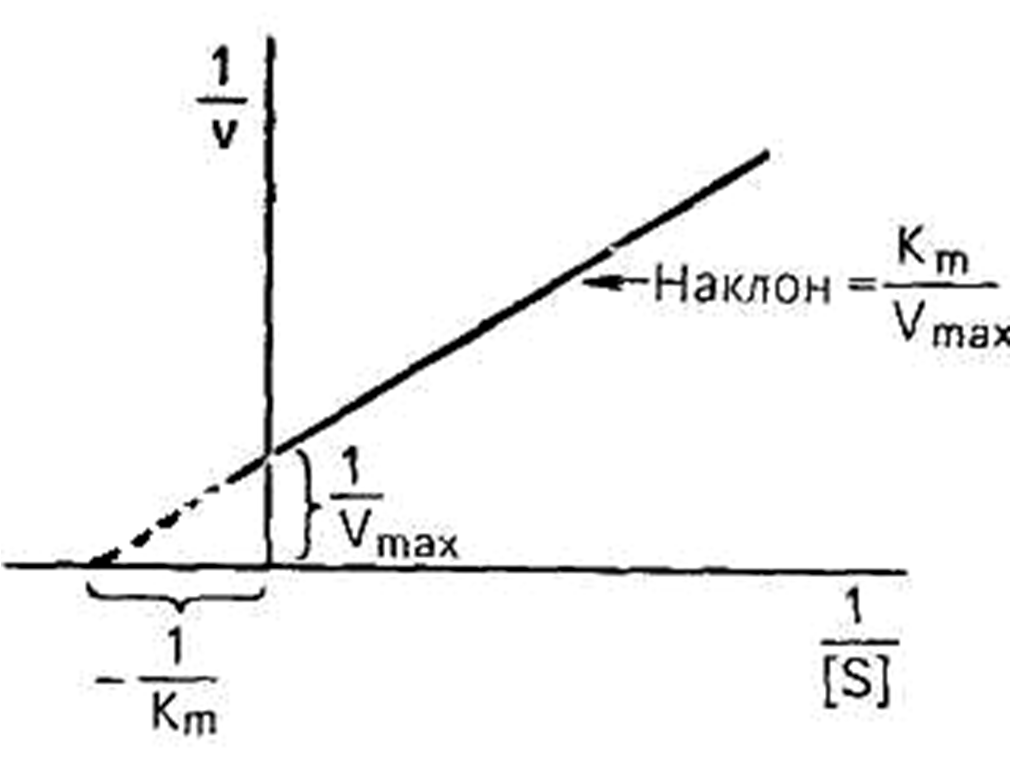
Рис. 21. Графическое определение константы Михаэлиса
по методу Лайнуивера-Берка