
- •Введение
- •Общие методические указания
- •I.Самостоятельная работа
- •Рекомендации
- •Требования
- •II.Экзаменационная сессия
- •III.Консультации. Экзамен
- •Программа по общей и неорганической химии
- •Список условных сокращений
- •Часть 1. Общая химия
- •Часть 2. Неорганическая химия
- •Литература
- •Методические указания и типовые примеры к контрольному заданию № 1
- •1. Атомно-молекулярное учение. Основные понятия и законы химии
- •0,1 Л газа весит 0,206 г
- •22,4 Л газа весят X г, отсюда
- •2. Строение вещества
- •2.1. Электронные оболочки атомов. Пз и псэ
- •2.2. Природа химической связи и строение химических соединений
- •2.3. Комплексные соединения
- •3. Реакции с переносом электронов
- •Контрольное задание № 1
- •Методические указания и типовые примеры к контрольному заданию № 2
- •Химическое равновесие
- •Скорость химических реакций
- •Задачи на концентрации растворов
- •Решение задач
- •Задачи на законы разбавленных растворов неэлектролитов (законы Вант-Гоффа и Рауля)
- •Задачи с использованием степени диссоциации
- •Задачи на рН, ионное произведение воды
- •Амфотерные гидроксиды
- •Гидролиз солей
- •Гетерогенные равновесия. Условия выпадения и растворения осадков
- •Контрольное задание № 2
- •Методические указания и типовые примеры к контрольным заданиям № 3 и № 4
- •Классификация неорганических соединений. Классы соединений. Генетическая связь между классами соединений
- •Номенклатура неорганических соединений. Графические формулы
- •Графические формулы
- •Примеры выполнения контрольных заданий № 3 и № 4
- •Контрольное задание № 3
- •Контрольное задание № 4
- •Вопросы к экзамену по неорганической химии (1 курс фарм.Ф-та СибГму, заочная форма обучения).
- •Билет № х
- •Ряд активности металлов (электрохимический ряд напряжений)
- •Стандартные окислительно-восстановительные потенциалы
- •Произведения растворимости некоторых труднорастворимых электролитов (25с)
- •П рограмма, методические указания и контрольные задания по общей и неорганической химии. Вариант № 2
0,1 Л газа весит 0,206 г
22,4 Л газа весят X г, отсюда
![]() г
г
Т.к. x – это масса 1 моль газа, то M(x) = 46 г/моль.
Выводим эмпирическую формулу газа.
Зная атомные массы элементов N (Aг = 14) и O (Аг = 16), методом подбора устанавливаем, что массу 46 г будет иметь 1 моль оксида азота NO2.
Составляем графическую формулу.
Для этого учитываем валентность кислорода, она равна II, т.е. каждый атом О должен образовывать с атомом N по две связи. При этом получается, что на атом N приходится в сумме 4 связи, т.е. он четырехвалентен. Тогда графическая формула имеет следующий вид: O=N=O.
Ответ: молярная масса газа NO2 составляет 46 г/моль. Графически формула изображается так: O=N=O.
Пример 4. В состав вещества входят 31,8% калия, 29,0% хлора и 39,2% кислорода. Установите его эмпирическую формулу, изобразите ее графически. Вычислите молярную массу вещества.
Решение:
Так как массовые доли всех компонентов вещества составляют в сумме 100%, можно принять массу всего вещества за 100 граммов.
Учитывая это, находим массы отдельных элементов по формуле:
![]() .
.
![]() г
г
![]() г
г
![]() г.
г.
Обозначим формулу вещества KxClyOz, где x, y, z – количество вещества каждого элемента соответственно. Так как количество вещества можно вычислить по формуле , найдем мольное соотношение x:y:z.
![]()
![]() .
.
Для приведения этого соотношения к
целым числам разделим каждое на меньшее
из них, т.е. на 0,82, при этом получаем
![]() .
Следовательно, эмпирическая (простейшая)
формула вещества KClO3.
.
Следовательно, эмпирическая (простейшая)
формула вещества KClO3.
Для графического изображения молекулы определим степени окисления элементов, которые в данном случае будут соответствовать их валентности:
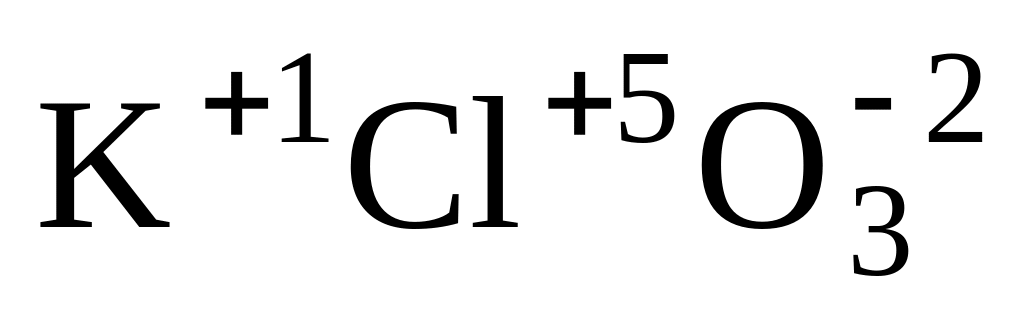 ,
значит
,
значит
 .
Тогда графическая формула имеет
следующий вид:
.
Тогда графическая формула имеет
следующий вид:
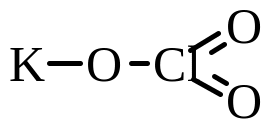 .
.Находим молярную массу вещества:
M(KClO3)=Ar(K) + Ar(Cl) + 3Ar(O) = 39 + 35,5 + 316 = 122,5 г/моль.
Ответ: молярная масса вещества KClO3 составляет 122,5 г/моль. Графически формула вещества изображается так:
Пример 5. К раствору, содержащему 4 моль FeCl3, прибавили 0,5 кг KOH. Определите массу полученного осадка.
Решение:
В основе решения лежит реакция:
FeCl3 + 3KOH Fe(OH)3 + 3KCl
Находим вещество, по которому следует вести расчет продуктов реакции, т.е. выясняем избыток и недостаток реагирующих веществ. По уравнению соотношение количества веществ FeCl3 к KOH равно 1 : 3. По условию дано 4 моль FeCl3, значит надо вычислить количество вещества n(x) KOH по формуле:
По условию m(KOH) = 0,5 кг = 500 г.
M(KOH) = Ar(K) + Ar(O) + Ar(H) = 39 + 16 + 1 = 56 г/моль.
На 4 моль FeCl3 должно приходиться 12 моль KOH по уравнению реакции. Имеется 8,9 моль, значит KOH находится в недостатке и расчет продукта следует вести по KOH.
Находим массу осадка.
Для этого составляем пропорцию:
![]() ,
где 107 г/моль = M(Fe(OH)3)
,
где 107 г/моль = M(Fe(OH)3)
решая которую, находим массу осадка.
m(Fe(OH)3)
= x =
![]() г
г
Ответ: масса осадка Fe(OH)3 составляет 318,45 грамма.
Пример 6. Сколько литров водорода выделится при действии разбавленной серной кислоты на 0,6 моль алюминия? Сколько соли при этом образуется?
Решение:
В основе решения лежит реакция:
2Al + 3H2SO4 Al2(SO4)3 + 3H2
Находим объем водорода по пропорции:
![]() ,
где 22,4 л/моль – молярный объем газа.
,
где 22,4 л/моль – молярный объем газа.
V(H2)
= x =
![]() (л)
(л)
Находим массу соли Al2(SO4)3.
Исходя из условия: m(Al) = n(Al)Ar(Al) = 0,6 моль27 г/моль = 16,2 г.
Составим пропорцию:
![]() ,
,
исходя из которой найдем массу соли
![]() г.
г.
Ответ: выделится 20,16 л H2 и образуется 102,6 г соли.
