
- •Введение
- •Общие методические указания
- •I.Самостоятельная работа
- •Рекомендации
- •Требования
- •II.Экзаменационная сессия
- •III.Консультации. Экзамен
- •Программа по общей и неорганической химии
- •Список условных сокращений
- •Часть 1. Общая химия
- •Часть 2. Неорганическая химия
- •Литература
- •Методические указания и типовые примеры к контрольному заданию № 1
- •1. Атомно-молекулярное учение. Основные понятия и законы химии
- •0,1 Л газа весит 0,206 г
- •22,4 Л газа весят X г, отсюда
- •2. Строение вещества
- •2.1. Электронные оболочки атомов. Пз и псэ
- •2.2. Природа химической связи и строение химических соединений
- •2.3. Комплексные соединения
- •3. Реакции с переносом электронов
- •Контрольное задание № 1
- •Методические указания и типовые примеры к контрольному заданию № 2
- •Химическое равновесие
- •Скорость химических реакций
- •Задачи на концентрации растворов
- •Решение задач
- •Задачи на законы разбавленных растворов неэлектролитов (законы Вант-Гоффа и Рауля)
- •Задачи с использованием степени диссоциации
- •Задачи на рН, ионное произведение воды
- •Амфотерные гидроксиды
- •Гидролиз солей
- •Гетерогенные равновесия. Условия выпадения и растворения осадков
- •Контрольное задание № 2
- •Методические указания и типовые примеры к контрольным заданиям № 3 и № 4
- •Классификация неорганических соединений. Классы соединений. Генетическая связь между классами соединений
- •Номенклатура неорганических соединений. Графические формулы
- •Графические формулы
- •Примеры выполнения контрольных заданий № 3 и № 4
- •Контрольное задание № 3
- •Контрольное задание № 4
- •Вопросы к экзамену по неорганической химии (1 курс фарм.Ф-та СибГму, заочная форма обучения).
- •Билет № х
- •Ряд активности металлов (электрохимический ряд напряжений)
- •Стандартные окислительно-восстановительные потенциалы
- •Произведения растворимости некоторых труднорастворимых электролитов (25с)
- •П рограмма, методические указания и контрольные задания по общей и неорганической химии. Вариант № 2
Амфотерные гидроксиды
Так как амфотерные гидроксиды проявляют свойства как кислот, так и оснований, то кроме уравнений их диссоциации по ступеням, нужно уметь записывать и двойную диссоциацию, например,
![]()
к-та H2ZnO2
![]()
к-та H3CrO3 (орто)
или HCrO2 (мета)
Растворение амфотерных гидроксидов в кислотах и щелочах следует записывать в молекулярном и ионном виде. Амфотерный гидроксид как слабый электролит на ионы не расписывается.
Пример 1.
![]()
![]()
а)

![]()
![]()
б)
![]()
![]()
Пример 2.
2Cr(OH)3 + 3H2SO4 Cr2(SO4)3 + 6H2O
2Cr(OH)3 + 6H+ + 3SO42- 2Cr3+ + 3SO42- + 6H2O
Cr(OH)3 + 3H+ Cr3+ + 3H2O
а) Cr(OH)3 + 3KOH
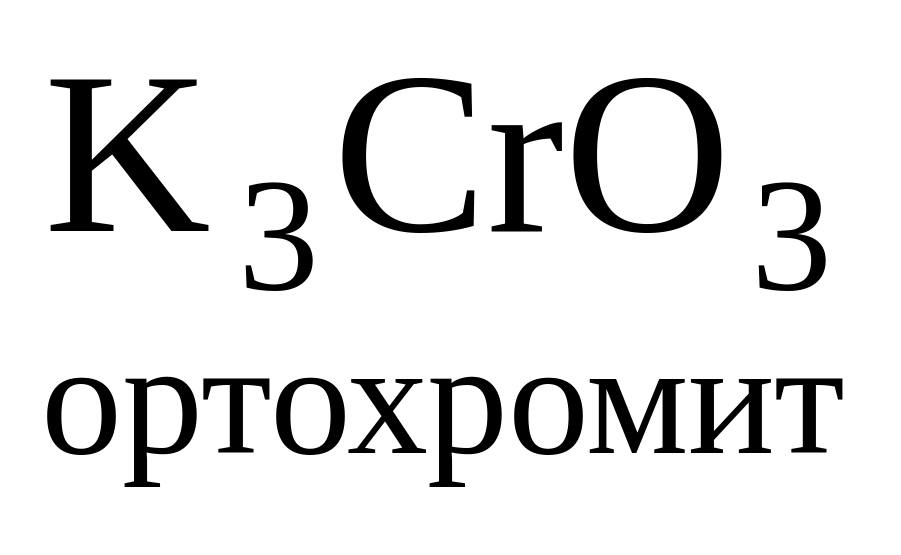 +
3H2O
+
3H2O
Cr(OH)3 + 3OH– CrO33– +3H2O
б) Cr(OH)3
+ KOH
![]() +
2H2O
+
2H2O
Cr(OH)3 + OH– CrO2– +2H2O
в) Cr(OH)3 + 3KOH K3[Cr(OH)6]
к.ч.=6 гидроксокомплекс
Cr(OH)3 + 3OH– [Cr(OH)6]3–
Гидролиз солей
Уравнения реакций гидролиза различных солей нужно писать по ступеням (1-я ступень наиболее важная), кроме случая полного гидролиза соли, в молекулярном и ионном виде.
Пример 1. K2S – соль образована сильным основанием KOH и слабой кислотой H2S (гидролиз по аниону). Гидролиз в 2 ступени, т.к. кислота двухосновная.
K2S + HOH
 KOH + KHS
KOH + KHS
2K+ + S2– + HOH K+ +OH– + K+ + HS–
S2– + HOH OH– + HS–
KHS + HOH KOH + H2S
K+ + HS– + HOH K+ + OH– + H2S
HS– + HOH OH– + H2S pH>7
Пример 2. Cr2(SO4)3 – соль образована слабым основанием Cr(OH)3 и сильной кислотой H2SO4 (гидролиз по катиону). Гидролиз идет в 3 ступени, т.к. основание трехосновное.
Cr2(SO4)3 + 2HOH 2CrOHSO4 + H2SO4
2Cr3+ + 3SO42– + 2HOH 2CrOH2+ + 2SO42- + 2H+ + SO42-
Cr3+ + HOH CrOH2+ + 2H+
2CrOHSO4 + 2HOH [Cr(OH)2]2SO4 + H2SO4
CrOH2+ + HOH Cr(OH)2+ + H+
[Cr(OH)2]2SO4 + 2HOH 2Cr(OH)3 + H2SO4
[Cr(OH)2]+ + HOH Cr(OH)3 + H+ pH < 7
Пример 3. Al2(CO3)3 – соль образована слабой кислотой H2CO3 и слабым основанием Al(OH)3 (гидролиз по катиону и аниону). Гидролиз идет в одну ступень (полный и необратимый гидролиз), т.к. в результате реакции равновесие смещено вправо ввиду образования осадка Al(OH)3 и газа СО2.
Al2(CO3)3 + 6HOH 2Al(OH)3 + 3H2CO3
H2CO3 CO2 + H2O pH=7
В других случаях соли, образованные слабыми кислотами и основаниями, гидролизуются по ступеням.
Пример 4. (NH4)3PO4 – соль образована слабым основанием NH4OH и слабой (средней) трехосновной кислотой H3PO4, поэтому гидролиз идет в 3 ступени.
(NH4)3PO4 + HOH NH4OH + (NH4)2HPO4
3NH4+ + PO43– + HOH NH4OH + 2NH4+ + HPO42–
NH4+ + PO43– + HOH NH4OH + HPO42–
(NH4)2HPO4 + HOH NH4OH + NH4H2PO4
2NH4+ + HPO42– + HOH NH4OH + NH4+ H2PO4–
NH4+ + HPO42– + HOH NH4OH + H2PO4–
NH4H2PO4 + HOH NH4OH + H3PO4
NH4+ + H2PO4 + HOH NH4OH + H3PO4
Среда – близкая к нейтральной, но слабокислая, т.к. H3PO4 – более сильный электролит, чем NH4OH.
Пример 5. NaCrO2 – соль образована сильным основанием NaOH и слабой кислотой HCrO2, в состав аниона которой входит амфотерный элемент Cr. Протекает гидролиз в 1 стадию, реакция среды – щелочная.
![]()
или H3CrO3
CrO2 + 2HOH OH– + Cr(OH)3
Пример 6. Соли SbCl3 и BiCl3 гидролизуются в 2 ступени (гидролиз не доходит до конца), т.к. на 2-й ступени выпадают осадки SbOCl и BiOCl.
SbCl3 + HOH SbOHCl2 + HCl
Sb3+ + HOH SbOH2+ + H+
SbOHCl2 + HOH Sb(OH)2Cl + HCl
Sb(OH)2Cl SbOCl + H2O
SbOH2+ + Cl– + HOH SbOCl + H2O + H+ pH<7
