
- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
Классификация химических реакций по механизму разрыва химической связи
При протекании химических реакций ковалентные связи в органических соединениях разрываются по гомолитическому или гетеролитическому механизму.
При гомолитическом разрыве связи электронная пара распадается на два электрона и соответственно возникают два атома или группа атомов с неспаренными электронами – свободные радикалы:
СН4 → ∙СН3 + ∙Н
радикал-метил радикал водорода
С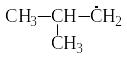 вободные
радикалы – очень реакционноспособные
частицы. Реакции, протекающие с их
участием, называются радикальными.
Самые химически активные, а, следовательно,
и самые неустойчивые − неразветвленные
радикалы.
Разветвленные
радикалы устойчивее неразветвленных.
Вторичные радикалы устойчивее первичных,
а третичные – устойчивее вторичных.
Так, в ряду радикалов:
вободные
радикалы – очень реакционноспособные
частицы. Реакции, протекающие с их
участием, называются радикальными.
Самые химически активные, а, следовательно,
и самые неустойчивые − неразветвленные
радикалы.
Разветвленные
радикалы устойчивее неразветвленных.
Вторичные радикалы устойчивее первичных,
а третичные – устойчивее вторичных.
Так, в ряду радикалов:
бутил СН3−СН2−СН2−ĊН2; изобутил ;
в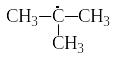
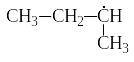 тор-бутил
; трет-бутил
тор-бутил
; трет-бутил
устойчивость радикалов увеличивается, химическая активность уменьшается.
При гетеролитическом разрыве связи электронная пара переходит к одному из атомов, в результате чего возникают катионы и анионы:
CH3Cl → CH3+ + Cl‾
метилхлорид метил-катион хлорид-анион
Образовавшиеся катионы и анионы принимают участие в последующих взаимодействиях. Положительно заряженные ионы (катионы) стремятся в ходе реакции получить электроны, поэтому их называют электрофильными, или электроноакцепторными реагентами. Они реагируют с молекулами, содержащими атомы с неподеленными электронными парами (Н2Ö, NH3), или
с анионами, например OH‾, Cl‾, Br‾, I‾:
CH3+ + ОH‾ → CH3OH
Реакции, протекающие под действием положительных частиц, называются электрофильными.
Отрицательно заряженные ионы (анионы), например СН3СОО‾, I‾, стремятся отдать электроны, поэтому они называются нуклеофильными, или электронодонорными реагентами. Они взаимодействуют с частицами, которые несут положительный заряд, например катионами металлов, ионами водорода:
СН3СОО‾ + Н+ → СН3СООН
Реакции, протекающие под действием отрицательных частиц, называются нуклеофильными.
Углеводороды
Природа химической связи в углеводородах
Атом углерода в возбужденном состоянии имеет 4 неспаренных электрона. При образовании химических связей может происходить sp3-, sp2-, sp-гибридизация атомных орбиталей углерода.
При sp3-гибридизации возникают 4 равноценные орбитали, расположенные в пространстве относительно друг друга под углом 109,50. Каждый атом углерода образует 4 ковалентные связи с другими атомами углерода и с атомами водорода. В результате образуются углеводороды алканы, у которых все валентности углеродных атомов насыщены.
В случае sp2-гибридизации у атома углерода образуются 3 гибридные орбитали и сохраняется одна негибридная р-орбиталь. Гибридные орбитали находятся в одной плоскости под углом 1200 относительно друг друга, а р-орбиталь расположена перпендикулярно этой плоскости. Соответственно атом углерода образует 3 s-связи с атомом углерода и атомами водорода и одну p-связь с атомом углерода. При sp2-гибридизации у двух атомов углерода образуются алкены – непредельные углеводороды с одной двойной связью, а при sp2-гибридизации у четырех атомов углерода образуются диены – непредельные углеводороды с двумя двойными связями. sp2-гибридизация шести атомов углерода приводит к замыканию шестичленного кольца и возникновению плоской молекулы бензола. У каждого атома углерода имеется также по одному негибридизированному р-электрону, который в случае бензола является нелокализованным.
При sp-гибридизации у атома углерода возникают две гибридные орбитали под углом 1800 относительно друг друга и сохраняются две негибридные р-орбитали, расположенные под углом 900 друг к другу. Атом углерода образует две s-связи с атомом углерода и с атомом водорода и две p-связи с атомом углерода. В результате образуется алкин – непредельный углеводород с тройной связью.
