
- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
Оксикислоты
К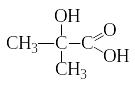 арбоновые
кислоты устойчивы к действию окислителей.
Легко окисляются лишь муравьиная кислота
и кислоты с третичным атомом углерода
в молекуле. При окислении последних
получаются оксикислоты
− вещества,
которые содержат в молекуле и гидроксильную
и карбоксильную группу:
арбоновые
кислоты устойчивы к действию окислителей.
Легко окисляются лишь муравьиная кислота
и кислоты с третичным атомом углерода
в молекуле. При окислении последних
получаются оксикислоты
− вещества,
которые содержат в молекуле и гидроксильную
и карбоксильную группу:
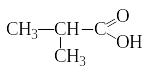
+ [O] →
изомасляная кислота α-оксиизомасляная кислота
Примеры оксикислот:
β α β α γ β α
СН2−СН(ОН)−СООН СН2(ОН)−СН2−СООН СН2(ОН)−СН2−СН2−СООН
α-оксипропионовая кислота β-оксипропионовая кислота γ-оксимасляная кислота
Химическое поведение оксикислот определяется двумя группами – карбоксильной и спиртовой. Поэтому они проявляют свойства как кислот, так и спиртов.
Кроме того, для оксикислот характерна реакция дегидратации (отщепление воды), причем, в зависимости от положения гидроксильной группы, образуются совершенно различные вещества:
-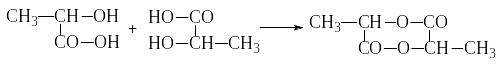 α-оксикислоты при нагревании легко
выделяют воду, образуя циклические
сложные эфиры – лактиды,
состоящие из остатков двух молекул:
α-оксикислоты при нагревании легко
выделяют воду, образуя циклические
сложные эфиры – лактиды,
состоящие из остатков двух молекул:
+ 2H2O
α-оксипропионовая α-оксипропионовая лактид
кислота кислота
- β-оксикислоты, отщепляя при нагревании воду, дают непредельные кислоты:
СН3−СНОН−СН2−СООН → СН3−СН=СН−СООН + Н2О
β-оrсимасляная кислота кротоновая кислота
-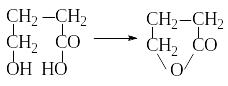 γ- и δ- оксикислоты при дегидратации
образуют внутримолекулярные циклические
эфиры – лактоны:
γ- и δ- оксикислоты при дегидратации
образуют внутримолекулярные циклические
эфиры – лактоны:
+ H2O
γ-оксимасляная кислота лактон γ-оксимасляной кислоты
Ароматические кислоты
К ароматическим кислотам относятся карбоновые кислоты, молекулы которых содержат бензольные кольца.
Простейшей ароматической карбоновой кислотой является бензойная кислота С6Н5−СООН. Она проявляет все химические свойства карбоновых кислот.
Производным бензойной кислоты является орто-гидроксибензойная или салициловая кислота:
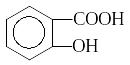
Салициловая кислота проявляет свойства и кислот и фенолов и в отличие от бензойной кислоты при взаимодействии с FeCl3 дает яркое фиолетовое окрашивание.
АМИНЫ
Амины – производные аммиака, в молекуле которого водородные атомы замещены на углеводородные радикалы.
П о
числу атомов водорода, замещенных
углеводородными радикалами, различают
первичные,
вторичные
и третичные
амины. Примеры аминов:
о
числу атомов водорода, замещенных
углеводородными радикалами, различают
первичные,
вторичные
и третичные
амины. Примеры аминов:
CH3−NH2 С6Н5−NH2 CH3−NH−CH3
метиламин фениламин (анилин) диметиламин триметиламин
первичные амины вторичный амин третичный амин
По химическим свойствам амины сходны с аммиаком. Как и аммиак в водных растворах амины проявляют свойства оснований. За счет свободной (неподеленной) пары электронов у атома азота молекулы аминов, подобно молекуле аммиака, могут присоединять протоны, отнимая их, например, от молекулы воды, в результате чего в растворах появляются гидроксид-ионы:
C2H5NH2 + H2O → [C2H5NH3]OH ↔ [C2H5NH3]+ + OH‾
Предельные амины более сильные основания, чем аммиак, т.к. углеводородные радикалы, обладая электродонорными свойствами, увеличивают электронную плотность на азоте, обеспечивая тем самым его большую способность к присоединению протона Н+. Третичные амины более сильные основания, чем вторичные, а вторичные сильнее первичных.
Основность ароматических аминов, в частности анилина С6Н5−NH2, меньше, чем у аммиака и предельных аминов, что обусловлено влиянием бензольного кольца. Свободная электронная пара атома азота частично втягивается в π-электронную систему бензольного кольца, а уменьшение электронной плотности на атоме азота снижает основные свойства анилина.
Таким образом, в ряду анилин, аммиак, метиламин, диметиламин, триметиламин основные свойства усиливаются.
