
- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
Карбоновые кислоты
Карбоновые кислоты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на карбоксильную группу
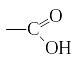
.
В карбоновых кислотах карбоксильная группа может быть соединена с различными углеводородными радикалами – предельными, непредельными, ароматическим. В связи с этим выделяют предельные, непредельные и ароматические карбоновые кислоты, например

С2Н5−СООН СН2=СН−СООН
пропановая кислота пропеновая кислота бензойная кислота
(предельная) (акриловая кислота) (непредельная) (ароматическая)
В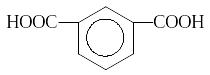 зависимости от числа карбоксильных
групп, содержащихся в молекулах карбоновых
кислот, различают одноосновные,
двухосновные и т.д. карбоновые кислоты:
зависимости от числа карбоксильных
групп, содержащихся в молекулах карбоновых
кислот, различают одноосновные,
двухосновные и т.д. карбоновые кислоты:
СН3−СООН НСОО−СООН
уксусная кислота щавелевая кислота терефталевая кислота
(одноосновная) (двухосновная) (двухосновная)
Одноосновные предельные карбоновые кислоты
Общая формула гомологического ряда предельных одноосновных кислот CnH2n+1COOH, n = 1,2,3…В табл. 3 приведены формулы некоторых кислот, их названия по заместительной номенклатуре и тривиальные названия.
Таблица 3
Некоторые предельные одноосновные кислоты
Формула |
Название |
|
по заместительной номенклатуре |
тривиальное |
|
НСООН |
Метановая |
Муравьиная |
СН3СООН |
Этановая |
Уксусная |
С2Н5СООН |
Пропановая |
Пропионовая |
С3Н7СООН |
Бутановая |
Масляная |
С4Н9СООН |
Пентановая |
Валериановая |
Свойства
Как и молекулы спиртов, молекулы карбоновых кислот ассоциированы за счет водородных связей:

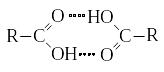
О собенности химических свойств карбоновых кислот обусловлены силь-
ным взаимным влиянием карбонильной и гидроксильной О−Н групп.
Поэтому все химические реакции карбоновых кислот будут идти по следующим направлениям:
1. Замещение водорода в гидроксильной группе. Карбоновые кислоты – слабые электролиты и взаимодействуют с активными металлами, оксидами и гидроксидами металлов с образованием солей:
2CH3COOH + Mg → Mg(CH3COO)2 + H2
уксусная кислота ацетат магния
2C2H5COOH + MgO → Mg(C2H5COO)2 + H2O
пропионовая кислота пропионат магния
C2H5COOH + NaOH → C2H5COONa + H2O
пропионовая кислота пропионат натрия
При сплавлении солей щелочных металлов карбоновых кислот со щелочами происходит расщепление углеродной цепи, в результате чего из углеводородного радикала кислоты образуется углеводород:
CH3−CH2−COONa + NaOH → CH3−CH2−CH3 + Na2CO3
2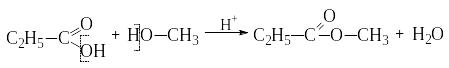 .
Замещение всей гидроксильной группы.
Карбоновые кислоты реагируют со спиртами
в присутствии сильных неорганических
кислот, в результате образуется сложный
эфир:
.
Замещение всей гидроксильной группы.
Карбоновые кислоты реагируют со спиртами
в присутствии сильных неорганических
кислот, в результате образуется сложный
эфир:
пропионовая метиловый метиловый эфир пропионовой кислоты
кислота спирт (метилпропионат)
3. Замещение водородных атомов в радикале. Атом водорода, расположенный у атома углерода, непосредственно связанного с карбоксильной группой, обладает повышенной подвижностью и легко замещается на галоген с образованием галогенозамещенных кислот:
СH3−СООН + Cl2 → СН2Cl−COOH + HCl
хлоруксусная кислота
Введение галогена в молекулу кислоты усиливает ее кислотные свойства: хлоруксусная кислота сильнее уксусной.
П ервый
член гомологического ряда карбоновых
кислот – муравьиная кислота НСООН –
в отличие от ее высших гомологов не
имеет в молекуле угле-
ервый
член гомологического ряда карбоновых
кислот – муравьиная кислота НСООН –
в отличие от ее высших гомологов не
имеет в молекуле угле-
водородного радикала .
В![]() место
него она содержит атом водорода, связанный
с карбонильной группой,
место
него она содержит атом водорода, связанный
с карбонильной группой,
т.е. в ее молекуле находится альдегидная группа
Вследствие этого муравьиная кислота отличается от других карбоновых кислот и по своим химическим свойствам. Например, она, как и альдегиды, вступает в реакцию серебряного зеркала с аммиачным раствором оксида серебра:
HCOOH + 2[Ag(NH3)2]OH → CO2 + 2 Ag + 4NH3 + 2H2O
