
- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
Простые эфиры
Простые эфиры – органические соединения, молекулы которых состоят из двух углеводородных радикалов, связанных атомом кислорода R−O−R/.
R и R/ − одинаковые или разные углеводородные радикалы. Примеры:
СН3−О−С2Н5 С2Н5−О−С2Н5
метилэтиловый эфир диэтиловый эфир
Общая формула гомологического ряда простых эфиров такая же, как и у спиртов CnH2n+2O. Это значит, что простые эфиры изомерны спиртам. Например, молекулярной формуле С2Н6О соответствуют два вещества: диметиловый эфир СН3−О−СН3 и этиловый спирт С2Н5ОН.
Простые эфиры образуются при нагревании спиртов с концентрированной серной кислотой. Так, этанол при нагревании с концентрированной серной кислотой при 140-150 0С дает диэтиловый эфир:
2C2H5OH С2Н5−О−С2Н5 + Н2О.
Карбонильные соединения
К арбонильные
соединения содержат в молекуле
карбонильную
группу−
арбонильные
соединения содержат в молекуле
карбонильную
группу−
. Карбонильные соединения делятся на альдегиды и кетоны.
Общая формула для альдегидов и кетонов одна и та же – CnH2nO.
Альдегиды и кетоны
В молекулах альдегидов карбонильная
группа соединена с углеводородным
радикалом и атомом водорода. Примеры
альдегидов:
молекулах альдегидов карбонильная
группа соединена с углеводородным
радикалом и атомом водорода. Примеры
альдегидов:


бутаналь 3-метил-2-хлорбутаналь 3,4-диметилпентаналь
В
 молекулах кетонов карбонильная группа
соединена с двумя одинаковыми или
разными радикалами R−CO−R/.
Примеры кетонов:
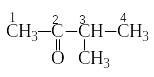
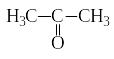
молекулах кетонов карбонильная группа
соединена с двумя одинаковыми или
разными радикалами R−CO−R/.
Примеры кетонов:
пропанон (ацетон) пентанон-3 3-метилбутанон-2
Химические свойства
Карбонильная группа обусловливает высокую реакционную способность альдегидов и кетонов. Для них характерны реакции:
1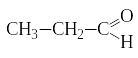 .
Присоединения.
В присутствии катализатора альдегиды
и кетоны присоединяют водород (по двойной
связи карбонильной группы) и
восстанавливаются: альдегиды – до
первичных спиртов, кетоны – до вторичных:
.
Присоединения.
В присутствии катализатора альдегиды
и кетоны присоединяют водород (по двойной
связи карбонильной группы) и
восстанавливаются: альдегиды – до
первичных спиртов, кетоны – до вторичных:
+ H2 CH3−CH2−CH2OH


+
Н2
![]()
2. Окисления. Альдегиды легко окисляются до органических кислот. Например, при окислении альдегидов аммиачным раствором оксида серебра образуется карбоновая кислота и происходит выделение металлического серебра.
Оно тонким блестящим слоем покрывает стенки сосуда, в котором проводилась реакция, поэтому данная реакция называется «реакцией серебряного зеркала» и
является качественной на альдегиды:

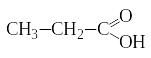
+ 2[Ag(NH3)2]OH → + 2Ag↓ + 4NH3 + H2O
пропаналь пропановая кислота
А льдегиды
окисляются также гидроксидом меди (II)
до красно-коричневого оксида меди (I):
льдегиды
окисляются также гидроксидом меди (II)
до красно-коричневого оксида меди (I):
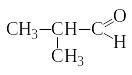
+ 2Cu(OH)2 → + Cu2O↓ + 2H2O
2-метилпропаналь изомасляная кислота
Кетоны окисляются значительно труднее альдегидов и только сильными окислителями. При этом происходит разрыв углеродной цепи и образование смеси продуктов. Кетоны не вступают в реакцию серебряного зеркала.
4
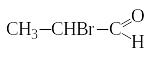 .
Взаимодействие
с галогенами.
Атом водорода, связанный с атомом
углерода, соединенным с карбонильной
группой, обладает повышенной подвижностью
и легко замещается на галоген:
.
Взаимодействие
с галогенами.
Атом водорода, связанный с атомом
углерода, соединенным с карбонильной
группой, обладает повышенной подвижностью
и легко замещается на галоген:
+ Br2 → + HBr
пропаналь α-бромпропаналь
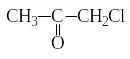
+ Cl2 → + НCl
П ервым
членом гомологического ряда альдегидов
является метаналь (му-
ервым
членом гомологического ряда альдегидов
является метаналь (му-
равьиный альдегид, или формальдегид) .
Формальдегид проявляет общие свойства альдегидов. Кроме того, имеет свои особенности. Так, большинство альдегидов под действием щелочей превращаются в смолы, а формальдегид при действии щелочи окисляется и восстанавливается одновременно, образуя метиловый спирт и соль муравьиной кислоты:
2СН2О + КОН → СН3ОН + НСООК
Формальдегид способен полимеризоваться с образованием полиформальдегида: nCH2O → (−CH2−O−)n
Формальдегид вступает в реакцию поликонденсации с фенолом с образованием фенолоформальдегидной смолы.
