
- •664074, Г. Иркутск, ул. Лермонтова, 83 дисперсные системы и поверхностные явления
- •Поверхностные явления
- •Дисперсные системы
- •Вопросы
- •1. Поверхностные явления и адсорбция
- •2. Дисперсные системы
- •3. Коллоидные растворы
- •4. Свойства коллоидных растворов
- •Аналитическая химия
- •Качественный химический анализ
- •Количественный анализ
- •Вопросы
- •1. Качественный химический анализ
- •2.Количественный анализ
- •3.Физико-химические и физические методы анализа
- •Органическая химия
- •Некоторые особенности органических соединений
- •Классификация органических соединений
- •Классификация химических реакций по механизму разрыва химической связи
- •Углеводороды
- •Алканы (предельные, или насыщенные, углеводороды)
- •Алкены (непредельные, или ненасыщенные, углеводороды ряда этилена, или олефины)
- •1. Реакции присоединения
- •Алкадиены (диеновые углеводороды)
- •Алкины (непредельные углеводороды ряда ацетилена)
- •Ароматические углеводороды
- •Гомологи бензола
- •Галогенопроизводные углеводородов
- •Спирты, фенолы, простые эфиры
- •Предельные одноатомные спирты
- •1. Реакции гидроксильного водорода
- •2. Реакции гидроксильной группы
- •Простые эфиры
- •Карбонильные соединения
- •Альдегиды и кетоны
- •Карбоновые кислоты
- •Одноосновные предельные карбоновые кислоты
- •Оксикислоты
- •Ароматические кислоты
- •Вопросы
- •1. Теория строения органических соединений
- •2. Углеводороды
- •3. Спирты и карбонильные соединения
- •4. Карбоновые кислоты и их производные
- •Высокомолекулярные соединения
- •Органические полимеры
- •Способы получения полимеров
- •Строение и свойства полимеров
- •Неорганические полимеры
- •Элементоорганические полимеры
- •Биополимеры
- •Вопросы
- •1. Органические и неорганические полимеры
- •2. Методы получения полимеров
- •3. Строение и свойства полимеров
- •4. Биополимеры
- •Библиографический список
- •Оглавление
1. Реакции гидроксильного водорода
а) Образование алкоголятов при взаимодействии с активными металлами (Na, K, Ca, Al, Mg):
2C2H5OH + 2Na → 2C2H5ONa + H2
б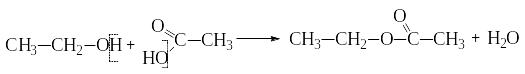 )
Образование сложных эфиров при
взаимодействии с органическими и
неорганическими кислотами:
)
Образование сложных эфиров при
взаимодействии с органическими и
неорганическими кислотами:
уксусноэтиловый эфир (этилацетат)
CH3OH
+ HO−NO2
↔ CH3−O−NO2
+ Н2О![]()
метилнитрат
2. Реакции гидроксильной группы
а) Замещение гидроксильной группы на галоген с образованием галогенопроизводных:
C2H5OH + HBr → C2H5Br + H2O
б) Дегидратация спиртов. Реакция дегидратации может быть внутримолекулярной и межмолекулярной. При внутримолекулярной дегидратации, которая идет в присутствии катализатора Al2O3 при температуре 380-400 0С, образуются алкены:
CH3−СН2−CH2−CH2ОН CH3−СН2−CH=CH2 + H2O
бутанол-1 бутен-1
Межмолекулярная дегидратация протекает с избытком спирта в присутствии концентрированной серной кислоты (водоотнимающее средство) при температуре 140-150 0С, что приводит к образованию простых эфиров:
C2H5OH
+ HOC2H5
![]() C2H5−O−C2H5+
H2O
C2H5−O−C2H5+
H2O
диэтиловый эфир
3 . Дегидрирование спиртов. При пропускании паров спиртов над катализатором при нагревании первичные и вторичные спирты теряют два атома водорода и превращаются соответственно в альдегиды и кетоны:
СH3−CH2−OH
![]() + Н2
+ Н2
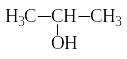 этанол
уксусный альдегид
этанол
уксусный альдегид
+ Н2
пропанол-2 диметилкетон (ацетон)
4 .
Окисление спиртов
с образованием альдегидов и кетонов:
.
Окисление спиртов
с образованием альдегидов и кетонов:

 СH3−CH2−OH
+ [O]
+ Н2О
СH3−CH2−OH
+ [O]
+ Н2О
+ [O] + Н2О
Третичные спирты более устойчивы к окислению. Только под действием сильных окислителей они могут окисляться с расщеплением углеродной цепи.
ФЕНОЛЫ
Фенолы – это органические соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца. Простейшим представителем фенолов является гидроксибензол или фенол, имеющий одну гидроксильную группу в бензольном кольце:
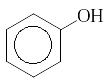
или С6Н5−ОН
Химические свойства фенолов определяются гидроксильной группой и связанным с ней бензольным кольцом.
Кислотные свойства. Под влиянием бензольного кольца полярность связи О−Н возрастает, поэтому подвижность атома водорода гидроксильной группы увеличивается. Этот атом способен к отщеплению в виде протона Н+, вследствие чего фенолы проявляют кислотные свойства и взаимодействуют со щелочными металлами и щелочами:
2 C6H5OH + 2 Na → 2 C6H5ONa + H2
C6H5OH + NaOH → C6H5ONa + H2O
Реакции замещения в бензольном кольце. Гидроксильная группа оказывает очень большое влияние на бензольное кольцо, увеличивая его реакционную способность. Поэтому фенол легко вступает в реакции электрофильного замещения (с ориентацией заместителей в о- и п-положения). Например, он легко бромируется бромной водой с образованием 2,4,6-трибромфенола, нитруется азотной кислотой с образованием тринитрофенола.
Качественная реакция на фенол. Фенол образует с FeCl3 комплексную соль, окрашенную в фиолетовый цвет.
